Autores: Lenita Zajdenverg, Cristina Figueiredo Sampaio Façanha, Patrícia Medici Dualib, Airton Golbert, Elaine Christine Dantas Moisés, Iracema de Mattos Paranhos Calderon, Rosiane Mattar, Rossana Pulcineli Vieira Francisco e Carlos Antonio Negrato.
Editor Chefe: Marcello Bertoluci
Última revisão em: 28/01/2022
DOI: 10.29327/557753.2022-11 | Cite este Artigo
Introdução
A disglicemia é a alteração metabólica mais comum na gestação. Estima-se que aproximadamente 16% dos nascidos vivos são gerados por mulheres que tiveram alguma forma de hiperglicemia durante a gravidez. Aproximadamente 8% dos casos são de mulheres com diabetes diagnosticada antes da gravidez.1 O aumento da prevalência de gestações em mulheres com diabetes (DM) pré-gestacional acompanha o incremento da frequência de DM1 e DM2 na população feminina em idade fértil.2
Além disso, desde que a consulta de pré-natal é frequentemente a primeira oportunidade de rastreamento do DM na mulher adulta, a hiperglicemia pode ser detectada pela primeira vez na gestação e deve ser diferenciada em duas categorias, segundo a Organização Mundial da Saúde (OMS): DM diagnosticado na gestação (do inglês overt diabetes) ou diabetes mellitus gestacional (DMG) 3 Figura 1
A pesquisa do DM na primeira consulta de pré-natal fornece oportunidade de reduzir o risco de anomalias congênitas, além de alertar para a necessidade de rastreamento e tratamento das complicações crônicas do DM em mulheres que desconheciam o diagnóstico. A definição de DM diagnosticado na gestação (overt diabetes) se dá pela presença de níveis glicêmicos que atingem critérios de DM fora da gestação na gestante sem diagnóstico prévio de DM. 3,4 Gestantes que apresentam a medida da HbA1c no primeiro trimestre que atinja o critério para DM fora da gestação (≥6,5%) deverão também ser categorizadas como tendo DM diagnosticado na gestação (overt diabetes) (Figura 1).
A forma mais prevalente de hiperglicemia na gestação é o DMG. O DMG é definido como uma intolerância aos carboidratos de gravidade variável, que se inicia durante a gestação porém não preenche critérios diagnósticos de DM fora da gestação.3 O DMG afeta de 3 a 25% das gestações, dependendo do grupo étnico e do critério diagnóstico utilizado.5
Figura 1: Classificação e critérios diagnósticos da hiperglicemia na gestação.4
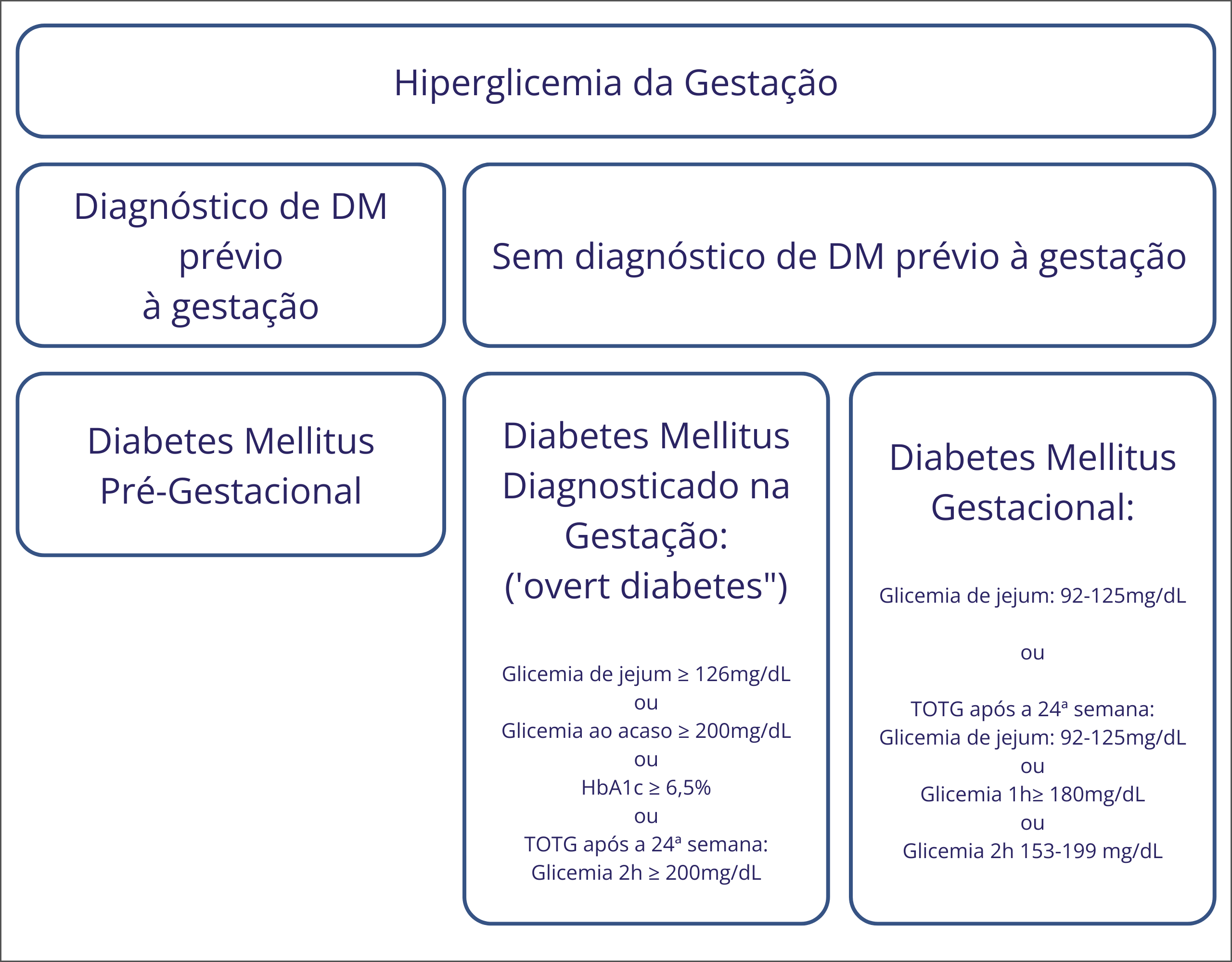
DM: Diabetes mellitus TOTG: Teste Oral de Tolerância à Glicose com 75 gramas de glicose anidra.
A incidência de DMG tem aumentado com o crescimento da obesidade na população feminina, em paralelo ao incremento da prevalência de DM2.6 Os principais fatores de risco para DMG encontram-se no Quadro 1.
Quadro 1: Fatores de risco para diabetes mellitus gestacional (DMG).4,7
| Quadro 1. Fatores de risco para diabetes mellitus gestacional (DMC). [4,7] |
|
Estudos também têm demonstrado outros fatores associados ao desenvolvimento de DMG como níveis séricos baixos de 25(OH) vitamina D8, idade da menarca antes de 11 anos9 e distúrbios do sono. Duração prolongada10 e má qualidade subjetiva do sono no início da gestação têm sido associados com aumento do risco de DMG.11
A hiperglicemia na gestação está associada ao risco de diversos desfechos adversos maternos e fetais (Quadro 2). É importante destacar que os riscos associados ao diabetes na gestação podem ser reduzidos com o planejamento adequado da gestação e a otimização do controle glicêmico ao longo de todo o período gravídico.12
Quadro 2: Complicações associadas à hiperglicemia na gestação.4
| Quadro 2. Complicações maternas e fatais | |
| PERINATAIS | |
| MATERNAS | FETAIS |
|
|
| FUTURAS | |
| MATERNAS | PROLE |
|
|
|
|
DM: Diabetes Mellitus; DMG: Diabetes Mellitus Gestacional
Recomendações
R1: Na primeira consulta pré-natal de gestantes sem conhecimento do diagnóstico prévio de DM, É RECOMENDADO solicitar uma glicemia plasmática de jejum, com o objetivo de detectar Diabetes (overt diabetes) e DMG precoce (Tabela 1).
| Classe I | Nível B |
- Revisão sistemática com metanálise comparou características clínicas e desfechos das gestações de mulheres que realizaram rastreamento e tratamento do DMG diagnosticado precocemente e gestantes diagnosticadas após a 24a semana de gestação. Observou-se que uma alta percentagem (15-70%) de DMG pode ser detectada no início da gestação, dependendo da população, dos critérios usados e da estratégia de triagem. Em 13 estudos observacionais, verificou-se que a mortalidade perinatal [RR 3,58 (IC 95% 1,91 a 6,71)], a hipoglicemia neonatal [RR 1,61 (IC 95% 1,02 a 2,55)] e a indicação de uso de insulina [RR 1,71 (IC 95% 1,45 a 2,03)] foram maiores em mulheres com DMG de início precoce.13 Esta população, portanto, apresenta maior risco de desfechos perinatais desfavoráveis.
Tabela 1 Interpretação dos valores da glicemia plasmática em jejum na primeira consulta do pré-natal.3,4
| Tabela 1. Glicemia em jejum na primeira consulta do pré-natal | |||
| Normal | DMG |
DM diagnosticado na gestação |
|
| Glicemia de jejum | <92 mg/dL |
≥92 e ≤125 mg/dL |
≥126 mg/dL |
| Glicemia ao acaso | NA | NA | ≥200 mg/dL |
| Ação |
Solicitar TOTG na 24-28 sem. |
Iniciar tratamento | Iniciar tratamento |
NA: Não aplicável, DMG: Diabetes Gestacional. DM: Diabetes Mellitus; TOTG: Teste Oral de Tolerância à Glicose
R2: Na primeira consulta pré-natal de gestantes sem conhecimento prévio de DM a solicitação adicional da hemoglobina glicada (HbA1c) PODE SER CONSIDERADA com o objetivo de diagnosticar DM (overt diabetes) ou detectar risco de desenvolver DMG (Tabela 2).
| Classe IIb | Nível B |
- O valor de HbA1c entre 5,7% e 6,4% no primeiro trimestre é importante fator de risco para o diagnóstico de DMG.14,15 Níveis de HbA1c ≥ 5.7% têm elevada especificidade diagnóstica (95%−98,4%). Entretanto, devido a baixa sensibilidade (14,5%-21%) não é considerado um método ideal de rastreamento do DMG.15
- Uma metanálise realizada por Renz PB et al, incluindo 8 estudos com 6406 gestantes, sendo 1044 com diagnóstico de DMG, também observou, independentemente do nível da HbA1c, uma boa especificidade, mas baixa sensibilidade para o diagnóstico de DMG (50,3% de sensibilidade e 83,7% de especificidade) quando a HbA1c igual a 5,4% e (12,9% de sensibilidade e 98,7% de especificidade) se HbA1c igual a 6,0%.16
- Revisão sistemática de 10 estudos que avaliaram a correlação de desfechos perinatais adversos com níveis de HbA1c no primeiro trimestre encontrou 4 estudos que mostraram o dobro do risco de pré-eclampsia, distócia de ombro, malformação congênita e morte perinatal quando HbA1c > 5,9%. Em 2 estudos foram encontrados aumento do risco de prematuridade e bebês GIG.15
- Em uma coorte incluindo 1228 mulheres de etnias variadas, Mañe et al. observaram que uma HbA1c acima de 5,9%, no início da gestação, está associada a um aumento de 3 vezes no risco de macrossomia ( IC 95%, 1.127 a 8.603, p = 0.028) e pré-eclâmpsia (IC 95%, 1.086 a 11.532, p = 0.036). A presença de HbA1c > 5,9% no início da gestação, identificou mulheres com alto risco de desfechos adversos, independentemente de diagnóstico posterior de DMG 17, sendo a HbA1c no primeiro trimestre considerada um melhor preditor de desfechos gestacionais adversos do que a glicemia de jejum.18
- Entretanto, o valor da HbA1c do primeiro trimestre para o diagnóstico de DMG é motivo de controvérsia. Um pequeno estudo randomizado incluiu 73 mulheres com HbA1c de 5,7 a 6,4%, com menos de 14 semanas de gestação para acompanhamento pré-natal de rotina ou tratamento para DMG com dieta, monitoramento de glicemia capilar e insulina, conforme necessário. O desfecho primário foi a prevenção do DMG diagnosticado através de um TOTG entre a 26a a 28a semanas, e os secundários incluíram parto cesárea, peso ao nascer, ganho de peso e mudança de HbA1c. Não houve diferença no desfecho primário (tratamento 45,2% vs. controle 56,1%; RR 0,80). Além disso, também não foram encontradas diferenças nos demais desfechos perinatais. Estudos maiores são necessários para esclarecer o papel da HbA1c como método diagnóstico do DMG.19
Tabela 2: Interpretação dos valores da HbA1c na primeira consulta do pré-natal
| Tabela 2. HbA1c na primeira consulta do pré-natal | |||
| Normal |
Risco aumentado de DMG |
DM diagnosticado na gestação (overt diabetes) |
|
| HbA1c | <5,7% | ≥5,7 e ≤6,4% | ≥6,5% |
| Ação: |
Solicitar TOTG 24-28 semana |
Iniciar tratamento | |
HbA1c: Hemoglobina glicada; TOTG: Teste Oral de Tolerância à Glicose
R3: O diagnóstico de DMG DEVE SER CONSIDERADO nas gestantes com glicemia plasmática em jejum de 92 a 125 mg/dL em qualquer momento da gestação (Tabela 1).
| Classe IIa | Nível B |
- As evidências são escassas e os achados controversos quanto aos desfechos perinatais associados a valores de glicemia de jejum de 92 a 125 mg/dl no primeiro trimestre. Apesar disso, a OMS em 2013 e o consenso brasileiro da SBD/FEBRASGO/OPAS adotado pelo Ministério da Saúde sobre rastreamento e diagnóstico do diabetes na gravidez de 2017 indicam que o diagnóstico de DMG deve ser feito nas gestantes que apresentem medida da glicemia de jejum no primeiro trimestre de 92 mg/dL a 125 mg/dL (Tabela 1).4
- A glicemia de jejum, especialmente em gestantes sem obesidade, diminui aproximadamente 9 mg/dL entre o final do primeiro trimestre e o início do segundo trimestre.20 Por isso, deve-se levar em consideração que o uso da glicemia de jejum próximo ao valor de corte de 92 mg/dL, principalmente em mulheres sem fatores de risco para DMG, pode superestimar o diagnóstico de disglicemia.
- Por outro lado, estudos associam glicemia de jejum aumentada, mesmo abaixo dos níveis considerados para o diagnóstico de DM fora da gestação com risco aumentado de desfechos perinatais adversos. Estudo retrospectivo de dados prospectivos que incluiu 27.198 gestantes sem DM prévio teve como objetivo avaliar os desfechos gestacionais de mulheres que apresentavam medida de glicemia de jejum de primeiro trimestre (n= 6150). As pacientes foram separadas em quartis dos valores da glicemia de jejum (≤ 78; 79-83; 84-87 e ≥ 88 mg/dL). A glicemia de jejum foi preditora de risco para desenvolvimento de DMG (7%; 8%; 10.2% e 16% para cada quartil, respectivamente, p < 0,001). A glicemia de jejum também se associou significativamente com o nascimento de bebês GIG (8,2%; 9,3%; 10% e 11,7% para cada quartil, respectivamente, p = 0,011). Não houve associação com outros desfechos obstétricos.21
- A avaliação de 6129 mulheres, em média, na nona semana de gestação e com os níveis de glicemia de jejum divididos em sete categorias, <75; 75–79; 80–84; 85–89; 90–94; 95–99; e 100–105 mg/dl, encontrou relação entre o aumento da glicemia no primeiro trimestre com o desenvolvimento de DMG, bebês GIG e/ou macrossômicos e realização de parto cesárea. A frequência de desenvolvimento de DMG no segundo trimestre aumentou de 1,0% na categoria de glicose mais baixa para 11,7% na mais alta [OR 11,92 (IC 95% 5,39 a 26,37)]; a frequência de neonatos GIG e/ou macrossômicos aumentou de 7,9 para 19,4% [OR 2,82 (IC 95% 1,67 a 4,76)] e taxa de cesárea primária aumentou de 12,7 para 20,0% [OR 1,94 (IC 95% 1,11 a 3,41)].22
R4: Para todas as gestantes sem diagnóstico prévio de DM, independentemente da presença de fatores de risco, É RECOMENDADO que a investigação diagnóstica do DMG seja feita entre a 24ª e 28ª semana de gestação, através da realização de um teste de tolerância oral à glicose, com medida da glicose plasmática em jejum, 1 e 2 horas após a ingestão de 75 g de glicose anidra.
| Classe I | Nível B |
- Estudo de revisão sistemática da base de dados Cochrane, mostrou que o rastreamento universal do DMG é capaz de diagnosticar uma maior proporção de gestantes quando comparado ao rastreamento feito apenas em mulheres que apresentem fatores de risco (RR 1.85, 95%CI 1.12 a 3.04).23 O DMG é uma patologia assintomática, portanto, a identificação de gestantes que necessitam de tratamento é fundamental uma vez que a intervenção adequada do DMG resulta em melhores desfechos da gestação.12
- O estudo observacional Hyperglycemia and Adverse Pregnancy Outcomes (HAPO), teve como objetivo encontrar um ponto de corte que ligasse a hiperglicemia materna a eventos perinatais adversos. O estudo incluiu 25.505 gestantes de diversas etnias sem DM prévio, de 15 centros, de nove países, que realizaram teste de tolerância oral à glicose (TOTG) entre a 24ª e 32ª semana de idade gestacional. Foram encontradas associações contínuas e lineares dos níveis de glicemia materna com aumento do peso ao nascer e dos níveis de peptídeo C no cordão umbilical independentemente da presença de outros fatores de risco.24
Nota importante 1: Recomendações para o TOTG
- Para aumentar a reprodutibilidade do método, o TOTG deve ser precedido por dieta sem restrição de carboidratos ou com, no mínimo, ingestão diária de 150 g de carboidratos durante os 3 dias anteriores ao teste e com jejum de 8 horas.26
R5: É RECOMENDADO que o diagnóstico de DMG seja estabelecido entre a 24a e a 28a semana de idade gestacional, através do teste de tolerância oral à glicose com 75g, quando pelo menos 1 dos valores de glicemia a seguir esteja presente: jejum ≥92 e < 126 mg/dL; 1 hora ≥ 180 mg/dl; 2 horas ≥153 e <200 mg/dL.
| Classe I | Nível B |
- Em 2010, utilizando-se os achados do estudo HAPO, a International Association of Diabetes and Pregnancy Study Groups (IADPSG) sugeriu que os critérios diagnósticos do DMG deveriam basear-se em valores de glicemia que aumentassem em 75% ou mais o risco de desenvolver as seguintes complicações perinatais encontradas no estudo: peso ao nascer acima do percentil 90, parto cesárea, hipoglicemia neonatal e níveis de peptídeo C no cordão umbilical acima do percentil 90. Foram propostos, os seguintes pontos de corte no TOTG: (glicemias em jejum, 1 e 2 horas) ≥ 92 mg/dL; ≥ 180 mg/dL e ≥ 153 mg/dL, respectivamente. Todos os valores de glicemia nos diferentes momentos do TOTG se associaram de forma independente com os desfechos estudados, portanto a IADPSG definiu que apenas um valor anormal leva ao diagnóstico de DMG (Tabela 3).25
Tabela 3: Valores da glicemia no TOTG com 75 gramas de glicose entre a 24a e 28a para o diagnóstico de DMG.3,4
| Tabela 3. Glicemia no TOTG com 75 gramas de glicose anidra | |
| Tempo | Glicemia plasmática* |
| Jejum | ≥ 92 e < 126 mg/dL |
| 1 hora | ≥ 180mg/dL |
| 2 horas | ≥ 153 e < 200 mg/dL |
R6: No rastreamento do DMG, após a 24a semana, quando o valor da glicemia de 2h no teste de tolerância oral à glicose com 75g estiver ≥ 200 mg/dL DEVE SER CONSIDERADO a presença de DM diagnosticado na gestação (overt diabetes) e não de DMG.
| Classe IIa | Nível B |
- Em 2013, a OMS endossou o uso dos pontos de corte sugeridos pela IADPSG para o diagnóstico de DMG destacando, entretanto, que caso a glicemia após sobrecarga ≥ 200 mg/dL seria definida a presença de DM diagnosticado na gestação (overt diabetes), e não de DMG.3
- Um estudo retrospectivo de coorte longitudinal avaliou comparativamente os desfechos de 1579 mulheres com DMG e de 254 com DM diagnosticado na gravidez (overt diabetes). As gestantes com DM diagnosticado na gravidez (overt diabetes) tinham mais fatores de risco associados ao DM como maior IMC. Além disso, elas necessitaram mais frequentemente fazer uso de insulina 49,2% versus 25,1% [RR 2,0 (IC 95% 1,7 a 2,3)] e em doses maiores quando comparadas com as mulheres com DMG. O OR ajustado de bebês GIG foi de [RR 1,55 (IC 95% 1,02 a 2,38)]. Hipoglicemia neonatal e distócia de ombro foram também mais frequentes neste grupo.27
- Neste mesmo estudo, a avaliação do subgrupo de 133 pacientes com DM diagnosticado na gravidez (overt diabetes) que realizaram o TOTG 75 g no primeiro ano pós-parto, 28 (21,1%) apresentaram resultados compatíveis com o diagnóstico de DM, 50 (37,6%) apresentaram intolerância à glicose ou glicemia de jejum alterada e 55 (41,4%) apresentaram exame dentro da normalidade. O DM diagnosticado na gestação não foi, portanto, bom preditor de diagnóstico de DM após o período gestacional.27
R7: Em mulheres com disglicemia na gestação, É RECOMENDADO a pronta implementação da terapêutica para controle glicêmico adequado.
| Classe I | Nível A |
- Em uma meta-análise que incluiu 21 estudos de coorte populacional e dados de 6685 mulheres com DM1, DM2 prévios e DMG, observou-se que comparado com mulheres com DM que não receberam intervenção, o tratamento do diabetes na gestação reduz de forma significativa o risco de malformações congênitas, morte perinatal, recém-natos GIG e hipoglicemia neonatal (76,3%; 54,3%; 20,6%, e 32,8%, respectivamente). A intervenção não levou ao aumento no risco de nascimento de bebês pequenos para a idade gestacional [RR 0,597 (IC 95% 0,35 a 1.00); I2 = 0,0%, p = 0,695.28
- Uma metanálise que avaliou 10 estudos que incluíram dados de 3.317 mulheres com DMG consideradas de menor gravidade devido a níveis pouco alterados da glicemia em jejum e/ou no TOTG comparadas com 4.407 gestantes com DMG que não receberam tratamento específico mostrou que a intervenção, mesmo em casos menos graves de DMG, foi associada a significativa redução do risco de macrossomia [OR 0,3 (IC 95% 0,3 a 0,4)], bebês GIG [OR 0,4 (IC 95% 0,3 a 0,5)], distócia de ombro [OR 0,3 (IC 95% 0,2 a 0,6)], parto cesárea [OR 0,8 (IC 95% 0,7 a 0,9)], pré-eclampsia [OR 0,4 (IC 95% 0,3 a 0,6)], dosagem de peptídeo C no cordão umbilical [OR 0,7 (IC 95% 0,6 a 0,9)], e síndrome da angústia respiratória [OR 0,7 (IC 95% 0,5 a 0,9)]. Além disso, não foi encontrada diferença entre os grupos no risco de nascimento de bebês pequenos para idade gestacional, mostrando que a intervenção com objetivo de manter o controle glicêmico é considerada segura.29
- Em situações de viabilidade financeira e disponibilidade técnica total, todas as gestantes com glicemia de jejum inferior a 92 mg/dL devem realizar o TOTG com 75g de glicose entre a 24a e 28a semanas de idade gestacional. Se o início do pré-natal for tardio deve-se realizar o TOTG com a maior brevidade possível. Estima-se que assim sejam detectados aproximadamente 100% dos casos (Figura 2).4
- Em locais onde há restrição financeira ou disponibilidade técnica parcial todas as gestantes devem realizar a glicemia de jejum no início do pré-natal para diagnóstico de DMG e de DM diagnosticado na gestação. Caso o resultado do exame apresente valores inferiores a 92 mg/dL, antes da 24a semana de idade gestacional, deve-se repetir a glicemia de jejum entre a 24a e 28a semanas. Estima-se que assim sejam detectados 86% dos casos (Figura 3).30
Nota importante 2: Critérios unificados
- Em 2017, a Sociedade Brasileira de Diabetes (SBD) juntamente com a Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), com a Organização Pan-americana de Saúde (OPAS) e com o Ministério da Saúde do Brasil definiram uma proposta conjunta de padronização do rastreamento e diagnóstico do DMG no país. Os critérios brasileiros foram adaptados dos critérios da OMS3, considerando-se as particularidades do Brasil, onde a disponibilidade de recursos de saúde se distribui de forma irregular. O consenso brasileiro de diagnóstico do DMG propõe estratégia alternativa para o diagnóstico de DMG na população onde existem restrições de recursos em saúde.4
Figura 2: Fluxograma do diagnóstico de DMG em locais com situação de viabilidade financeira e disponibilidade técnica total.4

Figura 3: Fluxograma do diagnóstico de DMG em locais com situação de viabilidade financeira e disponibilidade técnica parcial.4
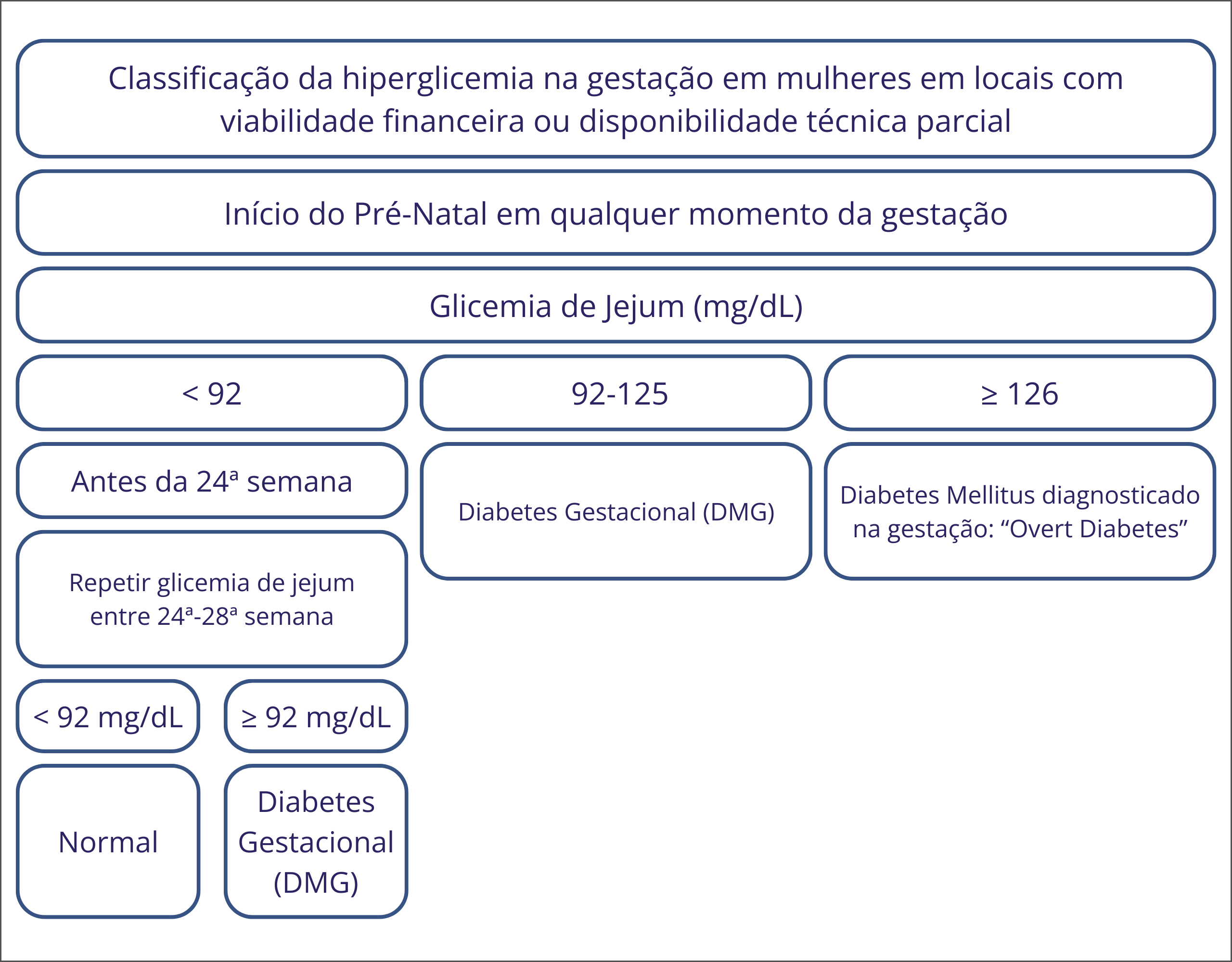
Tabela de Recomendações
| RECOMENDAÇÃO | CLASSE | NÍVEL |
| R1: Na primeira consulta pré-natal de gestantes, sem conhecimento do diagnóstico prévio de DM, É RECOMENDADO solicitar uma glicemia plasmática de jejum, com o principal objetivo de detectar DM (overt diabetes) e DMG precoce. | I | B |
| R2: Na primeira consulta pré-natal de gestantes sem conhecimento prévio de DM a solicitação adicional da HbA1c PODE SER CONSIDERADA com o objetivo de diagnosticar DM (overt diabetes) ou detectar risco de desenvolver DMG. | IIb | B |
| R3: O diagnóstico de DMG DEVE SER CONSIDERADO nas gestantes com glicemia plasmática em jejum de 92 a 125 mg/dL em qualquer momento da gestação | IIa | B |
| R4: Para todas as gestantes sem diagnóstico prévio de DM, independentemente da presença de fatores de risco, É RECOMENDADO que a investigação diagnóstica do DMG seja feita entre a 24ª e 28ª semana de gestação, através da realização de um TOTG, com medida da glicose plasmática em jejum, 1 e 2 horas após a ingestão de 75 g de glicose anidra. | I | B |
| R5: É RECOMENDADO que o diagnóstico de DMG seja estabelecido entre a 24a e a 28a semana de idade gestacional, através do TOTG com 75g, quando pelo menos 1 dos valores de glicemia a seguir esteja presente: jejum ≥92 e < 126 mg/dL; 1 hora ≥ 180 mg/dl; 2 horas ≥153 e <200 mg/dL | I | B |
| R6: No rastreamento do DMG, após a 24a semana, quando o valor da glicemia de 2h no TOTG com 75 g estiver ≥ 200 mg/dL DEVE SER CONSIDERADO a presença de DM diagnosticado na gestação (overt diabetes) e não DMG. | IIa | B |
| R7: Em mulheres com disglicemia na gestação É RECOMENDADO a pronta implementação da terapêutica para controle glicêmico adequado. | I | A |
Referências
- International DiabetesFederation. IDF Diabetes Atlas,9th ed. Brussels [Internet]. Brussels, Belgium; 2019. Available from: https://www.diabetesatlas.or
- Bardenheier BH, Imperatore G, Devlin HM, Kim SY, Cho P, Geiss LS. Trends in Pre-Pregnancy Diabetes Among Deliveries in 19 U.S. States, 2000−2010. Am J Prev Med [Internet]. 2015;48(2):154–61.
- WHO. Diagnostic criteria and classification of hyperglycemia first detected in pregnancy: A World Health Organization Guideline. WHO, editor. Diabetes Res Clin Pract [Internet]. 2014 Mar;103(3):341–63. Available from: http://www.ncbi.nlm.nih.gov/books/nbk169024/
- Organização Pan-Americana da Saúde. Ministério da Saúde. Federação Brasileira das Associações de Ginecologia e Obstetrícia. Sociedade Brasileira de Diabetes. Rastreamento e diagnóstico de diabetes mellitus gestacional no Brasil. Vol. 1, Sociedade Brasileira de Diabetes. Brasília; 2017. 1–36 p. Available from: https://www.diabetes.org.br
- Guariguata L, Linnenkamp U, Beagley J, Whiting DR, Cho NH. Global estimates of the prevalence of hyperglycemia in pregnancy. Diabetes Res Clin Pract. 2014;103(2):176–85.
- Zhu Y, Zhang C. Prevalence of Gestational Diabetes and Risk of Progression to Type 2 Diabetes: a Global Perspective. Curr Diab Rep. 2016 Jan 7;16(1):7.
- Hod M, Kapur A, Sacks DA, Hadar E, Agarwal M, Di Renzo GC, et al. The International Federation of Gynecology and Obstetrics (FIGO) Initiative on gestational diabetes mellitus: A pragmatic guide for diagnosis, management, and care. Int J Gynecol Obstet. 2015;131:S173–211.
- Sadeghian M, Asadi M, Rahmani S, Akhavan Zanjani M, Sadeghi O, Hosseini SA, et al. Circulating vitamin D and the risk of gestational diabetes: a systematic review and dose-response meta-analysis. Endocrine. 2020; 24;70(1):36–47.
- Sun X, Yang L, Pan J, Yang H, Wu Y, Chen Z, Chen X, Mu L. Age at menarche and the risk of gestational diabetes mellitus: a systematic review and meta-analysis. Endocrine. 2018;61(2):204-209. doi: 10.1007/s12020-018-1581-9. Epub 2018 Mar 20. PMID: 29556913.
- Xu Y-H, Shi L, Bao Y-P, Chen S-J, Shi J, Zhang R-L, et al. Association between sleep duration during pregnancy and gestational diabetes mellitus: a meta-analysis. Sleep Med. 2018;52:67–74.
- Zhu B, Shi C, Park CG, Reutrakul S. Sleep quality and gestational diabetes in pregnant women: a systematic review and meta-analysis. Sleep Med. 2020;67:47–55.
- Falavigna M, Schmidt MI, Trujillo J, Alves LF, Wendland ER, Torloni MR, et al. Effectiveness of gestational diabetes treatment: a systematic review with quality of evidence assessment. Diabetes Res Clin Pract. 2012;98(3):396–405.
- Immanuel J, Simmons D. Screening and Treatment for Early-Onset Gestational Diabetes Mellitus: a Systematic Review and Meta-analysis. Curr Diab Rep. 2017; 2;17(11):115. doi: 10.1007/s11892-017-0943-7. PMID: 28971305.
- Arbib N, Shmueli A, Salman L, Krispin E, Toledano Y, Hadar E. First trimester glycosylated hemoglobin as a predictor of gestational diabetes mellitus. Int J Gynaecol Obstet. 2019 12;145(2):158–63.
- Kattini R, Hummelen R, Kelly L. Early Gestational Diabetes Mellitus Screening With Glycated Hemoglobin: A Systematic Review. J Obstet Gynaecol Canada. 2020;42(11):1379–84.
- Renz PB, Chume FC, Timm JRT, Pimentel AL, Camargo JL. Diagnostic accuracy of glycated hemoglobin for gestational diabetes mellitus: a systematic review and meta-analysis. Clin Chem Lab Med. 2019 25;57(10):1435–49.
- Mañé L, Flores-Le Roux JA, Benaiges D, Rodríguez M, Marcelo I, Chillarón JJ, et al. Role of first trimester HbA1c as a predictor of adverse obstetric outcomes in a multi-ethnic cohort. J Clin Endocrinol Metab. 2017;102(2):390-397. doi: 10.1210/jc.2016-2581.
- Mañé L, Flores-Le Roux JA, Pedro-Botet J, Gortazar L, Chillarón JJ, Llauradó G, et al. Is fasting plasma glucose in early pregnancy a better predictor of adverse obstetric outcomes than glycated haemoglobin? Eur J Obstet Gynecol Reprod Biol. 2019;234:79–84. 17.
- Osmundson SS, Norton ME, El-Sayed YY, Carter S, Faig JC, Kitzmiller JL. Early Screening and Treatment of Women with Prediabetes: A Randomized Controlled Trial. Am J Perinatol. 2016 Jan;33(2):172-9. doi: 10.1055/s-0035-1563715.
- Mills JL, Jovanovic L, Knopp R, Aarons J, Conley M, Park E et al. Physiological reduction in fasting plasma glucose concentration in the first trimester of normal pregnancy: the diabetes in early pregnancy study. Metabolism 1998; 47(9):1140- 1144.
- Sesmilo G, Prats P, Garcia S, Rodríguez I, Rodríguez-Melcón A, Berges I, Serra B. First-trimester fasting glycemia as a predictor of gestational diabetes (GDM) and adverse pregnancy outcomes. Acta Diabetol. 2020;57(6):697-703. doi: 10.1007/s00592-019-01474-8.
- Riskin-Mashiah S, Younes G, Damti A, Auslender R. First-trimester fasting hyperglycemia and adverse pregnancy outcomes. Diabetes Care. 2009;32(9):1639-43. doi: 10.2337/dc09-0688.
- Tieu J, McPhee AJ, Crowther CA, Middleton P, Shepherd E. Screening for gestational diabetes mellitus based on different risk profiles and settings for improving maternal and infant health. Cochrane database Syst Rev. 2017 Aug 3;8:CD007222.
- HAPO Study Cooperative Research Group, Metzger BE, Lowe LP, Dyer AR, Trimble ER, Chaovarindr U, Coustan DR, Hadden DR, McCance DR, Hod M, McIntyre HD, Oats JJ, Persson B, Rogers MS, Sacks DA. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med. 2008;358(19):1991-2002. doi: 10.1056/NEJMoa0707943.
- International Association of Diabetes and Pregnancy Study Groups Consensus P, Metzger BE, Gabbe SG, Persson B, Buchanan TA, Catalano PA, et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes care. 2010;33:676-82.
- Rosenberg EA, Seely EW, James K, Arenas J, Callahan MJ, Cayford M, Nelson S, Bernstein SN, Thadhani R, Powe CE. Relationship between carbohydrate intake and oral glucose tolerance test results among pregnant women. Diabetes Res Clin Pract. 2021;176:108869. doi: 10.1016/j.diabres.2021.108869.
- Wong T, Ross GP, Jalaludin BB, Flack JR. The clinical significance of overt diabetes in pregnancy. Diabet Med. 2013;30(4):468-74.
- Xie GH, Zheng Z, Liu TC, Qing LL, Hong XQ, Zha WT, Lv Y. Health care and risk of adverse pregnancy outcomes among diabetic women: an updated meta-analysis. Arch Gynecol Obstet. 2019;299(3):891-899. doi: 10.1007/s00404-019-05042-x.
- Behboudi-Gandevani S, Bidhendi-Yarandi R, Panahi MH, Vaismoradi M. The Effect of Mild Gestational Diabetes Mellitus Treatment on Adverse Pregnancy Outcomes: A Systemic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2021 26;12.
- Trujillo J, Vigo A, Reichelt A, Duncan BB, Schmidt MI. Fasting plasma glucose to avoid a full OGTT in the diagnosis of gestational diabetes. Diabetes Res Clin Pract. 2014;105(3):322–6.
Cite este artigo
Zajdenverg L, Façanha C, Dualib P, Golbert A, Moisés E, Calderon I, Mattar R, Francisco R, Negrato C, Bertoluci M. Rastreamento e diagnóstico da hiperglicemia na gestação. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-11, ISBN: 978-85-5722-906-8.

