Autores: Luiz Clemente Rolim, Patrícia J Thyssen, Ronald LG Flumignan, Daniel Ciampi de Andrade, Sérgio Atala Dib
Editor Chefe: Marcello Bertoluci
Ultima revisão em: 03/03/2022
DOI: 10.29327/557753.2022-14 | Cite este Artigo
Introdução
As neuropatias diabéticas (ND) constituem a complicação crônica mais prevalente, subdiagnosticada e subtratada do diabetes mellitus (DM). A neuropatia periférica diabética (NPD) é uma complicação precoce, polimórfica e furtiva1 em que, pelo menos, metade dos indivíduos permanece assintomática por muitos anos, enquanto a outra metade manifesta-se com dor neuropática aguda ou crônica (menos ou mais de 3 meses de evolução, respectivamente), reconhecida como neuropatia periférica diabética dolorosa (NPDD).2
A prevalência da NPD na população geral é de 49%,4 variando entre 12% nos indivíduos com pré-DM, até 90% nas pessoas com DM, candidatas a transplante renal.5 Estima-se que, até 25% das das pessoas com DM sofram de NPDD.
A NPD apresenta implicações importantes nos custos de saúde pública.2 Evidências recentes apontam uma relação direta entre os determinantes sociais da saúde nas suas três vertentes (social, econômica e ambiental) e o risco de NPD.7Assim, para reduzir o ônus resultante da NPD e suas sequelas (entre outras, o pé diabético), é imperativa a implementação de estratégias para sua detecção precoce e prevenção nos planos nacionais de cuidados com DM. 19,21
Conceito e classificação
O conceito da ND na literatura é definido pela presença de sintomas ou sinais de disfunção dos nervos, de forma difusa ou focal, em pessoas com DM, após a exclusão de outras causas. Já o conceito de neuropatia periférica diabética (NPD), a forma mais comum de ND, refere-se à doença como uma “lesão difusa, simétrica, distal e progressiva das fibras sensitivo-motoras e autonômicas, causadas pela hiperglicemia crônica e por fatores de risco cardiovasculares”.6
A NPDD caracteriza-se por dor neuropática na área corpórea afetada pela neuropatia, que piora com repouso, durante o sono, e melhora com atividade física. A dor crônica traz impacto negativo na qualidade de vida, no humor e na funcionalidade de pessoas com diabetes, causando comorbidades graves, como insônia, ansiedade, depressão e perda de funcionalidade.3
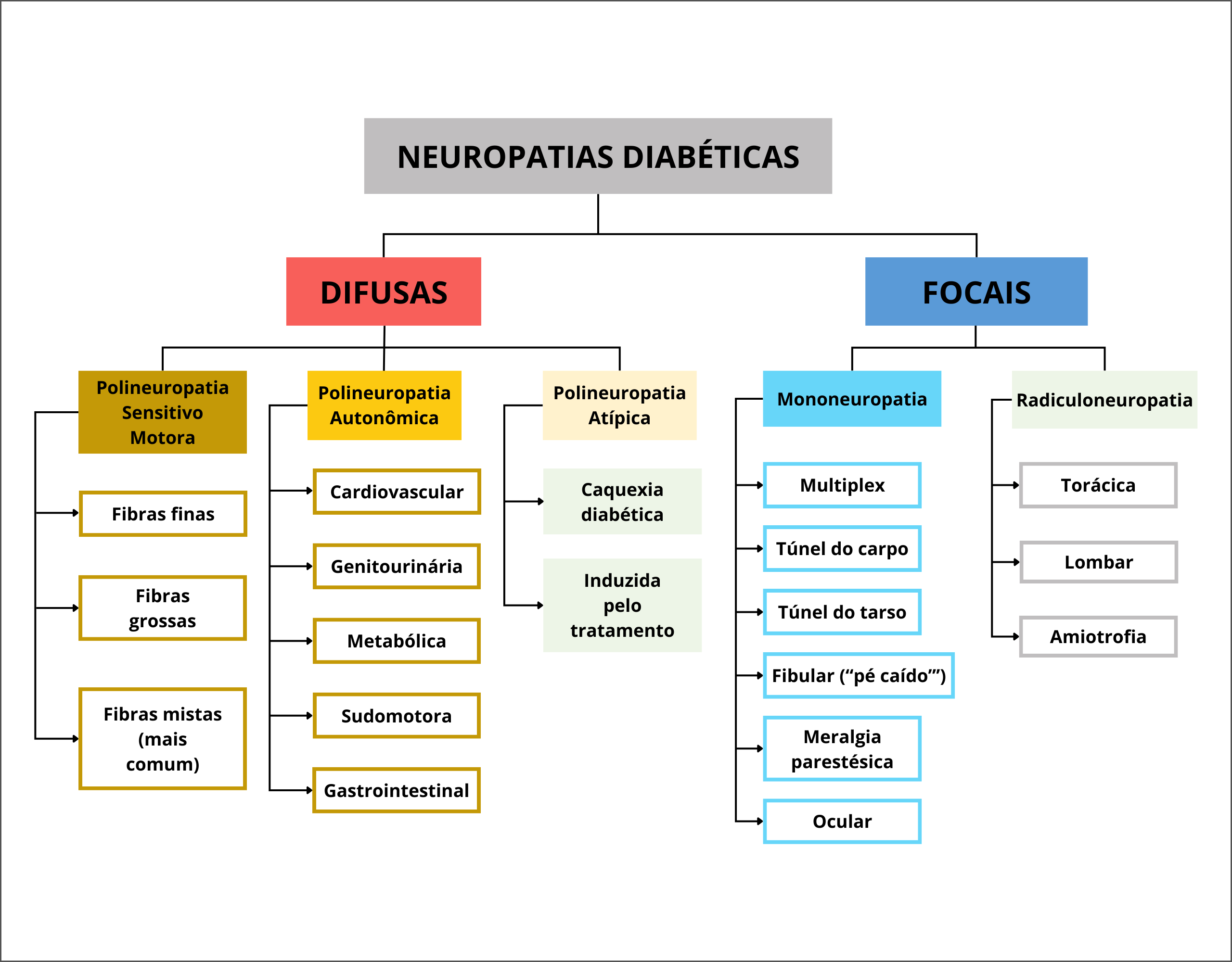
Na literatura e nas diretrizes a seguir formuladas, o termo NPD é empregado como sinônimo de neuropatia sensitivo motora e/ou de polineuropatia diabética. A Figura 1 mostra a classificação atual das neuropatias diabéticas.
Figura 1. Classificação das neuropatias diabéticas.
Figura 1. Classificação atual das neuropatias diabéticas (ND).
Fonte: Adaptada de Feldman et al. 1 e Pop-Busui et al.2
Rastreamento e diagnóstico
Em indivíduos com DM, o diagnóstico da NPD é essencialmente clínico e baseia-se na presença de dois ou mais testes ou sinais neurológicos alterados. Deve ser firmado após a exclusão de outras causas, independentemente dos sintomas.1–2Para melhor acurácia diagnóstica, o ideal é que a metodologia a ser utilizada tenha a capacidade de avaliar tanto as fibras nervosas finas, (mais precocemente acometidas, incluindo sensibilidade térmica, dolorosa e função sudomotora) e fibras nervosas grossas (reflexos tendíneos, sensibilidade vibratória, tátil e de posição).
O diagnóstico da NPD é de exclusão, e as neuropatias não diabéticas associadas à deficiência de vitamina B12, etilismo, hipotiroidismo, síndrome do túnel do carpo, excesso de vitamina B6 ou drogas, substâncias neurotóxicas e metais pesados devem ser consideradas, pois podem ocorrer concomitantemente nos indivíduos diabéticos.1 A tabela 1 mostra os principais testes, tanto para rastreio, quanto para diagnóstico da NPD.
Tabela 1. Testes para rastreio e escalas para diagnóstico da NPD: sensibilidade, especificidade e tipo de fibra avaliada.
|
Tabela 1. Escalas para rastreamento e diagnóstico da NPD: sensibilidade, especificidade e tipo de fibra avaliada. |
|||
| Testes (Rastreio) |
Sensibilidade (%) |
Especificidade (%) |
Tipo de fibra avaliada |
| Fibras grossas | |||
| DPN-Check | 95 | 71 | Grossas |
| Biotesiômetro | 61 a 80 | 64 a 76 | Grossas |
| Monofilamento 10 g | 19 a 59 | 64 a 87 | Grossas |
| Diapasão | 1 a 19 | 87 a 89 | Grossas |
| Fibras finas e grossas | |||
|
Escore de Toronto modificado |
98 | 97 |
Finas e grossas |
|
Escore de comprometimento neuropático (ECN/NDS) |
89 | 100 |
Finas e grossas |
| Escore de Michigan (MDNS) | 80 | 100 |
Finas e grossas |
| Fibras finas | |||
| NeuroPad | 86 a 89 | 60 a 65 | Finas |
Tabela 2. Escore de comprometimento neuropático (ECN/NDS*) para diagnóstico precoce da NPD.
| Escore de Comprometimento Neuropático (ECN/NDS) | ||
| Teste | Direira | Esquerda |
| Sensibilidade Vibratória - 128 Hz |
Preservada: 0 Alterada: 1 |
Preservada: 0 Alterada: 1 |
| Sensibilidade Térmica |
Preservada: 0 Alterada: 1 |
Preservada: 0 Alterada: 1 |
| Dor Superficial |
Ausente: 0 Presente: 1 |
Ausente: 0 Presente: 1 |
| Reflexo Aquileu |
Normal: 0 Presente com reforço: 1 Ausente: 2 |
Normal: 0 Presente com reforço: 1 Ausente: 2 |
| INTERPRETAÇÃO | ||
| SOMA BILATERAL DOS PONTOS | GRAU DE NEUROPATIA | |
| 0-2 | Ausente | |
| 3-5 | Leve | |
| 6-8 | Moderada | |
| 9-10 | Severa | |
*NDS: Neuropathy Disabilty Score. A simples associação de sintomas neuropáticos com DM não é suficiente para diagnóstico da NPD.
Rastreamento
Todos os pacientes com DM devem ser examinados para pesquisa da neuropatia periférica diabética no momento do diagnóstico de DM2 e cinco anos após o diagnóstico de DM1. Pacientes cujo rastreamento foi negativo devem ser reavaliados anualmente.2 Na prática clínica, os melhores testes para rastreamento são o biotesiômetro e a sensibilidade térmica. Já, para o diagnóstico definitivo da NPD, a SBD recomenda o Escore de Comprometimento Neuropático (ECN), esquematizado na Tabela 2.
Nota importante 1: Situações especiais para rastreamento
- Pacientes com pré-diabetes que apresentem sintomas neuropáticos devem ser avaliados para verificar possível presença de NPD de fibras finas.5
- Pacientes com neuropatia essencial (criptogenética) devem ser submetidos a um teste oral de tolerância à glicose (TOTG) para diagnóstico de pré-DM.
Nota importante 2: Uso do monofilamento 10g
- O uso do monofilamento de 10 g deve ser utilizado com cautela para o rastreio da neuropatia precoce em razão de sua baixa sensibilidade, porém pode ser considerado para triagem do pé diabético (pé em risco de úlcera).
Nota importante 3: Novos testes para NPD
3.1 DPN-Check
- O DPN-Check é um dispositivo portátil para estudos de condução nervosa que pode ser considerado para o rastreamento da NPD, por seu caráter não invasivo, fácil aplicabilidade e rapidez.
- Trata-se de um teste de condução nervosa que fornece a amplitude de onda e a velocidade de condução nervosa do nervo sural em cinco minutos, sem a necessidade de um eletrofisiologista ou equipamento dispendioso.
- O dispositivo estimula o nervo sural ortodromicamente com ondas distais, e opera usando um biossensor cobrindo ampla área do membro inferior proximalmente.
- Entretanto, não encontramos nenhuma revisão sistemática sobre a acurácia diagnóstica do DPN-Check, até o momento, embora um estudo primário com 44 participantes apresentou sensibilidade de 95% e especificidade de 71%, quando comparado com outros estudos de neurofisiologia para o diagnóstico de NPD.12
3.2 Neuropad
- Trata-se de um teste visual de dez minutos que avalia a produção de suor na superfície plantar dos pés. Baseia-se em uma mudança da cor (azul para rosa) em um adesivo composto de cobalto anidro. O resultado é categórico: função sudomotora normal (teste negativo), quando há alteração da cor (completa e uniforme) em ambos os pés ou alterada (teste positivo), quando o adesivo permanece azul parcial ou totalmente.
- Como apresenta alto valor preditivo negativo (98%), o teste está preconizado para excluir o diagnóstico da NPD; porém, em razão de sua baixa especificidade, os testes positivos de neuropad devem ser confirmados com instrumentos mais específicos.
3.3 Microscopia confocal da córnea (MCC)
- A córnea do olho humano é ricamente inervada por fibras finas do nervo trigêmeo (V nervo craniano) e essas fibras podem ser avaliadas pela MCC. A MCC emprega um feixe de luz que é focalizado por uma lente objetiva na camada da córnea examinada, enquanto toda a luz proveniente de outros pontos é eliminada de forma adequada. Esta técnica oferece duas vantagens: avalia fibras finas (mais precoces) e não é invasiva. Entretanto, é uma modalidade relativamente nova para o diagnóstico morfométrico (densidade, comprimento e tortuosidade) das fibras finas da córnea e trata-se de técnica sofisticada, com alto custo e que necessita pessoal experiente e treinado para usá-la.
Tratamento
O tratamento da NPD leva em consideração três princípios:
1) Tratamento de base (que interfere na história natural da doença). Este deve abordar, além do controle glicêmico, os fatores de risco cardiovasculares, como controle da hipertensão arterial, da albuminúria, dos lípides, do peso, etilismo e tabagismo.
Nota Importante 4: Objetivos do tratamento de base
- Uma vez estabelecida, a NPD geralmente é irreversível e o seu manejo visa retardar a progressão e prevenir as complicações, incluindo insônia, depressão, úlceras de pé diabético, artropatia de Charcot e quedas.
- Os objetivos incluem alcançar um peso corporal normal e atingir metas glicêmicas, de pressão arterial e lipídicas individualizadas, com 150 minutos de atividade aeróbica moderada a vigorosa e duas a três sessões de treinamento resistido, ambos semanalmente.
2) Tratamento restaurador (ou fisiopatológico) que visa restaurar a função neural e a funcionalidade do paciente, se possível. Baseado na evidência disponível atualmente, o tratamento restaurador da NPD compreende três princípios, a saber: fisioterapia (exercícios específicos), ácido alfa-lipóico e, se necessário, reposição racional de vitamina D e B-12 (deve-se fazer a dosagem sérica para documentar o défcit antes).
3) Tratamento sintomático (que pode ser farmacológico ou não farmacológico), direcionado para o controle da dor neuropática.
O tratamento sintomático da NPDD deve ser individualizado, realizado em etapas sucessivas, utilizando uma estratégia racional, considerando as comorbidades do paciente, a eficácia, os efeitos colaterais e o custo das medicações.
Nesse sentido há três níveis de evidência para o tratamento farmacológico:
3.1 Drogas de primeira linha com eficácia estabelecida e bom equilíbrio entre risco-benefício. Há três drogas neste grupo: antidepressivos tricíclicos (ADT) (imipramina, nortriptilina e amitriptilina); antidepressivos duais (ADD) (duloxetina e venlafaxina) e anticonvulsivantes (AC) (gabapentina). 39,-40,60
3.2 Drogas de segunda linha, com eficácia, mas com desproporção entre risco e custo benefício. Há duas terapias neste grupo: pregabalina e a associação de um AD e um AC.
3.3 Terapia de terceira linha com eficácia possível ou provável. Neste grupo há três tipos de terapias consideradas adjuvantes ou complementares para o tratamento da NPDD: estimulação da medula espinhal (EME), acupuntura (ou eletroacupuntura) e a terapia tópica.
Nota importante 5: Avaliação da dor neuropática: Escala Visual Analógica (EVA)
- A escala visual analógica (EVA) é um instrumento importante para avaliar a evolução da dor durante o tratamento. A EVA consiste em uma escala visual de intensidade de dor informada pelo paciente, situando-se entre 0 e 10, sendo que 0 significa ausência total de dor e 10 o nível de dor máximo suportável pelo paciente. Se não houver dor a classificação é 0; dor leve, 1-3; dor moderada, 4-7; dor intensa, 8-10.61
Nota importante 6: Tratamento da dor neuropática
- Em relação às drogas de primeira linha, deve-se sempre iniciar com doses baixas e titulando lentamente (a cada 4 ou 8 semanas) até as doses máximas toleradas, antes de se julgar pela ineficácia.
- É importante distinguir a dor neuropática da parestesia não dolorosa, pois, neste último caso, há resolução apenas com a melhora do controle glicêmico.
- As contraindicações absolutas ao uso de antidepressivos tricíclicos (ADT) são: infarto e isquemia do miocárdio, bloqueio AV (2° ou 3° grau), demência, glaucoma, disautonomia e distúrbio bipolar. É recomendado realizar um ECG nos indivíduos acima de 50 anos, antes de iniciar um ADT.
Nota importante 7: Uso de opioides
- Em casos selecionados, e a curto prazo, pode ser utilizado um opioide fraco (tramadol) como terapia de resgate da dor severa.
Nota importante 8: Terapia tópica
- A terapia tópica (“patch” de lidocaína ou capsaicina a 8% e toxina botulínica subcutânea) é considerada terapia de terceira linha em NPDD e está preconizada quando a dor neuropática for focal, isto é, restrita a uma área menor do que 20 x 30 cm.
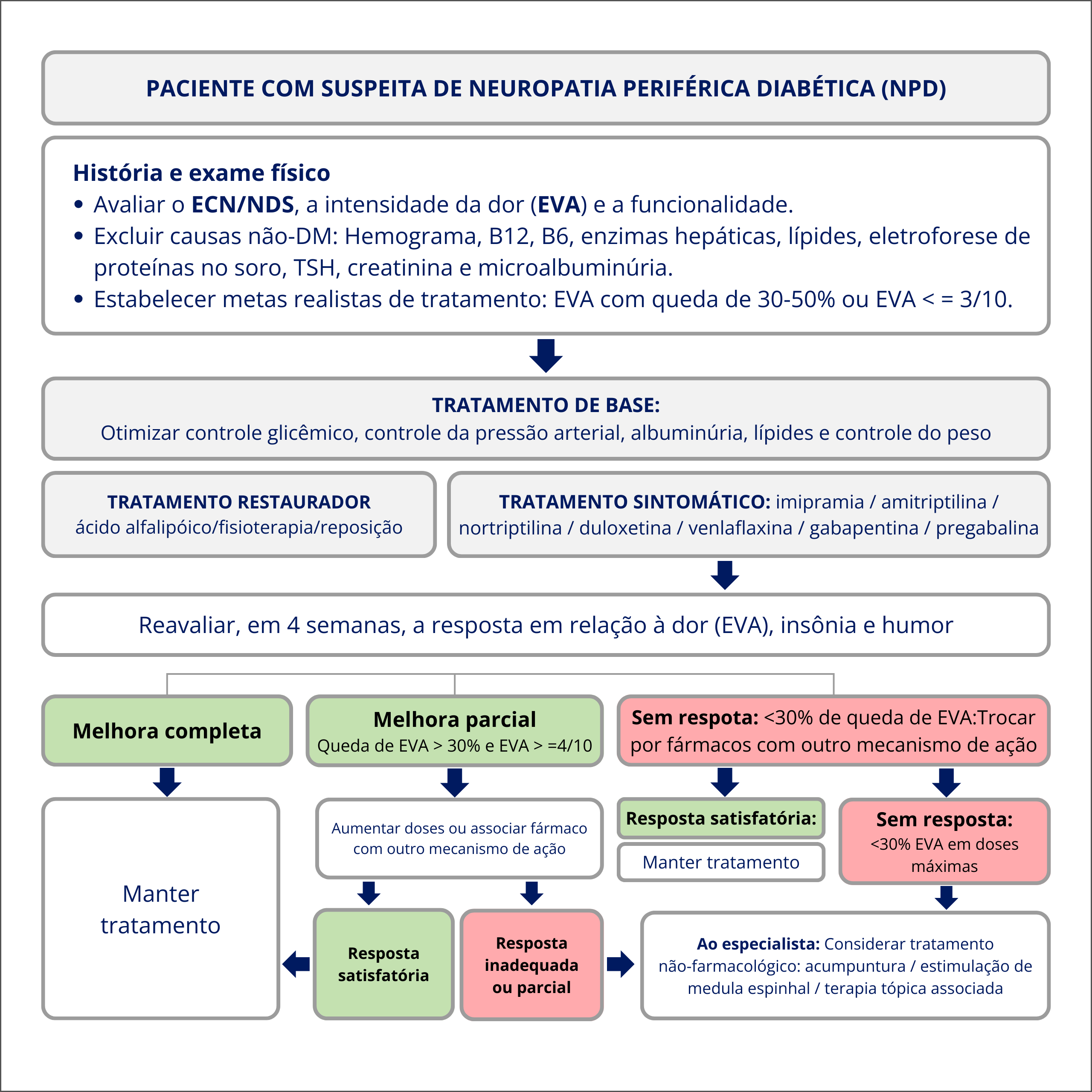
A figura 2 resume a estratégia sugerida pela SBD para o manejo da NPD.
Figura 2. Fluxograma para estratégia de manejo da neuropatia periférica diabética.
Recomendações
Rastreamento
R1. Todos os pacientes com DM devem ser examinados para pesquisa da neuropatia periférica diabética no momento do diagnóstico de DM2 e cinco anos após o diagnóstico de DM1.
| Classe I | Nível C |
- Considera-se, com base em opinião de experts, que, devido às complicações potencialmente graves da NPD (incluindo amputação por úlceras infectadas), a detecção precoce, seguida de intervenções terapêuticas (incluindo educação do paciente, vigilância regular dos pés e melhor controle glicêmico e metabólico), podem diminuir a morbidade.
R2. Para o rastreamento da neuropatia periférica diabética, DEVE SER CONSIDERADO o uso de um teste de alta sensibilidade para avaliar fibras finas (sensibilidade térmica, dolorosa ou função sudomotora) e outro teste para fibras grossas (sensibilidade vibratória, preferentemente com biotesiômetro).
| Classe IIa | Nível B |
- Como o objetivo do rastreamento é justamente o de mudar o curso natural da doença, é importante que o método tenha capacidade para detectar a NPD precocemente (alta sensibilidade), além de factibilidade, rapidez e baixo custo. O ideal é que se utilizem dois testes: um de fibra fina (térmica ao frio, com a ponta e a cabeça do diapasão, ou dolorosa com alfinete) e outro de fibra grossa (sensibilidade vibratória avaliado por um biotesiômetro) com sensibilidade de 85% a 100%.58 (Tabela 1).
- Em uma revisão sistemática com 699 participantes, em cinco estudos, a sensibilidade foi de 1 a 19% para o diapasão (três estudos); de 61 a 80% para o biotesiômetro (dois estudos); e de 19 a 73% para o monofilamento de 10g (dois estudos).8
- As especificidades variaram de 87 a 99% para o diapasão (três estudos); de 64 a 76% para o biotesiômetro (dois estudos); e de 64 a 87% para o monofilamento de 10 g (dois estudos).8 Os testes usados como referência para comparação foram os estudos de condução nervosa (eletroneuromiografia), que até o presente ainda constituem o padrão-ouro.
- Uma revisão sistemática identificou sensibilidade de 59,32% e especificidade de 80,21% para os testes de monofilamento (10 g) e eletroneuromiografia (ENM), respectivamente.9
- Outra revisão sistemática com 19 estudos primários identificou sensibilidade de 53% e especificidade de 88% para o teste de monofilamento (10 g), quando comparado com ENM.10
- Uma outra revisão sistemática com três estudos primários identificou sensibilidade de 41% a 93% e especificidade de 68% a 100% para o teste de monofilamento de 10 g, quando comparado com ENM,11 que também somente avalia as fibras grossas.
R3. O neuropad é um exame rápido e não invasivo que PODE SER CONSIDERADO para rastreamento da NPD visando excluir o diagnóstico de fibras finas.
| Classe IIb | Nível B |
- Duas revisões sistemáticas com metanálise13–14 avaliaram o uso do neuropad e mostraram boa sensibilidade para rastreamento de NPD de fibras finas com potencial para diagnóstico precoce. Uma revisão,13 que incluiu 18 estudos com 3.470 participantes, verificou na metanálise uma sensibilidade de 86% (IC 95%: 79 a 91%) e especificidade de 65% (IC 95%: 51 a 76%), com heterogeneidade importante nas duas análises.
- Na revisão mais recente e de melhor qualidade metodológica,14 cinco estudos foram incluídos com 1.587, participantes e a metanálise resultou em sensibilidade de 89,4% (IC 95%: 83,2 a 93,5%) e especificidade de 60,3% (IC 95%: 50,9 a 69%), também com heterogeneidade importante nas análises.
Diagnóstico
R4. Para o diagnóstico definitivo da neuropatia diabética periférica, É RECOMENDADO utilizar o escore de comprometimento neuropático (ECN ou NDS, sigla em inglês), validado para o português.
| Classe I | Nível C |
- O escore de comprometimento neuropático (ECN/NDS) é o principal teste para diagnóstico precoce da NPD, avaliando fibras finas e grossas. Na Tabela 1 estão resumidos os testes de fibras grossas e finas para rastreio e as principais escalas de sinais e sintomas para o diagnóstico definitivo da NPD e e seus respectivos valores de sensibilidade e especificidade.59 Na Tabela 2 podem-se observar os quatro testes neurológicos que compõem o NDS e seus respectivos escores.
- Os questionários validados de sinais e sintomas – NIS-LL, NDS (Neuropathy Disability Score), Michigan, Toronto modificado e Utah – sumarizam a história e/ou o exame físico em pontuações e escalas e são úteis na confirmação diagnóstica e em pesquisa clínica,2,8 porém consomem tempo, são subjetivos e dependem da interpretação do paciente. A SBD recomenda o questionário NDS por já estar validado para o português (Figura 2).
R5. A microscopia confocal da córnea é um exame não invasivo que PODE SER CONSIDERADO no diagnóstico da neuropatia diabética.
| Classe IIb | Nível B |
- Os estudos localizados15–18 adotaram como exames de referência o diagnóstico clínico e eletrofisiológico como padrão-ouro. Foi observada sensibilidade de 77 a 88% e especificidade de 52 a 88% para o exame de microscopia confocal de córnea no diagnóstico de ND.
- O estudo mais recente,17 com maior amostra e de melhor qualidade metodológica, verificou sensibilidade e especificidade de 88%, utilizando o parâmetro comprimento da fibra nervosa da córnea com ponto de corte inferior a 8,6 mm/mm2 para o diagnóstico de ND.
Prevenção
R6. É RECOMENDADO otimizar o controle glicêmico para evitar ou atrasar o desenvolvimento da NPD em indivíduos com DM1.
| Classe I | Nível A |
- Em indivíduos com DM1, evidências de alta qualidade apoiam a recomendação de que o controle glicêmico intensivo e estável é importante tanto na prevenção como no tratamento da NPD.2 O acompanhamento no longo prazo do ensaio clínico randomizado DCCT demonstrou que um controle mais intensivo da glicemia retardou o início da NPD, bem como a progressão dos seus marcadores eletrofisiológicos.19–20
- Em uma reanálise dos dados do DCCT e em um estudo adicional com um total de 1.228 pacientes com DM1, o controle glicêmico otimizado reduziu tanto o risco anual de NPD [diferença de risco absoluto -1,8 (IC 95% -2,6 a -1,1) como a incidência de neuropatia clínica em cinco anos, que foi de 17 e 8% nos grupos de tratamento convencional e intensivo, respectivamente, com risco relativo [RR 0,46 (IC 95% 0,33 a 0,63)]. Também houve diminuição na progressão das medidas de velocidade de condução nervosa e dos limiares de percepção de vibração.21
R7. É RECOMENDADO otimizar o controle glicêmico para retardar a progressão da NPD em indivíduos com DM2.
| Classe I | Nível B |
- Em indivíduos com DM2, o controle glicêmico tem efeito modesto, mas importante, no curso da NPD. Uma metanálise de quatro estudos clínicos envolvendo 6.669 pacientes com DM2 encontrou tendência não significativa em direção a uma pequena redução no risco anual de NPD nos indivíduos com controle glicêmico aprimorado [Risco Anualizado RD -0,58( IC 95% -1,4 a 0,01)].21
- A falta de um efeito maior e independente por parte do controle glicêmico pode refletir uma diferença na fisiopatologia da NPD no DM2, que, por sua vez, pode estar relacionada aos componentes da síndrome metabólica.22
- Intervenção nos fatores de risco cardiovascular em indivíduos com DM, incluindo melhor controle da pressão arterial, lipídios, peso corporal, evitar o sedentarismo, o tabagismo e o consumo excessivo de álcool, pode contribuir para retardar ou prevenir a progressão da NPD.2,24
R8. Para prevenção da NPD, É RECOMENDADO a implementação de medidas de estilo de vida, visando perda de peso (se pertinente), dieta saudável e moderada atividade física aeróbica e de resistência, além de cessar tabagismo e o uso de álcool.
| Classe I | Nível B |
- Atualmente, exercício físico (EF) e perda de peso estão emergindo como estratégias promissoras na prevenção da NPD, em particular nos indivíduos com DM2 e pré-DM.23–24,28 Em termos de EF, três estudos não controlados e um pequeno ensaio randomizado mostraram potencial do exercício físico para melhorar os resultados da NPD, mesmo naqueles pacientes que apresentaram perda de peso corporal mínima.25–28
- Um estudo com 32 indivíduos com NPD causada por tolerância à glicose diminuída revelou que a densidade de fibras nervosas intraepidérmicas (DFNIE) aumentou significativamente após 12 meses de uma intervenção no estilo de vida focada em exercícios, embora a DFNIE geralmente diminua com o tempo em indivíduos sem intervenção.28
- Da mesma forma, outro estudo envolvendo 36 indivíduos com DM e síndrome metabólica revelou que a capacidade regenerativa do nervo cutâneo melhora após quatro meses de exercícios supervisionados.27
- Um terceiro estudo com 17 indivíduos com NPD demonstrou que a DFNIE melhora significativamente após dez semanas de exercício.26
- Um pequeno ensaio randomizado de pacientes com DM1 e DM2 revelou melhora nos ENMs e limiares de vibração após quatro anos de intervenção com exercício.25
- Apesar desses quatro estudos, maiores ensaios clínicos randomizados ainda são necessários para determinar o papel apropriado do EF para a prevenção e tratamento da NPD. Se os regimes de treinamento aeróbio tradicional ou intervalado de alta intensidade levam a uma melhor adesão e/ou resultados na NPD também requerem estudos com maior robustez.
- Em relação à perda de peso corporal, no estudo AHEAD (Action for Health and Diabetes), uma população obesa com DM2 (n = 5.145) foi randomizada para uma intervenção de perda de peso e mudança de estilo de vida ou de cuidados habituais. A intervenção resultou em melhora em um questionário de sintomas, o Michigan Neuropathy Screening Instrument (MNSI), após 9-11 anos de intervenção.29
R9. Embora esteja associada à redução da incidência de NPD em pessoas com DM2, a cirurgia bariátrica NÃO É RECOMENDADA para a prevenção da NPD.
| Classe III | Nível C |
- Não está claro se a cirurgia bariátrica previne NPD. Até o presente, nenhum estudo focou na perda de peso como medida de prevenção de NPD.
- A cirurgia bariátrica potencialmente pode reduzir a incidência da NPD em pessoas com DM2 e com outras complicações microvasculares.30–31 Um estudo piloto (n = 20) avaliou indivíduos com DM2 obesos (IMC = 32,8 kg/m2), em uso de insulina, com mau controle glicêmico (HbA1c: 8,2%), portadores de NPD, antes e após seis meses do bypass gástrico. Os autores utilizaram duas escalas validadas para avaliar a NPD (NSS e NDS) e encontraram melhora em ambas (p < 0,05).30 No entanto, é importante ressaltar que nesse estudo não houve grupo controle. O objetivo não foi a prevenção de NPD, e as medidas dos resultados não foram cegadas para a intervenção.
- Um estudo de coorte retrospectivo com mais de 4.000 adultos obesos com DM2, em que a cirurgia bariátrica (76% com bypass gástrico) foi associada a uma taxa mais baixa de NPD em quatro anos (7% vs. 21%), com [HR 0,37 (IC 95% 0,30 a 0,47)].31
- Até que estudos mais consistentes possam guiar a prática clínica, não se recomenda a cirurgia bariátrica como medida de prevenção para a NPD.
Tratamento
R10. É RECOMENDADO otimizar o tratamento do DM, incluindo mudanças no estilo de vida, otimização do controle glicêmico e intervenção nos fatores de risco cardiovasculares, visando retardar a progressão da NPD em indivíduos com DM1 e DM2.
| Classe I | Nível C |
- As intervenções de mudança de estilo de vida são endossadas pela SBD e outras sociedades, com base em opiniões de experts, sendo consideradas essenciais para prevenir a progressão da NPD, particularmente em indivíduos com pré-DM e DM2.2,23
Tratamento restaurador
R11. O ácido alfa-lipoico (AAL) DEVE SER CONSIDERADO no tratamento da NPD leve a moderada, para uso no longo prazo, visando melhora da força muscular e estabilização do déficit neuropático, considerando sua segurança e custo-benefício.
| Classe IIa | Nível B |
- As evidências de ensaios clínicos randomizados são limitadas com o uso de antioxidantes, com exceção do ácido alfa-lipoico (AAL).
- O estudo NATHAN 1 foi um ensaio clínico randomizado que avaliou o efeito do AAL 600 mg contra placebo em 460 pacientes com diabetes e polineuropatia leve a moderada,35 com seguimento de quatro anos. O estudo avaliou eficácia, tendo como desfechos, os escores de comprometimento neuropático (NIS-LL) antes, durante e após os quatro anos de tratamento. Houve melhora maior dos escores de NIS-LL em relação ao basal com AAL do que com o placebo (p = 0,028 e p = 0,05, respectivamente), embora sem diferença entre os grupos no final (p = 0,015). Houve melhora especialmente na força muscular (p = 0,045) e na progressão da NPD em quatro anos (p = 0,025). Os principais fatores preditivos de boa resposta ao tratamento foram: idade mais avançada, IMC e pressão arterial normais, neuropatia mais grave, história de doença cardiovascular, tratamento com insulina, maior tempo de duração do diabetes e uso de inibidores da ECA.36 As taxas de eventos adversos sérios foram maiores com ALL (38,1%) do que com o placebo (28%). Apesar disso, o número de mortes no grupo placebo foi maior. O estudo concluiu haver melhora dos escores neuropáticos que envolvem fibras finas e função muscular, embora sem melhora na condução nervosa. O AAL é bem tolerado e considerado seguro.
- Uma metanálise incluindo quatro ensaios clínicos randomizados e controlados (n = 1.258), concluiu que o tratamento com AAL (600 mg/dia, endovenoso) durante três semanas é seguro e oferece melhora clinicamente significativa nos sintomas neuropáticos em pacientes com NPDD34.
R12. Como tratamento de primeira linha para a NPDD, É RECOMENDADO o uso em monoterapia de antidepressivos tricíclicos, duloxetina, venlafaxina ou gabapentina, com eficácia comprovada e boa proporção entre risco-benefício.
| Classe I | Nível A |
- Há pelo menos 18 ensaios clínicos controlados por placebo sobre o uso de ADTs (16 positivos) em dor neuropática, com qualidade final moderada de evidência e um NNT = 3,5.40 Os eventos adversos (EAs) relatados incluíram efeitos centrais e anticolinérgicos que podem ser graves (disfunção cognitiva, hipotensão arterial, isquemia e arritmia cardíaca). É contraindicado, portanto, o uso de ADT em cardiopatas e idosos.39
- Há evidências em quantidade suficiente e de qualidade moderada à alta de oito estudos clínicos randomizados com duloxetina (2.728 pacientes), nas doses de 60 mg e 120 mg por dia, mostrando eficácia no tratamento da NPDD no curto prazo, com razão de risco (RR) para redução da dor ≥ 50% em 12 semanas [RR 1,73 (IC 95% 1,44 a 2,08)] e um NNT = 5,0 (IC 95% 4 a 7).41 Efeitos adversos com a duloxetina são dose-dependentes (náuseas, constipação e diminuição da libido), porém efeitos colaterais graves são raros, não havendo ganho de peso na maioria dos pacientes tratados.
- Da mesma forma, em pacientes com NPDD, a gabapentina na dose de 1.200 mg/dia ou mais mostrou benefícios substanciais (pelo menos 50% de alívio da dor) em relação ao placebo, com uma [RR 1,9 (IC 95% 1,5 a 2,3)] e um NNT = 5,9 (4,6 a 8,3), em seis estudos com 1.277 participantes. Em relação aos EAs, os participantes em uso de gabapentina experimentaram mais distúrbios da marcha (14%), tontura (19%), sonolência (14%) e edema periférico (7%) do que o placebo, em 18 estudos com 4.279 participantes e moderada qualidade de evidência.42
- Chou e colaboradores43 realizaram uma metanálise de ensaios “head to head“, comparando gabapentina e ADT no alívio da NPDD e não encontraram diferença na eficácia analgésica entre as duas drogas na comparação direta, pois ambas foram igualmente mais eficazes do que o placebo.
R13. Como tratamento de segunda linha da NPDD, É RECOMENDADO a terapia combinada com duas drogas de primeira linha, com mecanismos de ação diferentes ou o uso de pregabalina.
| Classe I | Nível A |
Pregabalina:
- Revisão sistemática recente44 avaliou o uso da pregabalina na NPDD em duas doses: 1) na dose de 300 mg/dia, houve mais participantes com pelo menos 30% de redução da intensidade da dor com pregabalina do que com placebo (47% vs. 42%; [RR 1,1 (IC 95% 1,01 a 1,2)], porém com NNT = 22 (12-200), a partir de oito estudos, com total de 2.320 participantes e evidências de moderada qualidade. Da mesma forma, mais pacientes tiveram redução de pelo menos 50% da intensidade da dor (31% vs. 24%; [RR 1,3 (IC 95% 1,2 a 1,5)], com NNT = 22 (12-200), em 11 estudos, com 2.931 participantes e evidências de qualidade moderada; 2) na dose de 600 mg/dia (“off label”), houve mais participantes com pelo menos 30% de redução da intensidade da dor com pregabalina do que com placebo (63% vs. 52%; [RR 1,2 (IC 95 % 1,04 a 1,4)] com NNT = 9,6 (5,5-41), em dois estudos, com 611 participantes e evidência de baixa qualidade. Igualmente, mais pacientes tiveram redução de pelo menos 50% da intensidade da dor (41% vs. 28%; [RR 1,4 (IC 95% 1,2 a 1,7)], com NNT = 7,8 (5,4-14), em cinco estudos, com 1.015 participantes e evidências de baixa qualidade. Em relação aos eventos adversos (EAs), sonolência e tontura foram mais comuns com o uso da pregabalina do que com o placebo, em ambas as doses. Na dose de 300 mg/d: sonolência 11% vs. 3,1% e tontura 13% vs. 3,8%;e na dose de 600 mg/d: sonolência 15% vs. 4,5% e tontura 22% vs. 4,4% (evidência de qualidade moderada).
- A terapia combinada de duas drogas de primeira linha com diferentes mecanismos de ação (um AD mais um AC) tem sido prescrita para NPDD sob a alegação teórica de que doses menores de medicamentos individuais poderiam resultar em melhor tolerabilidade e maior eficácia (coanalgesia). Entretanto, os dados ainda não são robustos e há questionamentos em relação aos custos
- Resultados de dois estudos sugerem que o tratamento da PNDD com combinações de duas drogas de diferentes classes é modestamente mais eficaz do que a monoterapia. Um ensaio clínico randomizado com 47 participantes mostrou que a combinação de nortriptilina com gabapentina foi mais eficaz do que qualquer um dos agentes isoladamente em reduzir a intensidade média da dor diária na quarta semana de tratamento, na dose máxima diária tolerada (50 mg/dia de nortriptilina e 2.180 mg/d de gabapentina), porém às custas de mais EAs.45
- Em um segundo estudo,46 os autores verificaram que a combinação de doses moderadas de imipramina (75 mg/dia) e pregabalina (300 mg/dia) foi mais eficaz no tratamento sintomático da NPDD do que a monoterapia de cada um desses medicamentos, mas às custas de uma taxa de abandono mais elevada, além de maior gravidade e frequência de EAs.
- Contudo, não houve diferença na eficácia analgésica entre a associação de duloxetina (60 mg/dia) e pregabalina (300 mg/dia) com a monoterapia com cada uma das duas drogas em doses máximas (120 mg/dia de duloxetina e 600 mg/dia de pregabalina).47
- Em conclusão, pregabalina e terapia combinada são terapias eficazes no tratamento sintomático da NPDD, porém há incerteza ou desproporção entre o risco-benefício e/ou o custo-benefício das mesmas.1,39–40,60
R14. Em situações específicas, vitamina B1, vitamina B12, benfotiamina, clonidina tópica, carbamazepina, lamotrigina, oxcarbazepina, acetil-L-carnitina, clonazepam, midazolam, paracetamol e creme de capsaicina (0,075%), PODEM SER CONSIDERADOS, porém os dados de eficácia do tratamento sintomático da NPDD ainda são escassos ou controversos.
| Classe IIb | Nível C |
- Há incerteza para concluir sobre a eficácia das seguintes drogas ou tratamentos para a NPDD:3940 vitamina B138, vitamina B1238, benfotiamina38–39, clonidina tópica, creme de capsaicina, carbamazepina, lamotrigina, oxcarbazepina, canabinoides e acetil-L-carnitina.33
- Da mesma forma, faltam dados ou estudos correspondentes aos critérios de inclusão para NPDD para os seguintes medicamentos: clonazepam, midazolam, paracetamol.39
Tratamentos não farmacológicos
R15. Acupuntura ou eletroacupuntura PODEM SER CONSIDERADAS como terapias adjuvantes e seguras para pacientes com NPDD que não respondem ou não toleram os tratamentos de primeira e segunda linha, em especial idosos frágeis e/ou aqueles com componente importante de dor miofascial.
| Classe IIb | Nível B |
- Uma metanálise de 25 estudos randomizados na China concluiu que a acupuntura melhora os sintomas globais da NPDD, em comparação com vitaminas do complexo B (RR 1,3-1,6) ou nenhum tratamento (RR 1,6) e sem EAs relatados.52
- Estudos pilotos indicaram que a acupuntura e/ou eletroacupuntura podem ser uma opção não farmacológica eficaz para a NPDD, quando administrada individualmente48–50 ou em grupo.51
R16. A terapia de estimulação da medula espinhal (EME) PODE SER CONSIDERADA para aliviar a dor da NPDD em casos refratários que não responderam aos tratamentos de primeira e segunda linhas.
| Classe IIb | Nível B |
- Um estudo prospectivo, multicêntrico, controlado e randomizado53 demonstrou que 79% dos pacientes com NPDD refratária, submetidos ao tratamento com EME de alta frequência (10 kHz), alcançaram pelo menos 50% de alívio da dor em uma escala visual analógica, em comparação com 5% daqueles alocados no tratamento clínico convencional. A EME requer uma cirurgia com anestesia local e deve ser realizada em centros especializados com experiência adequada. Nessas condições, trata-se de terapia segura e as complicações são muito raras.54
Tratamentos não recomendados
R17. No tratamento sintomático da NPD NÃO SE RECOMENDAM as seguintes terapias: topiramato, valproato, lacosamida, clonidina, pentoxifilina, mexiletina, vitamina E, canabinoides, AINEs, campo magnético, laser de baixa intensidade e terapia com Reiki.
| Classe III | Nível B |
- Neste grupo há evidências suficientes de que os efeitos desejáveis claramente não são maiores do que os indesejáveis. Por exemplo, uma revisão sistemática55 que analisou dados de três ensaios clínicos randomizados concluiu que topiramato não é eficaz para NPDD. Além desta droga, as revisões sistemáticas mais recentes estabelecem como ineficazes na dor neuropática os seguintes tratamentos: valproato, lacosamida, clonidina, pentoxifilina, mexiletina, vitamina E, tratamento com campo magnético, terapia com laser de baixa intensidade e terapia com Reiki.39–40
Nota importante 9: Uso de canabinoides
- Em relação aos canabinoides e derivados da cannabis (Sativex) no tratamento da NPDD, os resultados foram negativos39–40 e os eventos adversos comuns, mostrando desequilíbrio entre o risco-benefício. Além disso, há potencial para abuso e, até o momento, não se conhecem os riscos do uso no longo prazo.
R18. NÃO É RECOMENDADO o uso rotineiro de opioides em NPDD em razão da falta de evidências sobre a eficácia no longo prazo e do potencial de tolerância, dependência, overdose e eventos adversos sérios.
| Classe III | Nível C |
- No tratamento da dor neuropática, vale lembrar que a abordagem deve ser sempre holística, a saber: melhorar a qualidade de vida, a funcionalidade, o padrão de sono e os distúrbios do humor (ansiedade e depressão). É conhecido que os derivados opioides no tratamento da dor neuropática podem causar hiperalgesia e não melhoram a qualidade de vida.56–57 Além disso, duas revisões sistemáticas56–57 sobre tratamento da dor neuropática sugerem que o uso de opioides cronicamente tem benefício limitado e traz risco médico claro, acrescentando nível de evidência A (forte) ao consenso atual de que a terapia com opioides em NPDD não deve ser recomendada rotineiramente.
- Para aqueles pacientes cuja dor não responde às terapias convencionais (primeira, segunda e terceira linhas), preconiza-se o encaminhamento para um especialista.
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1. Todos os pacientes com DM devem ser examinados para pesquisa da neuropatia diabética (NPD) no momento do diagnóstico de DM2 e cinco anos após o diagnóstico de DM1. | I | C |
| R2. Para o rastreamento da neuropatia diabética, DEVE SER CONSIDERADO o uso de um teste de alta sensibilidade para avaliar fibras finas (sensibilidade térmica, dolorosa ou função sudomotora) e outro teste para fibras grossas (sensibilidade vibratória, preferentemente com biotesiômetro) | IIa | B |
| R3. O neuropad é um exame rápido e não invasivo que PODE SER CONSIDERADO para rastreamento da NPD visando excluir o diagnóstico de fibras finas. | IIb | B |
| R4. Para o diagnóstico definitivo da neuropatia diabética periférica, É RECOMENDADO utilizar o escore de comprometimento neuropático (ECN ou NDS, sigla em inglês), validado para o português. | I | C |
| R5. A microscopia confocal da córnea é um exame não invasivo que PODE SER CONSIDERADO no diagnóstico da neuropatia diabética. | IIb | B |
| R6. É RECOMENDADO otimizar o controle glicêmico para evitar ou atrasar o desenvolvimento da NPD em indivíduos com DM1. | I | A |
| R7. É RECOMENDADO otimizar o controle glicêmico para retardar a progressão da NPD em indivíduos com DM2. | I | B |
| R8. Para prevenção da NPD, É RECOMENDADO a implementação de medidas de estilo de vida, visando perda de peso (se pertinente), dieta saudável e moderada atividade física aeróbica e de resistência, além de cessar tabagismo e o uso de álcool. | I | B |
| R9. Embora esteja associada à redução da incidência de NPD em pessoas com DM2, a cirurgia bariátrica NÃO É RECOMENDADA para a prevenção da NPD. | III | C |
| R10. É RECOMENDADO otimizar o tratamento do DM, incluindo mudanças no estilo de vida, otimização do controle glicêmico e intervenção nos fatores de risco cardiovasculares, visando retardar a progressão da NPD em indivíduos com DM1 e DM2. | I | C |
| R11. O ácido alfa-lipoico (AAL) DEVE SER CONSIDERADO no tratamento da NPD leve a moderada, para uso no longo prazo, visando melhora da força muscular e estabilização do déficit neuropático, considerando sua segurança e custo-benefício. | IIa | B |
| R12. Como tratamento de primeira linha para a NPDD, É RECOMENDADO o uso em monoterapia de antidepressivos tricíclicos, duloxetina, venlafaxina ou gabapentina, com eficácia comprovada e boa proporção entre risco-benefício. | I | A |
| R13. Como tratamento de segunda linha da NPDD, É RECOMENDADO a terapia combinada com duas drogas de primeira linha, com mecanismos de ação diferentes ou o uso de pregabalina. | I | A |
| R14. Em situações específicas, vitamina B1, vitamina B12, benfotiamina, clonidina tópica, carbamazepina, lamotrigina, oxcarbazepina, acetil-L-carnitina, clonazepam, midazolam, paracetamol e creme de capsaicina (0,075%), PODEM SER CONSIDERADOS, porém os dados de eficácia no tratamento sintomático da NPDD ainda são escassos ou controversos. | IIb | C |
| R15. Acupuntura ou eletroacupuntura PODEM SER CONSIDERADAS como terapias adjuvantes e seguras para pacientes com NPDD que não respondem ou não toleram os tratamentos de primeira e segunda linha, em especial idosos frágeis e/ou aqueles com componente importante de dor miofascial. | IIb | B |
| R16. A terapia de estimulação da medula espinhal (EME) PODE SER CONSIDERADA para aliviar a dor da NPDD em casos refratários que não responderam aos tratamentos de primeira e segunda linhas. | IIb | B |
| R17. No tratamento sintomático da NPD NÃO SE RECOMENDAM as seguintes terapias: topiramato, valproato, lacosamida, clonidina, pentoxifilina, mexiletina, vitamina E, canabinoides, AINEs, campo magnético, laser de baixa intensidade e terapia com Reiki. | III | B |
| R18. NÃO É RECOMENDADO o uso rotineiro de opioides em NPDD em razão da falta de evidências sobre a eficácia no longo prazo e do potencial de tolerância, dependência, overdose e eventos adversos sérios. | III | C |
Referências
- Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, Bennett DL, et al. Diabetic neuropathy. Nat Rev Dis Primers. 2019;5(1):1-18.
- Pop-Busui R, Boulton AJM, Feldman EL, Bril V, Freeman R, Malik RA, et al.. Diabetic neuropathy: a position statement by the american diabetes association. Diabetes Care. 2017;40(1):136–54.
- Rolim LC, da Silva EMK, de Sá JR, Dib SA. A systematic review of treatment of painful diabetic neuropathy by pain phenotype versus treatment based on medical comorbidities. Front Neurol. 2017;8:285.
- Abbott CA, Malik RA, van Ross ERE, Kulkarni J, Boulton AJM. Prevalence and characteristics of painful diabetic neuropathy in a large community-based diabetic population in the U.K. Diabetes Care. 2011;34(10):2220–4.
- Ziegler D, Rathmann W, Dickhaus T, Meisinger C, Mielck A. Neuropathic pain in diabetes, prediabetes and normal glucose tolerance: the MONICA/KORA Augsburg Surveys S2 and S3. Pain Med. 2009;10(2):393–400.
- Rolim LC, Sá JR, Chacra AR, Dib SA. Clinical heterogeneity and coexistence of diabetic neuropathies: difference and similarities between types 1 and 2 diabetes mellitus. Arq Bras Endocrinol Metabol. 2009;53(7):818–24.
- Perkins BA. Rethinking neuropathy in type 1 diabetes: had we lost sight of what matters most? Diabetes Care. 2020;43(4):695–7.
- Hirschfeld G, von Glischinski M, Blankenburg M, Zernikow B. Screening for peripheral neuropathies in children with diabetes: a systematic review. Pediatrics. 2014;133(5):e1324–30.
- Soto Molina H, Diaz-Alvarez O, Sandoval-Avila M, Dominguez V, Sinta Cortes G, Rodriguez-Mendoza MM. Economic evaluation of the nerve conduction measuring device for the diagnosis of peripheral diabetic neuropathy. Value Health. 2018;21:S169.
- Wang F, Zhang J, Yu J, Liu S, Zhang R, Ma X, et al. Diagnostic accuracy of monofilament tests for detecting diabetic peripheral neuropathy: a systematic review and meta-analysis. J Diabetes Res. 2017;2017:8787261.
- Dros J, Wewerinke A, Bindels PJ, van Weert HC. Accuracy of monofilament testing to diagnose peripheral neuropathy: a systematic review. Ann Fam Med. 2009;7(6):555–8.
- Lee JA, Halpern EM, Lovblom LE, Yeung E, Bril V, Perkins BA. Reliability and validity of a point-of-care sural nerve conduction device for identification of diabetic neuropathy. PloS One. 2014;9(1):e86515.
- Tsapas A, Liakos A, Paschos P, Karagiannis T, Bekiari E, Tentolouris N, Boura P. A simple plaster for screening for diabetic neuropathy: a diagnostic test accuracy systematic review and meta-analysis. Metabolism. 2014;63(4):584-92.
- NICE – National Institute for Health and Care Excellence. Neuropad for detecting preclinical diabetic peripheral neuropathy. Medical Technologies Guindance 38. [cited 2020 Dec 4]; Available from: www.nice.org.uk/guidance/mtg38.
- Ahmed A, Bril V, Orszag A, Paulson J, Yeung E, Ngo M, et al. Detection of diabetic sensorimotor polyneuropathy by corneal confocal microscopy in type 1 diabetes: a concurrent validity study. Diabetes Care. 2012;35(4):821–8.
- Alam U, Jeziorska M, Petropoulos IN, Asghar O, Fadavi H, Ponirakis G, et al. Diagnostic utility of corneal confocal microscopy and intra-epidermal nerve fiber density in diabetic neuropathy. PLoS One. 2017;12(7):e0180175.
- Perkins BA, Lovblom LE, Bril V, Scarr D, Ostrovski I, Orszag A, et al. Corneal confocal microscopy for the identification of diabetic sensorimotor polyneuropathy: a pooled multinational consortium study. Diabetologia. 2018;61(8):1856–61.
- Tavakoli M, Quattrini C, Abbott C, Kallinikos P, Marshall A, Finnigan J, et al. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy. Diabetes Care. 2010;33(8):1792–7.
- Diabetes Control and Complications Trial Research Group. Effect of intensive diabetes treatment on nerve conduction in the diabetes control and complications trial. Ann Neurol. 1995;38:869.
- Martin CL, Albers JW, Pop-Busui R; DCCT/EDIC Research Group. Neuropathy and related findings in the diabetes control and complications trial/ epidemiology of diabetes interventions and complications study. Diabetes Care. 2014;37:31.
- Callaghan BC, Little AA, Feldman EL, Hughes RA. Enhanced glucose control for preventing and treating diabetic neuropathy. Cochrane Database Syst Rev. 2012;6(6):CD007543.
- Cortez M, Singleton JR, Smith AG. Glucose intolerance, metabolic syndrome, and neuropathy. Handb Clin Neurol. 2014;126:109.
- Bönhof GJ, Herder C, Strom A, et al. Emerging biomarkers, tools, and treatments for diabetic polyneuropathy. Endocr Rev. 2019;40:153.
- American Diabetes Association. 4. Lifestyle management: standards of medical care in diabetes–- 2018. Diabetes Care. 2018;41:S38.
- Balducci S, Iacobellis G, Parisi L et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complicat. 2006;20(4):216–23.
- Kluding PM, Pasnoor M, Singh R et al. The effect of exercise on neuropathic symptoms, nerve function, and cutaneous innervation in people with diabetic peripheral neuropathy. J Diabetes Complicat. 2012;26(5):424–9.
- Singleton JR, Marcus RL, Lessard MK, Jackson JE, Smith AG. Supervised exercise improves cutaneous reinnervation capacity in metabolic syndrome patients. Ann Neurol. 2015;77(1):146–53.
- Smith AG, Russell J, Feldman EL et al. Lifestyle intervention for pre-diabetic neuropathy. Diabetes Care. 2006;29(6):1294–9.
- The Look AHEAD Research Group (2017). Effects of a long-term lifestyle modification programme on peripheral neuropathy in overweight or obese adults with type 2 diabetes: the Look AHEAD Study. Diabetologia. 60(6):980–8.
- Müller-Stich BP, Fischer L, Kenngott HG, et al. Gastric bypass leads to improvement of diabetic neuropathy independent of glucose normalization – results of a prospective cohort study (DiaSurg 1 Study). Ann Surg. 2013;258:760.
- O’Brien R, Johnson E, Haneuse S, et al. Microvascular outcomes in patients with diabetes after bariatric surgery versus usual care: a matched cohort study. Ann Intern Med. 2018;169:300.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetic neuropathy: cellular mechanisms as therapeutic targets. Nat Rev Neurol. 2011;7:573–83.
- Rolim LC, da Silva EM, Flumignan RL, Abreu MM, Dib SA. Acetyl-L-carnitine for the treatment of diabetic peripheral neuropathy. Cochrane Database Syst Rev. 2019;6(6):CD011265.
- Ziegler D, Nowak H, Kempler P, Vargha P, Low PA. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis. Diabet Med. 2004;21:114–21.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with a-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care. 2011;34:2054–60.
- Ziegler D, Low PA, Freeman R, Tritschler H, Vinik AI. Predictors of improvement and progression of diabetic polyneuropathy following treatment with alpha-lipoic acid for 4 years in the NATHAN 1 trial. J Diabetes Complications. 2016;30(2):350–6.
- Tesfaye S, Sloan G. Diabetic polyneuropathy – advances in diagnosis and intervention strategies. Eur Endocrinol. 2020;16(1):15–20.
- Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, et al. Vitamin B for treating peripheral neuropathy. Cochrane Database Syst Rev. 2008;16(3):CD004573.
- Moisset X, Bouhassira D, Avez Couturier J, Alchaar H, Conradi S, Delmotte MH, et al. Pharmacological and non-pharmacological treatments for neuropathic pain: a systematic review and French recommendations. Rev Neurol. (Paris). 2020;176(5):325–52.
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta- analysis. Lancet Neurol. 2015;14(2):162–73.
- Lunn MP, Hughes RA, Wiffen PJ. Duloxetine for treating painful neuropathy, chronic pain, or fibromyalgia. Cochrane Database Syst Rev. 2014;(1):CD007115.
- Wiffen PJ, Derry S, Bell RF, Rice ASC, Tölle TR, Phillips T, Moore RA. Gabapentin for chronic neuropathic pain in adults. Cochrane Database of Syst Rev. 2017;6:CD007938.
- Chou R, Carson S, Chan BK. Gabapentin versus tricyclic antidepressants for diabetic neuropathy and post-herpetic neuralgia: discrepancies between direct and indirect meta-analysis of RCT. J Gen Intern Med. 2009;24(22):178–88.
- Derry S, Bell RF, Straube S, Wiffen PJ, Aldington D, Moore RA. Pregabalin for neuropathic pain in adults. Cochrane Database Syst Rev. 2019;1(1):CD007076.
- Gilron I, Bailey JM, Tu D, Holden RR, Jackson AC, Houlden RL. Nortriptyline and gabapentin, alone and in combination for neuropathic pain: a double-blind, randomised controlled crossover trial. Lancet. 2009;374(9697):1252.
- Holbech JV, Bach FW, Finnerup NB, Brøsen K, Jensen TS, Sindrup SH. Imipramine and pregabalin combination for painful polyneuropathy. Pain. 2015;156(5):958–66.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetine and pregabalin: high-dose monotherapy or their combination? The “COMBO-DN Study” – a multinational, randomized, double-blind, parallel-group study in patients with diabetic peripheral neuropathic pain. Pain. 2013;154(12):2616–25.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomised control trial. Acupunct Med. 2007;25:11.
- Garrow AP, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): a pilot RCT. Acupunct Med. 2014;32:242.
- Abuaisha BB, Costanzi JB, Boulton AJ. Acupuncture for the treatment of chronic painful peripheral diabetic neuropathy: a long-term study. Diabetes Res Clin Pract. 1998;39:115.
- Chao MT, Schillinger D, Nguyen U, et al. A Randomized clinical trial of group acupuncture for painful diabetic neuropathy among diverse safety net patients. Pain Med. 2019;20:2292.
- Chen W, Yang GY, Liu B, et al. Manual acupuncture for treatment of diabetic peripheral neuropathy: a systematic review of randomized controlled trials. PLoS One, 2013;8:e73764.
- Petersen EA et al. Effect of high-frequency (10-kHz) spinal cord stimulation in patients with painful diabetic neuropathy: a randomized clinical trial. JAMA Neurol. 2021;
- de Vos CC, Meier K, Zaalberg PB, Nijhuis HJA, Duyvendak W, Vesper J, et al. Spinal cord stimulation in patients with painful diabetic neuropathy: a multicentre randomized clinical trial. Pain 2014;155:2426–31.
- Wiffen PJ, Derry S, Lunn MP, Moore RA. Topiramate for neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev. 2013;CD008314.
- Busse JW, Wang L, Kamaleldin M, et al. Opioids for chronic noncancer pain: a systematic review and meta-analysis. JAMA. 2018;320:2448.
- Cooper TE, Chen J, Wiffen PJ, et al. Morphine for chronic neuropathic pain in adults. Cochrane Database Syst Rev. 2017; 5:CD011669.
- England JD et al. Distal symmetric polyneuropathy: a definition for clinical research. Neurology. 2005;64:199-207.
- Moreira RO et al. Translation into Portuguese and assessment of the reliability of a scale for the diagnosis diabetic distal polyneuropathy. Arq Bras Endocrinol Metab. 2005.49(6):944–50.
- Finnerup NB et al. Neuropathic pain clinical trials: factors associated with decreases in estimated drug efficacy. Pain. 2018;159(11):2339–46.
- Cruccu Get al. EFNS guidelines on neuropathic pain assessment. Eur J Neurol 2004 Mar; 11: 153-162.
Cite este artigo
Rolim L, Thyssen P, Flumignan R, andrade D, Dib S, Bertoluci M. Diagnóstico e tratamento da neuropatia periférica diabética.
Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-14, ISBN: 978-85-5722-906-8.