Autores: Ana Teresa Santomauro, Augusto Cézar Santomauro Junior e Roberto Abrão Raduan
Editor Chefe: Marcello Bertoluci
Última revisão em: 18/04/2023
DOI: 10.29327/557753.2022-22 | Cite este Artigo
Introdução
A cetoacidose diabética euglicêmica (CAD-E) é uma condição pouco comum, mas potencialmente ameaçadora à vida, e uma emergência que pode ocorrer em pessoas com DM1, DM2, ou mesmo em pessoas sem diabetes. Apresenta um desafio diagnóstico pois, como a glicemia não está muito elevada, pode haver atrasos no reconhecimento do diagnóstico e no início do tratamento.1
Diagnóstico
A CAD-E é definida pela presença de glicemia < 200 mg/dL, com pH < 7,3, bicarbonato < 18 mEq/L, anion gap 10-12 mEq/L e concentrações elevadas de cetonemia (Quadro 1).2–4 Seu quadro clínico é semelhante ao da cetoacidose diabética (CAD), como visto no Quadro 2.1
Quadro 1. Critérios diagnósticos para CAD-E
| Quadro 1. Critérios diagnósticos para CAD-E¹ |
|
A medida da cetonemia é preferencial em relação à cetonúria. A cetonemia indica o nível sérico de beta hidroxibutirato, que se eleva mais precocemente e mais acentuadamente do que o acetoacetato, medido na urina.21
A mensuração da cetonemia é especialmente importante se o paciente estiver em uso de inibidores de SGLT2. Nesta situação, pode haver redução da cetonúria por aumento da reabsorção tubular de acetoacetato, apesar do aumento da cetonemia.21
Em todas as pessoas sintomáticas (Quadro 2) e com cetonemia elevada acima de 1,6 mmol/L, é necessário verificar a presença de acidose por meio de gasometria.1,21
Quadro 2. Sinais e sintomas de CAD e CAD-E
| Quadro 2. Sinais e Sintomas de CAD e CAD-E¹ |
|
A CAD-E também é descrita em outras situações clínicas, como gestantes com ou sem diabetes,5 pessoas com restrição na ingestão de carboidratos ou em jejum prolongado,6 indivíduos com doenças de armazenamento de glicogênio,7,8 uso abusivo de álcool, doença hepática crônica,9 sepse,10 pancreatite,11 uso de cocaína,12 entre outros (Quadro 3).
Após a introdução dos inibidores da SGLT2 (ISGLT2) para o tratamento de pessoas com DM2, a ocorrência de CAD-E aumentou e, consequentemente, a necessidade de um diagnóstico e tratamento adequados (Quadro 3).13
Os médicos devem estar cientes dos possíveis gatilhos etiológicos de CAD-E em pessoas suscetíveis, e ativamente descartar outros diferenciais, minimizando assim o tempo necessário para o diagnóstico de CAD-E (Quadros 3 e 4).
Quadro 3. Situações clínicas que favorecem a ocorrência de CAD-E
| Quadro 3. Situações clínicas que favorecem a ocorrência de CAD-E¹⁴ |
|
A CAD-E resulta da deficiência absoluta ou relativa de insulina, associada a um aumento de hormônios contrarreguladores (glucagon, cortisol, catecolamina e hormônio do crescimento). Na CAD-E, a deficiência de insulina e a resistência à insulina são mais leves, portanto, a superprodução e a subutilização de glicose são menores do que na CAD, limitando o aumento nos níveis de glicemia.1
O mecanismo da CAD-E é devido à diminuição da produção hepática de glicose durante o estado de jejum, e ao aumento urinário da excreção de glicose induzida por um excesso de hormônios contrarreguladores, sendo, o primeiro, o motivo mais comum.14 Na CAD-E induzida por ISGLT2, a glicosúria renal contribui para níveis ainda mais baixos de glicose plasmática.15–17
Os principais fatores de risco para desenvolvimento de CAD-E, podem ser vistos no Quadro 4.
Quadro 4. Fatores que podem precipitar a CAD-E em pessoas propensas
| Quadro 4. Fatores precipitantes para desenvolvimento de CAD-E¹⁸ |
|
Tratamento
A tabela 1 descreve o manejo específico da CAD-E de acordo com a etiologia.
Tabela 1. Manejo da CAD-E
| Tabela 1. Principais causas e manejo correspondente da CAD-E | ||
| Causas | Características | Tratamento |
| Inibidores do SGLT2 | Pessoas com DM 1 ou 2 + fatores precipitantes: Doença aguda, cirurgia, desidratação, ingestão de álcool. |
|
|
Restrição de carboidratos |
Gatilho em pessoas com diabetes usando insulina Pessoas sem diabetes |
|
| Gestantes | Gestantes com DM1, DM2 ou diabetes gestacional Gestantes sem diabetes |
|
| Alcoolismo | Pessoas sem diabetes Gatilho em pessoas com diabetes |
|
|
Doença Hepática Crônica |
Pessoas com ou sem Diabetes |
|
| Cocaina | Pessoas com ou sem Diabetes |
|
A tabela 2 mostra o manejo da CAD-E de acordo com o nível de cetonemia.
Tabela 2. Manejo da cetonemia
| Tabela 2. Pontos de corte para cetonemia e ações corretivas¹⁸ | ||
| Cetonemia (mmol/L) | Cetonúria | Recomendações |
| < 0,6 | negativa |
|
| 0,6-1,5 | traços |
|
|
1,6-3,0 (CAD iminente) |
moderada |
|
|
>3,0 (CAD provável) |
Alta | |
Se diagnosticado precocemente e tratado agressivamente com fluidos e insulina IV, a CAD-E pode ser facilmente revertida, minimizando assim a morbidade e mortalidade.19
Reposição de volume
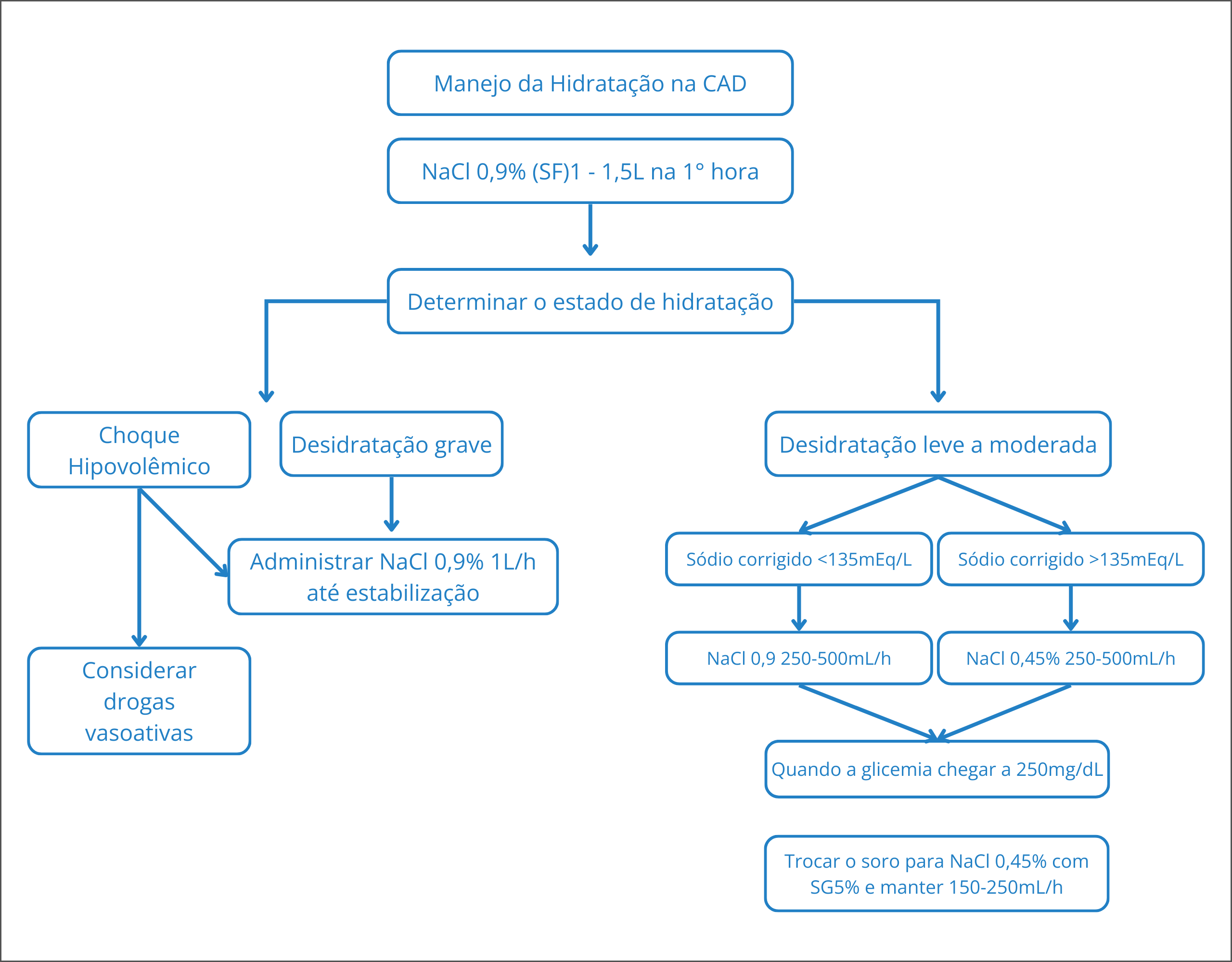
Os objetivos da reposição volêmica são: repor o déficit de água, manter a pressão arterial, melhorar a perfusão tissular e renal, reduzir a glicemia.13,28 Para correção da desidratação, na ausência de comprometimento das funções cardíaca e renal, deve-se iniciar infusão de solução salina isotônica de cloreto de sódio (NaCl) 0,9%, em média 15 a 20 mL/kg na primeira hora, buscando-se restabelecer a perfusão periférica. A escolha subsequente de fluidos dependerá da evolução dos eletrólitos séricos e da diurese.
Se o indivíduo evoluir com sódio elevado (≥ 150 mEq/L), deve-se prescrever solução salina hipotônica de NaCl 0,45%, em média 10 a 14 mL/kg/h. Caso contrário, pode-se administrar solução isotônica de NaCl 0,9%.34
Figura 1. Fluxograma mostrando a estratégia de manejo da hidratação
Reposição de potássio
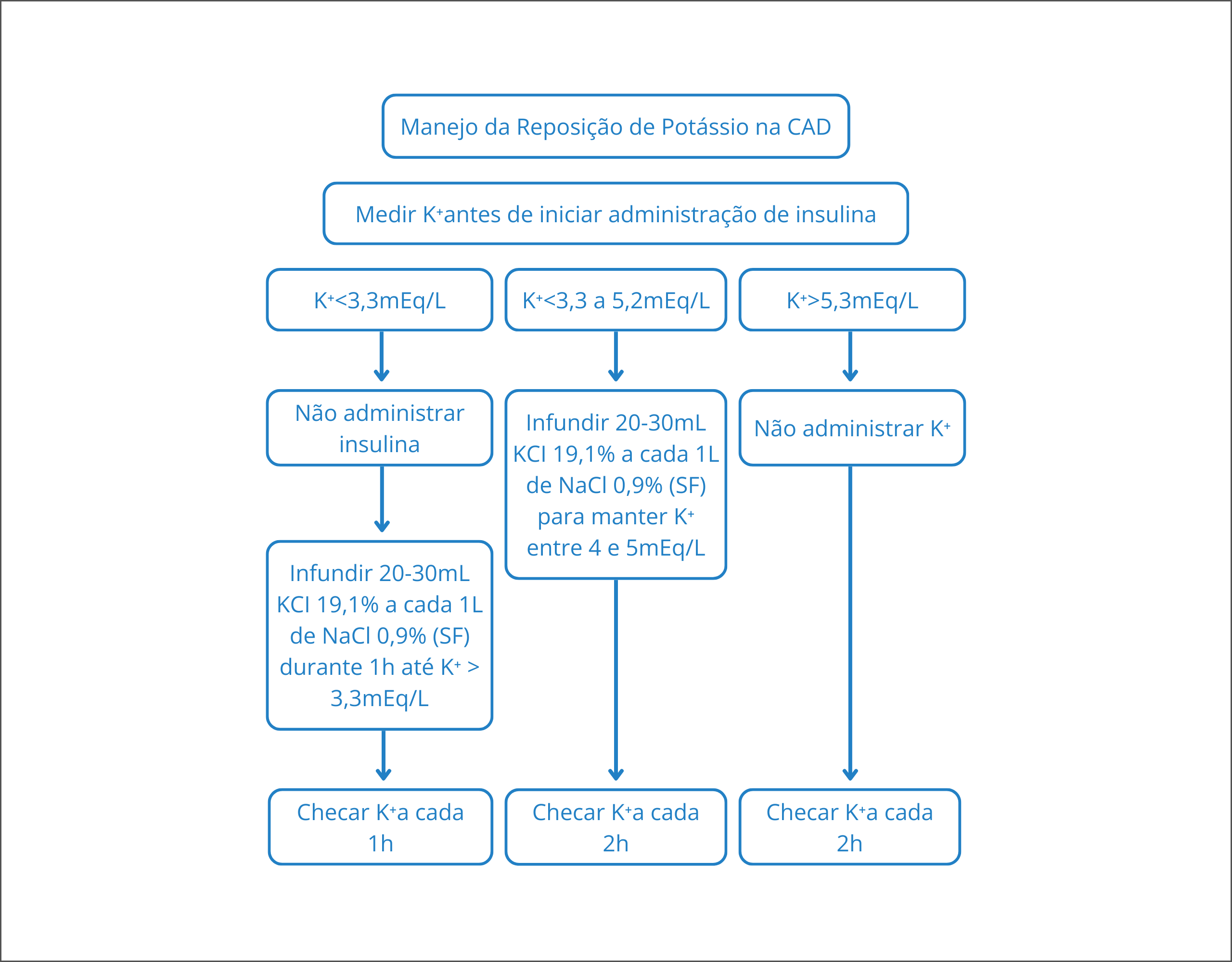
O início do tratamento deve ser com baixa dose de insulina IV em todos os indivíduos com CAD moderada a grave que tenham potássio sérico ≥3,3 mEq/L. A única indicação para atrasar o início da terapia com insulina é se o potássio sérico estiver abaixo de 3,3 mEq/L, uma vez que a insulina piorará a hipocalemia ao direcionar o potássio para as células.
Pessoas com um potássio sérico inicial abaixo de 3,3 mEq/L devem receber fluido e reposição de potássio antes do tratamento com insulina. A terapia com insulina deve ser adiada até que o potássio sérico esteja acima de 3,3 mEq/L para evitar complicações como arritmias cardíacas, parada cardíaca e fraqueza dos músculos respiratórios.
Figura 2. Manejo da reposição de potássio
Reposição de insulina
Insulina regular IV e análogos de insulina de ação rápida são igualmente eficazes no tratamento de CAD-E. A escolha da insulina IV é baseada nas preferências institucionais, experiência clínica e preocupações com custos.
Para o tratamento agudo da CAD-E, não há papel para a insulina de ação longa ou intermediária.
O principal efeito da terapia com insulina é reduzir a concentração de glicose sérica, principalmente diminuindo a produção de glicose hepática e aumentando a utilização periférica, assim como através de um efeito menos importante, diminuindo a produção de cetona, reduzindo a lipólise e a secreção de glucagon.
A inibição da lipólise requer um nível de insulina muito mais baixo do que o necessário para reduzir a concentração de glicose sérica. Portanto, se a dose de insulina administrada está reduzindo a concentração de glicose, ela deve ser mais do que suficiente para interromper a geração de cetonas.
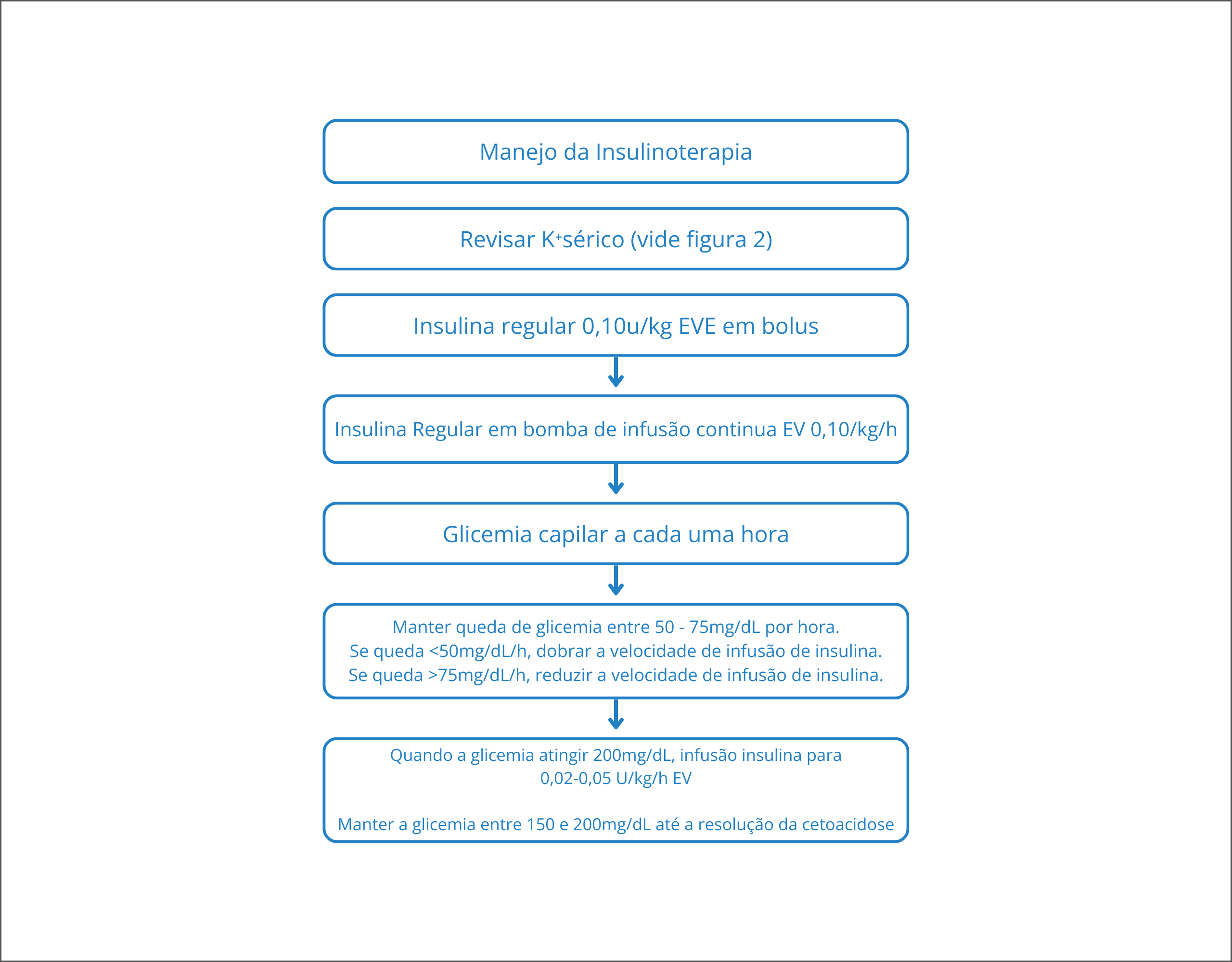
Na CAD-E, o tratamento pode ser iniciado com um bolus IV de insulina regular (0,1 unidades/kg de peso corporal) seguido, dentro de cinco minutos, por uma infusão contínua de insulina regular de 0,1 unidades/kg por hora (equivalente a 7 unidades/hora em um indivíduo de 70 kg).
Alternativamente, a dose em bolus pode ser omitida se uma dose mais alta de insulina regular IV contínua (0,15 unidades/kg por hora, equivalente a 10 unidades/hora em um indivíduo de 70 kg) for iniciada. Essas doses de insulina regular IV geralmente diminuem a concentração de glicose sérica em aproximadamente 50 a 70 mg/dL/hora. Doses mais altas geralmente não produzem um efeito de redução da glicose mais proeminente, provavelmente porque os receptores de insulina estão totalmente saturados e ativados pelas doses mais baixas, a taxa de infusão de insulina deve ser dobrada a cada hora até que um declínio constante na glicose sérica dessa magnitude seja alcançado.
Quando a glicemia se aproxima de 200 mg/dL, é necessário, além de trocar a solução salina IV para dextrose em solução salina, diminuir a taxa de infusão de insulina para 0,02 a 0,05 unidades/kg por hora. Se possível, não permitir que a glicemia, neste momento, caia abaixo de 200 mg/dL, porque isso pode promover o desenvolvimento de edema cerebral.
Pessoas com CAD-E podem ser tratados com segurança com análogos de insulina de ação rápida subcutânea na enfermaria ou pronto socorro, mas apenas quando uma equipe adequada estiver disponível para monitorar cuidadosamente o paciente e verificar, por exemplo a glicemia capilar, a cada hora, entre as outras monitorizações plasmáticas necessárias.
Figura 3. Manejo da insulinoterapia
Reposição de glicose
O início do tratamento deve ser com solução de NaCl 0,45% e SG 5% com infusão de 150-250 mL/h, quando a glicemia for menor que 250 mg/dL, que é o caso, na maior parte dos indivíduos com CAD-E.
Em pessoas com cetoacidose alcoólica ou em jejum, a correção parcial da acidose metabólica pode geralmente ser obtida pela administração de dextrose e soluções salinas desde o início do tratamento, sem necessidade de insulinoterapia.18,23
As soluções de dextrose devem ser evitadas inicialmente em pessoas com hipocalemia grave, pois estimulam a secreção de insulina, levando o potássio para as células e piorando a hipocalemia.
As concentrações de cetonas na urina dependem da hidratação e de outros fatores. Os valores podem não se correlacionar com os níveis de beta-hidroxibutirato no sangue.
Recomendações
R1 É RECOMENDADO que a cetonemia ou a cetonúria sejam imediatamente determinadas em todos os indivíduos com DM1 sintomáticos (quadro 2) e nos indivíduos com DM2 que apresentem sintomas associado a situações clínicas específicas (quadro 3), mesmo com glicemias abaixo de 200 mg/dL.
| Classe I | Nível C |
- Cetoacidose euglicêmica foi inicialmente relatada em uma série de casos em 1973. Munro et al. relatam que entre 211 episódios de CAD em pessoas com DM1, considerando o valor de corte < 300 mg/dL, 37 (17,5%) tiveram episódios cetoacidose severa (bicarbonato plasmático < 10 mmol/L). Em 16 episódios (7,6%) a glicemia inicial estava < 200 mg/dL. Vômitos foram o fator comum em todos os pacientes e, em todos, houve redução da ingestão de carboidratos, com doses mantidas ou aumentadas de insulina.19
- Em outra série de casos com 722 episódios de CAD em indivíduos com DM1, em 43 episódios (6%) a glicemia inicial estava abaixo de 300mg/dl e em 23 episódios (3%) os pacientes apresentavam critérios definidos por Munro com bicarbonato < 10 mmol/L. CAD-E com glicemias abaixo de 200mg/dL ocorreram em 6 episódios (0,8%). Os casos se caracterizaram pela presença de vômitos, com reduzida ingestão de carboidratos e manutenção da insulinoterapia, e desidratação leve.20
- O diagnóstico de CAD-E é um diagnóstico de exclusão. Outras formas de cetoacidose, como a cetoacidose do jejum, têm que ser descartadas. Além disso, outras causas de aumento do anion gap, como acidose láctica, aumento de álcoois tóxicos (metanol, etilenoglicol, etc.), toxicidade de drogas, ingestão de paraldeído e insuficiência renal devem ser excluídas.19
Uso de iSGLT2
R2 É RECOMENDADO a atenção especial ao diagnóstico de CAD-E em indivíduos com DM2 tratados com iSGLT2, que apresentem sintomas (Quadro 2), ou quando houver fatores precipitantes (Quadro 4).
| Classe I | Nível B |
- Evidências recentes sugerem que a ocorrência de CAD-E em indivíduos com DM2 é rara quando tratados com iSGLT2.13,22–24 Uma metanálise incluindo 72 ensaios clínicos randomizados em pacientes com DM2 usando iSGLT2 por mais de 12 semanas comparados a placebo, em 9 estudos ocorreu a presença de cetoacidose. Estes 8 estudos incluíram 10.157 indivíduos usando iSGLT2 e 5396 usando placebo. Nesta análise não se observou aumento de risco de CAD como classe [MH-OR 1,14 (IC 95% 0,45 a 2,88 p=0,78)]. Após análise de sensibilidade, o risco foi considerado negligível.25
- Um estudo observacional de coorte foi desenhado para comparar a incidência de CAD em pacientes com DM2 em novos usuários de iSGLT2 comparativamente a outras classes de antidiabéticos. Os pacientes foram identificados em 4 bases de dados americanos, tendo sido excluídos pacientes com DM1. Os novos usuários de iSGLT2 tiveram risco aumentado para CAD quando comparados às sulfoniluréias [RR 1,53 (IC 95% 1,31 a 1,79)]; inibidores da DPP-4 [RR 1,28 (IC 95% 1,11 a 1,47)]; agonistas do receptor de GLP-1 [RR 1,34 (IC 95% 1,12 a 1,60)]; metformina [RR 1,31 (IC 95% 1,11 a 1,54)]. A definição de DM2 parece ter sido importante nos resultados, uma vez que quando um critério mais rígido para diagnóstico de DM2 foi aplicado, os iSGLT2 apenas mostraram risco maior de CAD em relação às sulfonilureias, sugerindo que boa parte do risco se deva a pacientes com diagnóstico errôneo de DM2.26
- No Canadá e Reino Unido (mais de 350.000 pacientes e 500 eventos de CAD-E), iSGLT2 foram associados a risco maior de cetoacidose em relação ao inibidores DPP-4 (incidência 2,03 vs 0,75 para cada 1000 pacientes-ano, [RR 2,85 (IC 95% 1,99 a 4,08)].27
- Um estudo mostrou que em 22% dos casos a ocorrência de CAD-E não foi associada com qualquer outro fator precipitante claro, como aqueles vistos no Quadro 4.15
Nota importante 1: uso de iSGLT2 em pessoas com DM1
- No Brasil, os iSGLT2 não estão aprovados para o uso no DM1.
- Até o momento, a aprovação dos iSGLT2 para DM1 foi rejeitada pelo US Food and Drug Administration (FDA), pois os dados disponíveis sobre o iSGLT2 como adjuvante da insulina para o tratamento de pessoas com DM1 sugeriram que os benefícios gerais não superaram os riscos de CAD potencialmente fatal.28
- A European Medicines Agency (EMA) aprovou a indicação clínica da dapagliflozina para pessoas com DM1 com IMC ≥ 27 kg/m², porém em novembro de 2021, o fabricante retirou esta indicação da bula e suspendeu sua comercialização para pessoas com DM1.29
Nota importante 2: uso de iSGLT2 em ambiente hospitalar
- A cetose euglicêmica, ainda é pouco diagnosticada e reconhecida. Muitos casos, que são incorretamente diagnosticados como cetoacidose diabética, principalmente em pacientes com diabetes tipo 2, são na verdade, pacientes com cetose euglicêmica. Na experiência do nosso serviço (Hospital BP – Beneficência Portuguesa de São Paulo) nos últimos 3 anos, em torno de 40% dos pacientes com DM2 internados nas unidades de terapia intensiva com diagnóstico de cetoacidose diabética, na verdade apresentavam cetose euglicêmica, secundária principalmente ao uso de inibidores de SGLT2 ou alcoolismo. Houve também um caso de uma paciente com DM1, associada à baixa ingestão alimentar, após cirurgia bariátrica.
R3. É RECOMENDADO a suspensão dos iSGLT2 entre 3 a 4 dias antes de cirurgia de grande porte, procedimentos invasivos planejados, ou exercícios muito intensos, para redução do risco de CAD-E.
| Classe I | Nível C |
- A manutenção dos iSGLT2 antes da cirurgia pode colocar os indivíduos em risco potencialmente fatal de CAD-E.30
- Considerando que a meia-vida plasmática média dos iSGLT2 é de aproximadamente 13 horas, e que a glicosúria, devido a inibição do transportador SGLT2, pode permanecer vários dias após a suspensão da droga,30–32 os iSGLT2 devem ser descontinuados entre 1 a 3 dias antes de cirurgias eletivas de grande porte, procedimentos invasivos planejados ou exercícios muito intensos, como maratonas. Nesse período a glicemia deve ser cuidadosamente monitorada.
- No caso de cirurgias ou procedimentos, os iSGLT2 podem ser reiniciados assim que a ingestão oral do paciente estiver liberada e quaisquer outros fatores de risco para cetoacidose forem resolvidos.32
Gestantes
R4 – DEVE SER CONSIDERADO o diagnóstico de CAD-E em gestantes sintomáticas (quadro 2), com ou sem diagnóstico de diabetes, geralmente ao final da gravidez, visto que é uma complicação com potencial de provocar morte materna e fetal.
| Classe IIa | Nível C |
- A incidência de CAD-E em relatos de caso situa-se entre 0,8% e 1,1% dos casos de gestação com CAD sendo 3 vezes mais frequente do que em mulheres não gestantes.5
- A CAD-E pode ocorrer em mulheres grávidas com diabetes, e mais raramente, em gestantes sem diabetes. O diagnóstico pode ser subestimado e o tratamento pode sofrer atrasos. O risco de perda fetal é elevado, atingindo 35% dos casos.33–35
- Jaber e colaboradores fizeram uma extensa revisão da literatura através de uma série de casos relatados de CAD-E em gestantes. A maioria dos episódios ocorreram no terceiro trimestre (entre 32 a 37 semanas de gestação). A idade média era de 30 anos e a média do de glicemia era 110 mg/dL. Os casos foram distribuídos igualmente entre pacientes com DM1, DM2 e DMG.36
Nota importante 3: Gestante com CAD
- Gestantes com CAD devem ser admitidas em ambiente hospitalar. Quando a cetoacidose diabética ocorre após a 24a semana de gestação, o bem estar fetal deve ser monitorado continuamente. As anormalidades na monitorização do bem-estar fetal frequentemente são revertidas quando a acidose é corrigida.5
- O parto cesáreo de emergência, por estar associado à alta morbidade materna, só deve ser tentado se a condição materna piorar. Em caso de necessidade de interrupção da gestação por parto cesáreo é necessário corrigir antes a acidose metabólica para evitar complicações cirúrgicas.35
Nota importante 4: Medição de cetonemia em gestantes com DM1
- Deve ser considerado que gestantes com DM1 recebam prescrição de tiras de cetonemia e orientação sobre a prevenção e detecção da cetoacidose.
Nota importante 5: Cirurgia Bariátrica e CAD-E
- Indivíduos submetidos à cirurgia bariátrica podem estar especialmente em risco de CAD-E, visto que eles passam por cirurgia e jejum perioperatório. O jejum ou a restrição da ingestão de carboidratos pode precipitar CAD-E mais comumente em pessoas com diabetes do que em pessoas sem diabetes e geralmente apresenta um fator precipitante de CAD típica.1
- A investigação de CAD-E deve ser considerada em pessoas com diabetes submetidas à cirurgia bariátrica que apresentem sintomas sugestivos de CAD.
- A indicação de cirurgia bariátrica está aumentando em pessoas com DM. A incidência de CAD é de até 1 em cada 4 indivíduos com DM1 após cirurgia bariátrica.19,37,38
Nota importante 6: Álcool e CAD-E
- A cetoacidose alcoólica é semelhante em apresentação à CAD-E embora frequentemente com valores de glicose normais ou baixos, sem glicosúria.39
- A acidose associada ao consumo de álcool é atribuível ao acúmulo de lactato e corpos cetônicos. A ausência de hiperglicemia é o resultado da restrição prolongada na ingestão calórica, reservas de glicogênio hepático depletadas e gliconeogênese prejudicada.
- O etanol que aumenta a razão NADH/NAD+. As cetonas são derivadas da oxidação do etanol em acetaldeído, que é, por sua vez, convertido em acetato e depois em acetoacetato.40,41
- Os indivíduos geralmente apresentam sintomas clássicos de CAD que melhoram rapidamente com glicose intravenosa e grandes volumes de solução salina intravenosa. Ocasionalmente, o bicarbonato intravenoso pode ser necessário para corrigir o distúrbio metabólico.9
Nota importante 7: Outras Drogas e CAD-E
- Ingestão de drogas como salicilato, metanol, etilenoglicol e paraldeído também pode causar acidose metabólica com euglicemia, acompanhada por níveis aumentados de corpos cetônicos.39
- Em indivíduos com abuso de cocaína, a ingestão calórica pobre e os efeitos hipoglicêmicos da cocaína são causas potenciais de euglicemia observada durante a cetoacidose.12
- A medição dessas drogas e tóxicos pode ser útil para diagnóstico diferencial.
R5 No manejo CAD-E, É RECOMENDADO iniciar prontamente a hidratação e correção das anormalidades eletrolíticas, usando fluidos intravenosos, seguido de insulina IV em solução contendo glicose, até que o anion gap e os níveis de bicarbonato se normalizem.
| Classe I | Nível C |
- Uma vez diagnosticado, o manejo de CAD-E é simples e semelhante ao da CAD. A base do tratamento envolve correção rápida de desidratação usando fluidos intravenosos e correção de anormalidades eletrolíticas.19,42,43 O segundo passo mais importante no manejo é o uso de insulina IV com uma solução contendo dextrose até o ânion gap, e os níveis de bicarbonato se normalizarem.43
- A administração de glicose usando porcentagens mais altas de dextrose (10 ou 20%) é necessária para facilitar a administração concomitante das quantidades relativamente grandes de insulina que são necessárias para corrigir a acidose severa nestes indivíduos.43
- É muito importante em vários casos prevenir a ocorrência de CAD-E em situações relevantes. Por exemplo, o manejo cuidadoso do DM em mulheres grávidas, particularmente no último trimestre da gravidez é muito importante para prevenir a descompensação e a ocorrência de CAD, incluindo a CAD-E.35
- O meio mais eficaz de prevenir a CAD associada ao iSGLT2 é garantir que o iSGLT2 seja prescrito de maneira adequada e suspenso durante qualquer situação que possa precipitar CAD (por exemplo, doença aguda, cirurgia, desidratação, ingestão excessiva de álcool).18
- Profissionais da saúde que tratam pessoas com DM1 e fazem uso de inibidores SGLT2 de forma off-label, devem suspender o medicamento se os indivíduos apresentarem qualquer cetonúria sintomática ou cetonemia.18
- Todos os indivíduos com DM2 devem ser orientados sobre hidratação suficiente e adequada, além da ingestão de carboidratos durante o uso de iSGLT2. Os médicos devem evitar o uso iSGLT2 em pessoas que são incapazes de tolerar a ingestão de alimentos por via oral, no perioperatório, com extrema perda de peso e dieta com muito baixo carboidrato.43,44,45
- A Tabela 1 mostra o manejo específico para cada uma das principais causas de CAD-E. A Tabela 2 mostra o manejo de CAD-E baseado na cetonemia.
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1. É RECOMENDADO que a cetonemia ou a cetonúria sejam imediatamente determinadas em todos os indivíduos com DM1 sintomáticos (quadro 2) e nos indivíduos com DM2 que apresentem sintomas associado a situações clínicas específicas (quadro 3), mesmo com glicemias abaixo de 200 mg/dL. | I | C |
| R2. É RECOMENDADO a atenção especial ao diagnóstico de CAD-E em indivíduos com DM2 tratados com iSGLT2, que apresentem sintomas (Quadro 2), ou quando houver fatores precipitantes (Quadro 4). | I | B |
| R3. É RECOMENDADO a suspensão do iSGLT2 entre 24-72h antes de cirurgia de grande porte, procedimentos invasivos planejados, ou exercícios muito intensos, para redução do risco de CAD-E. | I | C |
| R4. DEVE SER CONSIDERADO o diagnóstico de CAD-E em gestantes sintomáticas (quadro 2), com ou sem diagnóstico de Diabetes, geralmente ao final da gravidez, visto que é uma complicação com potencial de provocar morte materna e fetal. | I | C |
| R5. No manejo CAD-E, É RECOMENDADO iniciar prontamente a hidratação e correção das anormalidades eletrolíticas, usando fluidos intravenosos, seguido de insulina IV em solução contendo glicose, até que o anion gap e os níveis de bicarbonato se normalizem. | I | C |
Referências
- Barski L, Eshkoli T, Brandstaetter E, Jotkowitz A. Euglycemic diabetic ketoacidosis. Eur J Intern Med. maio de 2019;63:9–14.
- Plewa MC, Bryant M, King-Thiele R. Euglycemic Diabetic Ketoacidosis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 [citado 13 de novembro de 2021]. Disponível em: http://www.ncbi.nlm.nih.gov/books/NBK554570/
- Nasa P, Chaudhary S, Shrivastava PK, Singh A. Euglycemic diabetic ketoacidosis: A missed diagnosis. World J Diabetes. 15 de maio de 2021;12(5):514–23.
- Iqbal QZ, Mishiyev D, Zia Z, Ruggiero RA, Aftab G. Euglycemic Diabetic Ketoacidosis With Sodium-Glucose Cotransporter-2 Inhibitor Use Post-Bariatric Surgery: A Brief Review of the Literature. Cureus. 10 de outubro de 2020;12(10):e10878.
- Guo R-X, Yang L-Z, Li L-X, Zhao X-P. Diabetic ketoacidosis in pregnancy tends to occur at lower blood glucose levels: case-control study and a case report of euglycemic diabetic ketoacidosis in pregnancy. J Obstet Gynaecol Res. junho de 2008;34(3):324–30.
- Joseph F, Anderson L, Goenka N, Vora J. Starvation-induced true diabetic euglycemic ketoacidosis in severe depression. J Gen Intern Med. janeiro de 2009;24(1):129–31.
- Stoimenis D, Spyridonidou C, Theofanidou S, Petridis N, Papaioannou N, Iasonidou C, et al. Euglycemic Ketoacidosis in Spinal Muscular Atrophy. Case Rep Pediatr. 27 de janeiro de 2019;2019:1–3.
- Lee SH, Park JH, Hong M-K, Hyeon S, Kim MY, Lee SE, et al. True euglycemic diabetic ketoacidosis in a person with type 2 diabetes and Duchenne muscular dystrophy. Diabetes Res Clin Pract. abril de 2011;92(1):e7-8.
- McGuire LC, Cruickshank AM, Munro PT. Alcoholic ketoacidosis. Emerg Med J EMJ. junho de 2006;23(6):417–20.
- Nakamura K, Inokuchi R, Doi K, Fukuda T, Tokunaga K, Nakajima S, et al. Septic ketoacidosis. Intern Med Tokyo Jpn. 2014;53(10):1071–3.
- Prater J, Chaiban JT. Euglycemic Diabetic Ketoacidosis with Acute Pancreatitis in a Patient Not Known to Have Diabetes. AACE Clin Case Rep. maio de 2015;1(2):e88–91.
- Abu-Abed Abdin A, Hamza M, Khan MS, Ahmed A. Euglycemic Diabetic Ketoacidosis in a Patient with Cocaine Intoxication. Case Rep Crit Care. 2016;2016:4275651.
- Peters AL, Buschur EO, Buse JB, Cohan P, Diner JC, Hirsch IB. Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care. setembro de 2015;38(9):1687–93.
- Bonora BM, Avogaro A, Fadini GP. Euglycemic Ketoacidosis. Curr Diab Rep. julho de 2020;20(7):25.
- Bonora BM, Avogaro A, Fadini GP. Sodium-glucose co-transporter-2 inhibitors and diabetic ketoacidosis: An updated review of the literature. Diabetes Obes Metab. 2018;20(1):25–33.
- Bakris GL, Fonseca VA, Sharma K, Wright EM. Renal sodium-glucose transport: role in diabetes mellitus and potential clinical implications. Kidney Int. junho de 2009;75(12):1272–7.
- Rosenstock J, Ferrannini E. Euglycemic Diabetic Ketoacidosis: A Predictable, Detectable, and Preventable Safety Concern With SGLT2 Inhibitors. Diabetes Care. setembro de 2015;38(9):1638–42.
- Danne T, Garg S, Peters AL, Buse JB, Mathieu C, Pettus JH, et al. International Consensus on Risk Management of Diabetic Ketoacidosis in Patients With Type 1 Diabetes Treated With Sodium-Glucose Cotransporter (SGLT) Inhibitors. Diabetes Care. junho de 2019;42(6):1147–54.
- Munro JF, Campbell IW, McCuish AC, Duncan LJP. Euglycaemic Diabetic Ketoacidosis. Br Med J. 9 de junho de 1973;2(5866):578–80.
- Jenkins D, Close CF, Krentz AJ, Nattrass M, Wright AD. Euglycaemic diabetic ketoacidosis: does it exist? Acta Diabetol. 1993;30(4):251–3.
- Taylor SI, Blau JE, Rother KI. SGLT2 Inhibitors May Predispose to Ketoacidosis. J Clin Endocrinol Metab. agosto de 2015;100(8):2849–52.
- Goldenberg RM, Berard LD, Cheng AYY, Gilbert JD, Verma S, Woo VC, et al. SGLT2 Inhibitor-associated Diabetic Ketoacidosis: Clinical Review and Recommendations for Prevention and Diagnosis. Clin Ther. dezembro de 2016;38(12):2654-2664.e1.
- Meyer EJ, Gabb G, Jesudason D. SGLT2 Inhibitor-Associated Euglycemic Diabetic Ketoacidosis: A South Australian Clinical Case Series and Australian Spontaneous Adverse Event Notifications. Diabetes Care. abril de 2018;41(4):e47–9.
- Hine J, Paterson H, Abrol E, Russell-Jones D, Herring R. SGLT inhibition and euglycaemic diabetic ketoacidosis. Lancet Diabetes Endocrinol. julho de 2015;3(7):503–4.
- Monami M, Nreu B, Zannoni S, Lualdi C, Mannucci E. Effects of SGLT-2 inhibitors on diabetic ketoacidosis: A meta-analysis of randomised controlled trials. Diabetes Res Clin Pract. agosto de 2017;130:53–60.
- Wang L, Voss EA, Weaver J, Hester L, Yuan Z, DeFalco F, et al. Diabetic ketoacidosis in patients with type 2 diabetes treated with sodium glucose co-transporter 2 inhibitors versus other antihyperglycemic agents: An observational study of four US administrative claims databases. Pharmacoepidemiol Drug Saf. 2019;28(12):1620–8.
- Douros A, Lix LM, Fralick M, Dell’Aniello S, Shah BR, Ronksley PE, et al. Sodium-Glucose Cotransporter-2 Inhibitors and the Risk for Diabetic Ketoacidosis : A Multicenter Cohort Study. Ann Intern Med. 15 de setembro de 2020;173(6):417–25.
- Nathan DM. Adjunctive Treatments for Type 1 Diabetes. N Engl J Med. 14 de 2017;377(24):2390–1.
- Tahrani AA, Barnett AH, Bailey CJ. SGLT inhibitors in management of diabetes. Lancet Diabetes Endocrinol. outubro de 2013;1(2):140–51.
- Handelsman Y, Henry RR, Bloomgarden ZT, Dagogo-Jack S, DeFronzo RA, Einhorn D, et al. AMERICAN ASSOCIATION OF CLINICAL ENDOCRINOLOGISTS AND AMERICAN COLLEGE OF ENDOCRINOLOGY POSITION STATEMENT ON THE ASSOCIATION OF SGLT-2 INHIBITORS AND DIABETIC KETOACIDOSIS. Endocr Pract Off J Am Coll Endocrinol Am Assoc Clin Endocrinol. junho de 2016;22(6):753–62.
- American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes-2021. Diabetes Care. january 2021;44(Suppl 1): S111–24.
- FDA Says Stop SGLT2 Inhibitors for Diabetes Prior to Surgery [Internet]. Medscape. [citado 13 de novembro de 2021]. Disponível em: http://www.medscape.com/viewarticle/927047
- Dalfrà MG, Burlina S, Sartore G, Lapolla A. Ketoacidosis in diabetic pregnancy. J Matern-Fetal Neonatal Med Off J Eur Assoc Perinat Med Fed Asia Ocean Perinat Soc Int Soc Perinat Obstet. setembro de 2016;29(17):2889–95.
- Chauhan SP, Perry KG, McLaughlin BN, Roberts WE, Sullivan CA, Morrison JC. Diabetic ketoacidosis complicating pregnancy. J Perinatol Off J Calif Perinat Assoc. junho de 1996;16(3 Pt 1):173–5.
- Cullen MT, Reece EA, Homko CJ, Sivan E. The changing presentations of diabetic ketoacidosis during pregnancy. Am J Perinatol. outubro de 1996;13(7):449–51.
- Jaber JF, Standley M, Reddy R. Euglycemic Diabetic Ketoacidosis in Pregnancy: A Case Report and Review of Current Literature. Case Rep Crit Care. 2019;2019:8769714.
- Rottenstreich A, Keidar A, Yuval JB, Abu-Gazala M, Khalaileh A, Elazary R. Outcome of bariatric surgery in patients with type 1 diabetes mellitus: our experience and review of the literature. Surg Endosc. 2016;30(12):5428–33.
- Kirwan JP, Aminian A, Kashyap SR, Burguera B, Brethauer SA, Schauer PR. Bariatric Surgery in Obese Patients With Type 1 Diabetes. Diabetes Care. junho de 2016;39(6):941–8.
- Dillon ES, Dyer WW, Smelo LS. Ketone Acidosis in Nondiabetic Adults. Med Clin North Am. novembro de 1940;24(6):1813–22.
- Umpierrez GE, DiGirolamo M, Tuvlin JA, Isaacs SD, Bhoola SM, Kokko JP. Differences in metabolic and hormonal milieu in diabetic- and alcohol-induced ketoacidosis. J Crit Care. junho de 2000;15(2):52–9.
- Lefèvre A, Adler H, Lieber CS. Effect of ethanol on ketone metabolism. J Clin Invest. outubro de 1970;49(10):1775–82.
- Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN. Hyperglycemic Crises in Adult Patients With Diabetes. Diabetes Care. julho de 2009;32(7):1335–43.
- Nyenwe EA, Kitabchi AE. Evidence-based management of hyperglycemic emergencies in diabetes mellitus. Diabetes Res Clin Pract. dezembro de 2011;94(3):340–51.
- Qiu H, Novikov A, Vallon V. Ketosis and diabetic ketoacidosis in response to SGLT2 inhibitors: Basic mechanisms and therapeutic perspectives. Diabetes Metab Res Rev. 2017;33(5).
- Kalra S, Gupta Y, Patil S. Sodium-glucose cotransporter-2 inhibition and the insulin: Glucagon ratio: Unexplored dimensions. Indian J Endocrinol Metab. 2015;19(3):426.
Cite este artigo
Santomauro A, Junior A, Raduan R, Bertoluci M. Diagnóstico e Tratamento da Cetoacidose Diabética Euglicêmica. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-22, ISBN: 978-85-5722-906-8.