Autores: Ligia Mattos, Sharon Nina Admoni, Maria Cândida Parisi
Editor de Seção: Joaquim Custódio
Editor Chefe: Marcello Bertoluci
Ultima revisão em: 18/04/2023
DOI: 10.29327/557753.2022-20 | Cite este Artigo
Introdução
A prevalência de diabetes continua a aumentar em todo o mundo, levando a uma incidência crescente de complicações nos pés, incluindo infecções.1 As infecções do pé diabético estão associadas a morbidades substanciais, exigindo visitas frequentes ao médico, cuidados diários com úlceras, terapia antimicrobiana e procedimentos cirúrgicos, com altos custos de cuidados de saúde associados.2–3
De particular importância, infecções do pé diabético continuam a ser a complicação diabética mais frequente que requer hospitalização. A osteomielite pode complicar 20% das úlceras no diabetes e é o evento precipitante mais comum que leva à amputação de membros inferiores.4
Os resultados em pessoas com úlcera de pé diabético infectada são ruins: em grande estudo prospectivo, ao final de um ano, a úlcera havia cicatrizado em apenas 46% dos casos (e posteriormente recorreu em 10% deles), enquanto 15% morreram e 17% necessitaram de amputação da extremidade inferior.5–6 Assim, não é surpreendente que uma análise bibliográfica de pesquisas globais sobre úlceras de pé diabético nos últimos dez anos tenha constatado que a infecção pontuou entre os mais frequentes tópicos atuais e as publicações mais citadas.7
Gerenciar infecções do pé diabético requer atenção cuidadosa para diagnosticar adequadamente a condição, obter amostras adequadas para cultura, selecionar cuidadosamente a terapia antimicrobiana, determinar rapidamente quando as intervenções cirúrgicas são necessárias e fornecer qualquer cuidado adicional necessário ao tratamento da úlcera e da pessoa. Uma abordagem sistemática e baseada em evidências para gerenciar infecções do pé diabético provavelmente melhora os resultados, especificamente a resolução da infecção e a prevenção de complicações, como amputação de membros inferiores. Isso é melhor realizado por equipes interdisciplinares, que devem incluir entre os membros, sempre que possível, um especialista em doenças infecciosas ou em microbiologia clínica-médica.8
Recomendações
Diagnóstico da infecção
R1 – É RECOMENDADO considerar o diagnóstico de infecção no pé de um indivíduo com diabetes na presença de sinais clínicos locais ou sistêmicos de inflamação e classificar quanto à sua gravidade. (Quadro 1)
| Classe I | Nível C |
- As recomendações da SBD para o diagnóstico e estadiamento da infecção no pé DM são baseadas em consenso de experts e se alinham em boa parte com as diretrizes da International Working Group on the Diabetic Foot. O Quadro 1 é uma recomendação para avaliação clínica de paciente com suspeita de infecção no pé DM.
Quadro 1. Quando suspeitar e como graduar a infecção no pé DM.
| A. Existe infecção? | |
| Situação | Achados clínicos |
| Não infectado (1) | Ausência de sintomas locais ou sistêmicos de infecção |
| Infectado |
Pelo menos dois dos seguintes sinais locais*
|
| B. Qual a gravidade da infecção? | |
| Leve (2) |
|
| Moderada (3) |
|
| Grave (4) |
Presença de dois ou mais dos seguintes sintomas sistêmicos (SIRS)
|
| Osteomielite (O) | Ver critérios de osteomielite (Quadro 3) |
Quadro 1: Esses sinais devem ocorrer na ausência de trauma, gota, artropatia de Charcot aguda, fraturas, trombose ou estase venosa. (1) A presença de osteomielite pode ocorrer nas categorias moderada ou grave e será representada pela sigla (O). Deve ser indicada quando pertinente. (2).Infecção refere-se a qualquer parte do pé, não apenas de uma ferida ou úlcera. (3). Em qualquer direção, desde a borda da úlcera. (4) Se a osteomielite for demonstrada na ausência de ≥ 2 sinais e sintomas de inflamação local ou sistêmica, classificar o pé como grau 3 (O) (se < 2 critérios SIRS) ou grau 4 (O) se ≥ 2 critérios SIRS (síndrome da resposta inflamatória sistêmica). Fonte: Adaptado de IWGDF. 95
Exame físico duvidoso
R2 – Em pessoas com suspeita de infecção no pé, mas com exame físico duvidoso, DEVE SER CONSIDERADO o uso de marcadores inflamatórios séricos, como a velocidade de hemossedimentação (VHS) e a proteína C-reativa (PCR).
| Classe IIa | Nível C |
- Um estudo transversal pequeno avaliou 60 pessoas com DM2 com úlceras, sendo 30 clinicamente diagnosticadas com infecção, com base na presença de secreção purulenta ou, pelo menos, duas manifestações inflamatórias. A velocidade de hemossedimentação (VHS) e a proteína C reativa (PCR) foram significativamente mais elevadas no grupo infectado. O melhor ponto de corte para VHS foi 40,5 mmHg (90% de sensibilidade e 94% de especificidade). O melhor ponto de corte para PCR foi 0,21 (70% de sensibilidade e 74% de especificidade 74%). A melhor acurácia foi da VHS, seguida da PCR (0,967; p < 0,001) e 0,871; p < 0,001). O resultado sugere a VHS como melhor marcador de infecção de pé em pessoas com diabetes.9
Internação hospitalar
R3 – É RECOMENDADA a internação hospitalar para todas as pessoas com infecções graves e moderadas, ou associadas a comorbidades relevantes.
| Classe I | Nível C |
- A SBD recomenda a hospitalização com base na experiência de experts e na análise das condições da estrutura de saúde disponível. As indicações estão elencadas no Quadro 2.
- Evidências limitadas sugerem benefício na correção da hiperglicemia grave com o paciente internado.10
- A presença de infecção óssea não requer necessariamente hospitalização, exceto com infecção substancial de tecidos moles associada ou presença de sinais sistêmicos de infecção.
Quadro 2. Indicações de hospitalização.
| Indicações de hospitalização |
|
*Características complicadoras: Presença de corpo estranho, úlcera por punção, abscesso profundo, insuficiência arterial ou venosa, linfedema, doença ou tratamento imunossupressor, lesão renal aguda.
Temperatura cutânea do pé
R4 – NÃO É RECOMENDADA a utilização da determinação de temperatura cutânea do pé e da coleta microbiológica quantitativa para diagnóstico de infecção do pé diabético.
| Classe III | Nível C |
- O emprego de termografia infravermelha ou digital não fornece ajuda substancial no diagnóstico de infecção ou na previsão do resultado clínico em pessoas com úlcera do pé diabético atendidas em ambiente hospitalar. Embora a imagem infravermelha provavelmente não cause danos, ela é limitada pela baixa disponibilidade. É possível que tenha valor quando associado à avaliação fotográfica por meio da telemedicina no diagnóstico precoce de infecção do pé diabético.14
- A presença de grande número de bactérias na cultura (geralmente definido como ≥ 105 unidades formadoras de colônia por grama de tecido) tem sido sugerida como base para a diferenciação de úlcera do pé diabético infectado do não infectado.15–16 No entanto, não há dados convincentes (de cultura convencional ou métodos moleculares) que apoiem este conceito.17
Osteomielite: VHS e RX do pé
R5 – Na presença de úlcera ativa no pé, com suspeita de osteomielite, É RECOMENDADA a utilização da combinação dos dois testes, incluindo toque ósseo (“probe to bone”), VHS e/ou PCR e/ou procalcitonina e raio-X do pé, como exames iniciais subsidiários para o diagnóstico.
| Classe I | Nível B |
- A osteomielite está potencialmente subjacente a qualquer úlcera no pé diabético, especialmente aquelas existentes há muitas semanas ou extensas (> 2 cm), profundas ou localizadas sobre uma proeminência óssea, com exposição óssea ou acompanhadas de um dedo do pé eritematoso e inchado (“em salsicha”).18–19
- Em relação ao VHS, estudo retrospectivo de 107 pessoas com diabetes internadas por osteomielite histologicamente comprovada no pé avaliou o valor preditivo da velocidade de hemossedimentação. Após ajustes para fatores de confusão, o VHS teve bom valor preditivo para diagnóstico de osteomielite nesse perfil de paciente. A média do VHS nos pacientes internados com osteomielite foi elevada: 83.1 ± 29.8 (11.0 a 120.0) (n < 15 mm/h). O VHS isoladamente foi preditivo para osteomielite [OR 1.0204 (IC 95% 1.0033 a 1.0484; p = 0.0268; n = 61)]. Quanto mais elevado o VHS, maior foi a chance de osteomielite.20
- O teste toque ósseo (sondagem óssea) é o teste clínico mais útil para diagnóstico de osteomielite, embora seja examinador-dependente. A técnica e a experiência de quem executa, a localização da úlcera e a etiologia também afetam a confiabilidade do teste.21–22
- A sondagem óssea é um teste simples, exigindo apenas uma sonda de metal romba estéril.23 É barato e seguro, mas a concordância entre observadores é apenas moderada.
- Em uma revisão sistemática, incluindo sete estudos prospectivos e retrospectivos, com 1.017 pacientes incluídos com pé diabético infectado, o toque ósseo mostrou ter sensibilidade de 87% e especificidade de 83%.24 O diagnóstico de osteomielite é sugerido se for positivo em uma pessoa de alto risco; ele ajuda a descartar a osteomielite, quando negativo, em pessoas de baixo risco.
- Em relação ao RX do pé, quando interpretado por um avaliador experiente, os achados característicos de infecção óssea são altamente sugestivos de osteomielite. No entanto, a radiografia simples do pé tem baixa sensibilidade nas primeiras semanas de infecção, podendo apresentar-se negativo. Alguns achados anormais frequentemente podem ser confundidos com alterações comuns à osteoartropatia de Charcot.
Quadro 3. Características sugestivas de osteomielite
| Características da Osteomielite |
|
Algumas características, como sequestro, invólucro e cloaca, são vistas com menor frequência na osteomielite do pé diabético do que em pessoas mais jovens com osteomielite em ossos maiores. ** Geralmente com intervalo de várias semanas.
Osteomielite e ressonância magnética
R6 – Na suspeita de osteomielite, quando o diagnóstico não for claro após avaliação clínica, raio-X simples e exames laboratoriais, É RECOMENDADO confirmar o diagnóstico por ressonância magnética do pé ou PET- CT/ FDG ou cintilografia com leucócitos marcados.
| Classe I | Nível B |
- A ressonância magnética é o exame de imagem de referência para o diagnóstico de osteomielite. Tem sensibilidade de 90% e especificidade de 80%, e tem sido o teste mais amplamente usado por décadas.25
- A ressonância magnética oferece uma visão geral da presença de osteomielite e infecções de tecidos moles, além da estrutura anatômica dos dos ossos do pé. A presença de edema reativo da medula óssea de patologias não infecciosas, como trauma, cirurgia prévia do pé ou neuroartropatia de Charcot, diminui a especificidade e o valor preditivo positivo.26–27
- Em pessoas com neuro-osteoartropatia (pé de Charcot), técnicas mais novas, como angiografia por ressonância magnética, ressonância magnética com contraste dinâmico ou a neurografia, podem distinguir melhor o pé de Charcot da osteomielite.28–31
- Os testes de imagem mais recentes, especialmente PET/CT 18F-fluorodeoxiglicose (PET/CT-FDG) e Tc99m -exametazime e cintilografia com leucócitos marcados podem ser usados eventualmente em pessoas com contraindicações para a ressonância magnética. Esses testes têm especificidade ainda maior do que a ressonância magnética, especialmente porque discriminam quanto a alterações ósseas não infecciosas. Há, entretanto, limitações importantes para o seu uso, como a baixa disponibilidade, a necessidade de expertise e o custo.32–33
- Em comparação com outras técnicas de medicina nuclear (por exemplo, imagem de leucócitos), o PET (especialmente com CT) oferece alta resolução espacial e localização anatômica precisa, possivelmente maior sensibilidade para infecções crônicas, desempenho mais fácil, resultados mais rápidos e baixa exposição à radiação. No entanto, atualmente os dados de suporte para PET são menos robustos e são menos capazes de diferenciar infecção de inflamação (incluindo pé de Charcot agudo).34–35
- A imagem avançada (especialmente por meio da ressonância magnética) também é útil para o planejamento cirúrgico em casos selecionados, como para identificar coleções purulentas ou a extensão do envolvimento ósseo no pré-operatório.
- Em metanálise de nove estudos em pacientes com úlceras diabéticas, foi comparada a sensibilidade e a especificidade dos principais métodos de imagem para diagnóstico de osteomielite. A ressonância magnética foi o teste que mostrou maior sensibilidade.
A tabela 1 analisa a acurácia de diversos métodos diagnósticos para definir a presença de osteomielite em pé diabético.
Tabela 1. Análise de sensibilidade e especificidade para o diagnóstico de osteomielite associado à úlcera em pé diabético.36
| Método diagnóstico | n | Sensibilidade | Especificidade |
| Raio-x do pé | 177 | 0,54 (0,44-0,63) | 0,68 (0,53-0,80) |
| Ressonância magnética | 135 | 0,90 (0,82-0,95) | 0,79 (0,62-0,91) |
| Cintilografia óssea | 185 | 0,81 (0,73-0,87) | 0,28 (0,17-0,42) |
|
Cintilografia com leucócitos marcados |
269 | 0,74 (0,67-0,80) | 0,68 (0,57-0,78) |
Fonte: Adaptado de Dinh MT et al.³⁷
Nota importante 1 – Tomografia computadorizada do pé
- A tomografia computadorizada (TC) é mais disponível que a RM e a obtenção de imagens é menos demorada. A TC tem boa resolução espacial e pode demonstrar claramente a relação anatômica entre áreas de infecção e estruturas importantes, como a medula espinhal ou vasos principais. Portanto, aspirações percutâneas e biópsias são frequentemente realizadas sob orientação de TC para evitar danos a essas estruturas. A TC tem resolução óssea superior à RNM e é melhor para demonstrar alterações ósseas, como destruição cortical, reações periosteais e formação de sequestro. Assim como nas radiografias simples, o sequestro na TC aparece como uma lesão esclerótica com borda transparente. O gás intramedular é um sinal auxiliar da osteomielite, também melhor visualizado na TC.
- No entanto, reforça-se que a avaliação da osteomielite por meio da TC é limitada por sua pouca resolução na avaliação dos tecidos moles, quando comparada com a RM. A TC não é capaz de demonstrar edema da medula óssea, o que significa que uma TC normal não exclui a osteomielite precoce. Outras limitações da TC são a exposição à radiação ionizante e a degradação da imagem por artefato de listras na presença de implantes metálicos. Apesar dessas limitações, a TC continua sendo uma alternativa útil quando a RM não está disponível ou é contraindicada.37
Osteomielite e cultura do osso
R7 – Na suspeita de osteomielite na qual o diagnóstico definitivo ou a determinação da sensibilidade ao antibiótico do agente causal são necessários, deve ser colhida uma amostra asséptica de osso (de forma percutânea ou cirúrgica) para cultura e estudo histológico, este se possível.
| Classe I | Nível C |
- Estudos de vários tipos de infecção óssea,38–41 incluindo osteomielite do pé diabético, sugerem que receber terapia com antibióticos antes da cultura óssea não parece reduzir a porcentagem de culturas positivas ou o tempo de positividade da cultura.
- A obtenção de uma amostra de osso para diagnosticar osteomielite no pé diabético é o critério padrão-ouro para diagnosticar a infecção e a única forma definitiva de determinar o patógeno causador. A evidência disponível sugere que a coleta de uma amostra de osso seja realizada de maneira asséptica, via percutânea ou operatória, e nunca através da úlcera. A reprodutibilidade do método é baixa quando a amostra é coletada através da úlcera. Uma comparação direta e prospectiva entre 46 pares de biópsias ósseas obtidas de úlceras em pessoas com suspeita de osteomielite em pé diabético mostrou resultados idênticos em apenas 42% dos casos.42 O procedimento é considerado seguro e fornece avaliação precisa do agente microbiano.43–46
- A biópsia percutânea óssea não será necessária se, em uma amostra de tecido profundo coletado assepticamente de uma infecção de partes moles, crescer apenas um único patógeno, especialmente o Staphylococcus aureus.43–44
- O exame de cultura do osso tem a vantagem de determinar o patógeno causador; contudo, a histologia da lesão pode ser mais sensível se o paciente estiver sob antibioticoterapia, ou quando houver suspeita de contaminação.
- Em relação à histopatologia, a concordância entre avaliadores no diagnóstico de osteomielite é baixa, ficando em menos de 40% em um estudo.47 A concordância entre histopatologia e cultura de espécimes ósseos do pé também é pobre, chegando a 41% em outro estudo.48
Nota importante 2: Momento da biópsia óssea
Para minimizar culturas falso-negativas, deve-se realizar a biópsia óssea pelo menos duas semanas após o término da antibioticoterapia.43–44
Nota importante 3: Exame Cultural de partes moles
Cultura de espécimes de partes moles (mesmo aqueles coletados perto do osso) muitas vezes perdem patógenos causadores ou produzem contaminantes prováveis e, portanto, são menos precisos do que culturas de osso. As taxas de concordância relatadas entre culturas simultâneas de partes moles e osso são baixas e não passam de 50%.49–50
R8 – Em razão da limitação de evidências, a utilização de técnicas de biologia molecular em microbiologia NÃO É RECOMENDADA como primeira linha de identificação do agente causal.
| Classe III | Nível C |
- Técnicas de microbiologia molecular demonstraram na maioria das infecções do pé diabético que a microbiota é mais diversa e abundante do que aquela revelada por métodos convencionais de cultura.51–53 Em comparação com técnicas de cultura convencionais, os métodos moleculares também são mais caros e exigem mais tempo de processamento.
- Em geral, há boa correlação entre sequenciamento molecular e métodos de cultura convencionais em relação aos patógenos clinicamente relevantes identificados.54 As evidências, no entanto, ainda são limitadas com essa abordagem; estudos escassos e com populações pequenas testaram o sequenciamento molecular para infecção de partes moles ou osteomielite.
Infecção de partes moles
R9 – Em pessoas com infecção de partes moles no pé, DEVE SER CONSIDERADA a escolha empírica de antibióticos conforme a gravidade da infecção e a prevalência dos patógenos locais (Tabela 2).
| Classe IIa | Nível C |
- Os patógenos mais comuns em infecção do pé diabético são cocos Gram-positivos aeróbios, especialmente S. aureus, e, em menor extensão, estreptococos e estafilococos coagulase-negativos. As infecções geralmente são polimicrobianas.
- A SBD recomenda o uso do tabela 2 como guia de escolha da antibioticoterapia, com base na opinião de experts. A maioria das infecções poderá variar de acordo com o perfil microbiológico e as recomendações da comissão de controle de infecção hospitalar de cada localidade.
- Na escolha de antibiótico, devem ser consideradas questões como: 1) terapia antibiótica prévia, 2) presença de bacilos Gram-negativos isolados em cultura anterior recente, 3) exposição frequente a meio úmido (Pseudomonas aeruginosa) e 4) ambiente de origem com patógenos que costumam ser resistentes a antibióticos comumente usados para a escolha de um regime antibiótico empírico.
- O tratamento empírico voltado para P. aeruginosa deve ser considerado em climas tropicais/subtropicais e quando a P. aeruginosa for isolada de culturas anteriores na mesma pessoa.
- Deve-se pensar em bactérias anaeróbicas especialmente em membros isquêmicos e em caso de abcessos.52–55 O tratamento empírico com um imidazólico (metronidazol) ou betalactâmico com inibidor da betalactamase deve ser considerado quando estiver associado à isquemia ou à secreção com odor fétido.
Nota importante 4: Cobertura dos antibióticos
- Em pessoas com infecção leve, sem antibioticoterapia prévia recente, o tratamento empírico inicial deve cobrir agentes comunitários mais comuns como Gram-positivos aeróbicos (Streptococcus beta-hemolíticos e Staphylococcus aureus).
- Em pessoas que já tenham sido tratadas com antibióticos há poucas semanas e apresentando infecção moderada a grave, é necessária uma cobertura que envolva Gram-positivos, Gram-negativos comuns e anaeróbios. Este esquema deverá ser revisto conforme resposta clínica e resultados microbiológicos.
- Em pessoas com recidiva de processo infeccioso de partes moles, deve ser considerado o tratamento empírico com antibioticoterapia direcionada para Pseudomonas aeruginosa, se este agente já tiver sido isolado em processo anterior recente.
Tabela 2. Regimes de tratamento antibiótico empírico para infecções do pé diabético*
|
Gravidade da infecção |
Fatores adicionais |
Patógenos usuais |
Tratamentos empíricos potenciais |
| Leve |
Sem complicações |
Coco Gram + |
|
|
Alergia ou intolerância a beta lactâmicos |
Coco Gram + |
|
|
|
Exposição recente a antibióticos |
Coco Gram + Bacilo Gram - |
|
|
| Alto risco de MRSA | MRSA |
|
|
|
Moderada a grave |
Sem complicações |
Coco Gram + Bacilo Gram - |
|
| Antibióticos recentes |
Coco Gram + Bacilo Gram - |
|
|
| Úlcera macerada ou clima quente |
Bacilo Gram - Pseudomonas |
|
|
|
Perna isquêmica/ ou necrose ou formação de gás |
Coco Gram + Bacilo Gram - e anaeróbios |
|
|
|
Fator de risco para MRSA |
MRSA |
|
|
|
Fator de risco para Bacilo Gram-resistente |
Espectro estendido a organismos produtores de Beta lactamase |
|
* Recomendações baseadas em considerações teóricas e resultados de ensaios clínicos disponíveis. MRSA: Staphylococcus aureus meticilino-resistente; S-S pen: penicilina semi sintética resistente à penicilinase. Notas: Onde mais de um agente estiver citado, apenas um deles deve ser prescrito, a menos que indicado de outra forma. Antibióticos orais geralmente não devem ser usados para infecções graves, exceto como acompanhamento (substituição) após a terapia parenteral inicial.
Nota importante 5: Antibioticoterapia
Recomenda-se administrar, inicialmente, antibióticos parenterais em todas as infecções graves do pé diabético. Se a infecção apresentar evolução favorável, podem ser mudados para terapêutica oral. Tratar todas as infecções leves e a maioria das moderadas com antibioticoterapia oral, desde o início ou após melhora de tratamento inicial com antibioticoterapia parenteral
R10 – NÃO É RECOMENDADO utilizar agentes antimicrobianos tópicos, mesmo no tratamento das infecções leves do pé diabético.
| Classe III | Nível C |
- A maioria das infecções do pé diabético pode ser tratada com sucesso com terapia antibiótica adequadamente selecionada, combinada com cirurgia, controle metabólico adequado e cuidado local da úlcera.
- As evidências em relação à terapia antimicrobiana tópica são muito limitadas e não demonstraram superioridade em relação ao tratamento padrão isolado.56
Duração do tratamento: partes moles
R11 – O tempo de antibioticoterapia em infecções de partes moles é de uma semana a duas semanas, podendo ser prolongado para três semanas a quatro semanas se infecção extensa, resposta inadequada ou presença de doença arterial periférica grave. Na ausência de resolução após quatro semanas de antibioticoterapia, É RECOMENDADO reavaliar e reconsiderar novos estudos diagnósticos e alternativas terapêuticas.
| Classe I | Nível C |
A recomendação da duração do tratamento para infecção de partes moles é baseada em opinião e experiência de especialistas e leva em conta a disponibilidade de tratamento, métodos diagnósticos e o tempo de resposta usual observado na experiência individual.
Nota importante 6: Duração do tratamento da Osteomielite:
No tratamento da osteomielite devem ser usados antibióticos por até 6 semanas. Se a infecção não melhorar clinicamente nas primeiras 2-4 semanas, deve-se reconsiderar a necessidade de coletar amostra de osso para exame cultural, tratamento cirúrgico ou esquema antibiótico alternativo. Caso tenha sido necessário tratamento parenteral inicial, considerar trocar para antibioticoterapia oral após 5-7 dias, de acordo com o resultado do exame cultural. Quando a opção for por ressecção cirúrgica do osso, se não houver infecção de partes moles e todo osso tiver sido removido cirurgicamente, tratar com antibióticos por apenas alguns dias.
- No tratamento da osteomielite, a antibioticoterapia isolada pode ser considerada. Mas em geral é necessário algum procedimento cirúrgico (desbridamento, cultura, até ressecção cirúrgica do osso acometido), especialmente quando há infecção de partes moles associada. A ressecção cirúrgica de osso infectado tem sido o tratamento padrão da osteomielite.
- Como a penetração óssea dos antibióticos é variável, sugere-se manter a dosagem na extremidade superior da faixa de dosagem. Os antibióticos com melhor penetração óssea são: clindamicina, vários inibidores de betalactamase (por exemplo, ampicilina / sulbactam), fluoroquinolonas e sulfametoxazol-trimetropim.57–59. A rifampicina tem um papel antibiofilme importante e, portanto, não deve ser usada como monoterapia, salvo nos casos em que se tenha um agente isolado com sensibilidade comprovada.59
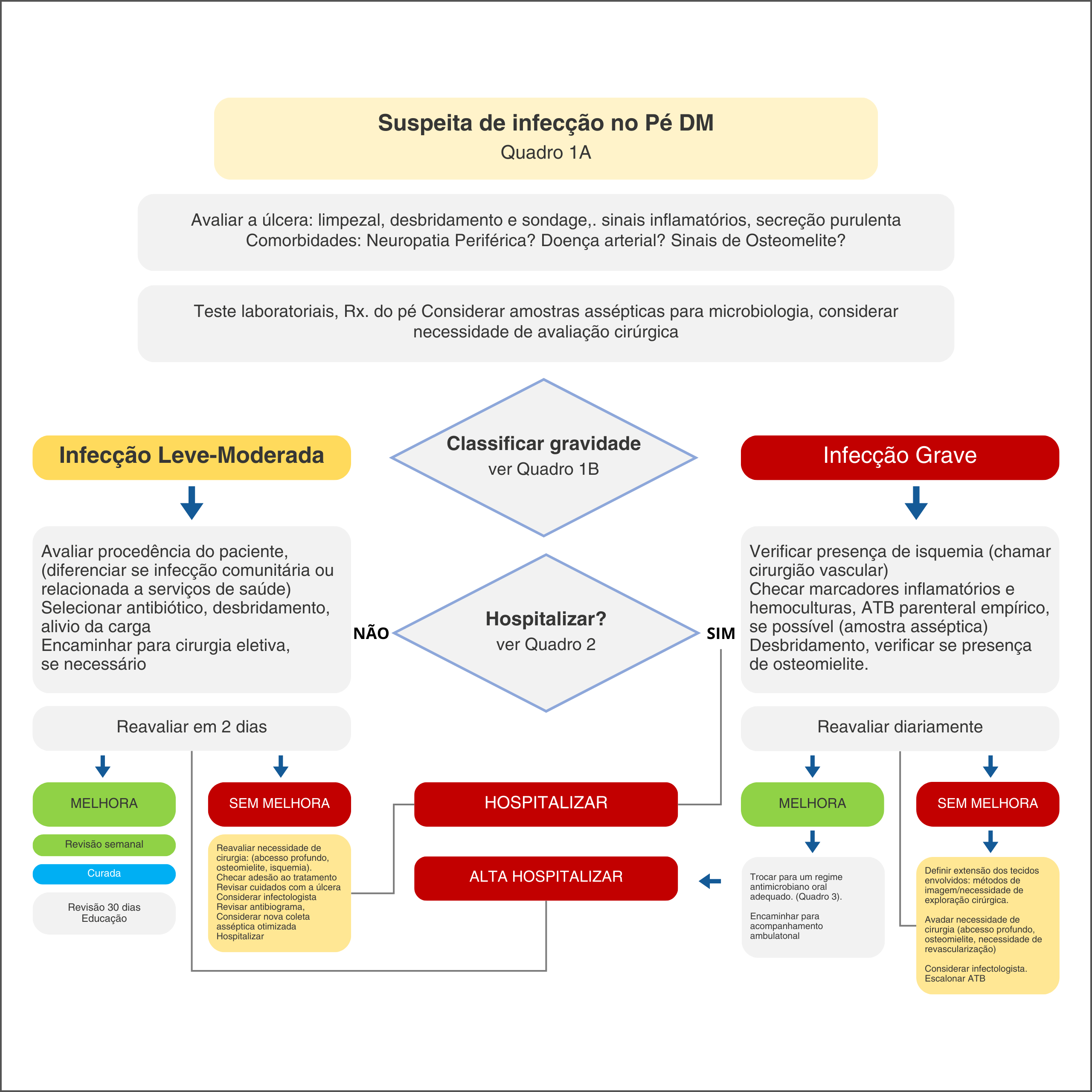
Figura 1. Fluxograma para o atendimento ao Pé Diabético com suspeita de infecção
Profilaxia com antibióticos
R12 – NÃO É RECOMENDADO tratar úlceras não infectadas com antibioticoterapia profilática.
| Classe III | Nível C |
- Não há dados convincentes para apoiar o conceito de que a profilaxia com antibióticos em úlceras clinicamente não infectadas acelera a cicatrização ou reduz o risco de desenvolver infecção clinicamente aparente.60
- Estudo de 77 pessoas com úlceras não infectadas em pé diabético, seguidas com culturas repetidas, revelou que nenhum parâmetro de cultura demonstrou valor preditivo para quaisquer resultados.61
Tratamento cirúrgico da infecção
R13 – Durante a ressecção de osso por osteomielite, na investigação de infecção residual, É RECOMENDADO realizar a coleta de tecido ósseo adjacente ao osso retirado para cultura e histologia. Caso seja identificado um agente patogênico ou reconhecido um padrão de osteomielite, recomenda-se ampliar o tempo de antibioticoterapia por mais seis semanas.
| Classe I | Nível B |
- Vários estudos demonstraram que um terço a dois terços das pessoas de quem o cirurgião obtém uma amostra de osso clinicamente não infectado (denominado de osso “marginal”, “distal” ou “proximal”) após a ressecção têm cultura ou evidência patológica com infecção residual.62–66 Este achado provavelmente significa restos ósseos infectados, exigindo mais antibiótico e/ou tratamento cirúrgico. É crucial que a amostra óssea seja coletada da forma mais asséptica possível, inclusive usando um novo conjunto de instrumentos esterilizados.
- Uma amostra de osso obtida durante a cirurgia pode ter maior probabilidade de ser contaminada por partes moles adjacentes infectadas do que uma biópsia percutânea. A possibilidade de que muitas das culturas ósseas positivas sejam falso-positivas é apoiada pela prevalência substancialmente mais baixa de histologia positiva na mesma amostra em dois estudos.62,65
- As culturas também podem ser falsamente negativas, especialmente em pessoas tratadas com antibióticos ou quando as amostras não são transportadas e processadas de forma adequada. Um problema adicional é a falta de uma definição consensual de osteomielite no pé diabético.
- Em dois estudos observacionais retrospectivos, com 111 62 e 27 pacientes63, observou-se que pacientes cuja margem de ressecção era positiva para osteomielite evoluíram com maior risco de desfechos negativos, como falência terapêutica, deiscência da ferida, ulceração, nova amputação ou morte. Outro estudo,64 que avaliou o desfecho de 54 amputações parciais realizadas por cirurgiões gerais, reforçou a necessidade de estadiamento de imagem prévio ao procedimento, tendo em vista a grande taxa de infecção residual encontrada. Portanto, seria prudente oferecer à maioria das pessoas com cultura óssea positiva maior tempo de tratamento antibiótico.
Oxigenioterapia hiperbárica
R14 – No pé diabético infectado NÃO É RECOMENDADO utilizar oxigenioterapia hiperbárica ou oxigênioterapia tópica como terapia adjuvante, se a indicação for especificamente para tratar infecção.
| Classe III | Nível B |
- A oxigenioterapia hiperbárica tem uma variedade de efeitos antimicrobianos nos tecidos moles e ossos que ainda estão sob discussão.67–72
- Uma revisão sistemática de relatos de casos e um estudo de coorte sugere que o tratamento da osteomielite crônica com oxigenioterapia hiperbárica adjuvante pode melhorar os desfechos clínicos relacionados à osteomielite. Porém a qualidade das evidências disponíveis desta revisão é muito baixa, com resultados ainda inconclusivos.73, 74
Uso de fatores de crescimento:
R15 – NÃO É RECOMENDADO o uso de fatores de crescimento como tratamento adjuvante para tratar infecção em úlcera do pé diabético.
| Classe III | Nível B |
- O fator estimulador de colônias de granulócitos (G-CSF) aumenta a liberação de células progenitoras endoteliais de neutrófilos da medula óssea e melhora as funções dos neutrófilos, que costumam ser prejudicadas em pessoas com diabetes.
- Revisão sistemática do banco de dados Cochrane atualizada em 2013 concluiu que o tratamento com G-CSF não parece aumentar a probabilidade de resolução da infecção ou cicatrização da úlcera do pé.75
Terapias adjuvantes à antibioticoterapia
R16 – Em pacientes com úlceras infectadas, tratamentos adjuvantes de rotina, como antissépticos tópicos, curativos com prata, mel, terapia cutânea com bacteriófagos e terapia de pressão negativa, embora sua eficácia não esteja totalmente estabelecida, PODEM SER CONSIDERADOS, desde que com o uso concomitante da antibioticoterapia específica.
| Classe IIb | Nível C |
- Vários tipos de antissépticos têm sido usados para tratar úlceras do pé diabético, mas não há evidências que apoiem essa prática.56
Prata
- A prata demonstrou ter efeito antibacteriano, e tratamentos tópicos (cremes, curativos) são amplamente utilizados para úlceras do pé diabético infectadas.76 Há evidência de revisões sistemáticas que apoiam a eficácia no tratamento ou prevenção da infecção da úlcera.77
- Vários pequenos estudos, entretanto, demonstraram benefícios anti-infecciosos para alguns agentes antissépticos, como cadexômero de iodo e soluções hipoclorosas, em úlceras infectadas. Há evidências de que curativos com prata, cadexômero de iodo e soluções hipoclorosas reduzem a carga microbiana nas úlceras.78–79 As evidências disponíveis são insuficientes para estabelecer se curativos contendo prata ou agentes tópicos promovem a cicatrização da úlcera ou previnem infecção da úlcera. Para evitar promover o desenvolvimento de resistência, deve-se evitar o uso de antibióticos tópicos, que também podem ser administrados de forma sistêmica.
Sacarose
- Estudos sugerem que o uso de curativo impregnado de octassulfato de sacarose é ineficaz no tratamento de úlceras infectadas. Seu uso pode ser considerado em úlceras neuroisquêmicas não infetadas que não cicatrizam após quatro semanas a seis semanas, apesar do tratamento clínico ideal.80–81
Mel
- O mel é usado há muito tempo no tratamento de vários tipos de úlceras, incluindo úlceras de pé diabético, por seus aparentes efeitos de cicatrização. Isso pode ser pelo menos parcialmente mediado por suas propriedades antibacterianas, antioxidantes e anti-inflamatórias, além de seus efeitos na osmolaridade, acidificação do pH e aumento dos fatores de crescimento.82 Não há, entretanto, estudos publicados que demonstrem claramente a eficácia contra achados clínicos de infecção.83–84
Bacterófagos
- Os bacteriófagos têm sido usados clinicamente há mais de 100 anos, mas os dados disponíveis sobre a eficácia (principalmente na Europa Oriental, muitos deles in vitro) são limitados.
- As poucas publicações sobre o uso de bacteriófagos são séries de casos de baixa qualidade sem um grupo de controle,85–86 que sugerem que eles podem ser seguros e até eficazes em alguns tipos de úlceras infectadas, mas os produtos comerciais são limitados e não estão disponíveis em muitos países. Embora a incidência de infecção com resistência antimicrobiana extensa ou mesmo completa esteja aumentando em alguns países, a antibioticoterapia ainda é preferível por causa da escassa evidência disponível para bacteriófagos. A terapia antimicrobiana com bacteriófagos pode, entretanto, ser uma opção a ser estudada.
Terapia com pressão negativa
- A terapia da úlcera com pressão negativa envolve a aplicação de um curativo especial conectado a uma máquina de sucção a vácuo que aspira o fluido da úlcera e do tecido da área tratada para uma vasilha.87 Algumas evidências demonstram que terapia da úlcera com pressão negativa resulta em condições moleculares mais pró angiogênicas e anti-inflamatórias em úlceras.88
- Terapia da úlcera com pressão negativa com instilação é um sistema que incorpora tanto a instilação (usando um dos vários tipos de fluidos estéreis) quanto a aspiração para limpar e, possivelmente, desinfetar úlceras.89
- Embora muitos estudos publicados tenham demonstrado a segurança e a eficácia na cicatrização de úlceras com a terapia com pressão negativa, a qualidade das evidências ainda é baixa. Poucos estudos abordaram as complicações do pé diabético90 e nenhum abordou especificamente se houve benefício na resolução de evidências de infecção da úlcera.
Terapia fotodinâmica
- A terapia fotodinâmica usa uma combinação de uma droga fotossensibilizante e luz visível, e demonstrou efeito bactericida in vitro com potencial ação para fungos e vírus. Quase todos os fotossensibilizadores mostram atividade fotodinâmica contra bactérias Gram-positivas, mas a atividade contra bactérias Gram-negativas é limitada a certos fotossensibilizadores catiônicos. Alguns pequenos estudos publicados, de baixa qualidade, relataram que a terapia fotodinâmica reduziu a carga bacteriana, curou infecções e pode ter ajudado a reduzir amputações de membros inferiores.91–94
- Embora a terapia fotodinâmica pareça ser segura e bem tolerada, produtos comerciais ainda não estão disponíveis na maioria dos países e não está claro se o uso de terapia fotodinâmica sem antibioticoterapia sistêmica será possível para a maioria das pessoas.95
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1 – É RECOMENDADO considerar o diagnóstico de infecção no pé de um indivíduo com diabetes na presença de sinais clínicos locais ou sistêmicos de inflamação e classificar quanto à sua gravidade. (Quadro 1) | I | C |
| R2 – Em pessoas com suspeita de infecção no pé, mas com exame físico duvidoso, DEVE SER CONSIDERADO o uso de marcadores inflamatórios séricos, como a velocidade de hemossedimentação (VHS) e a proteína C-reativa (PCR). | IIa | C |
| R3 – É RECOMENDADA a internação hospitalar para todas as pessoas com infecções graves e moderadas, ou associadas a comorbidades relevantes. | I | C |
| R4 – NÃO É RECOMENDADA a utilização da determinação de temperatura cutânea do pé e da coleta microbiológica quantitativa para diagnóstico de infecção do pé diabético. | III | C |
| R5 – Na presença de úlcera ativa no pé, com suspeita de osteomielite, É RECOMENDADA a utilização da combinação dos dois testes, incluindo toque ósseo (“probe to bone"), VHS e/ou PCR e/ou procalcitonina e raio-X do pé, como exames iniciais subsidiários para o diagnóstico. | I | B |
| R6 – Na suspeita de osteomielite, quando o diagnóstico não for claro após avaliação clínica, raio-X simples e exames laboratoriais, É RECOMENDADO confirmar o diagnóstico por ressonância magnética do pé ou PET- CT/ FDG ou cintilografia com leucócitos marcados | I | B |
| R7 – Na suspeita de osteomielite na qual o diagnóstico definitivo ou a determinação da sensibilidade ao antibiótico do agente causal são necessários, deve ser colhida uma amostra asséptica de osso (de forma percutânea ou cirúrgica) para cultura e estudo histológico, este se possível. | I | C |
| R8 – Em razão da limitação de evidências, a utilização de técnicas de biologia molecular em microbiologia NÃO É RECOMENDADA como primeira linha de identificação do agente causal. | III | C |
| R9 – Em pessoas com infecção de partes moles no pé, DEVE SER CONSIDERADA a escolha empírica de antibióticos conforme a gravidade da infecção e a prevalência dos patógenos locais (Quadro 3). | IIa | C |
| R10 – NÃO É RECOMENDADO utilizar agentes antimicrobianos tópicos, mesmo no tratamento das infecções leves do pé diabético. | III | C |
| R11 – O tempo de antibioticoterapia em infecções de partes moles é de uma semana a duas semanas, podendo ser prolongado para três semanas a quatro semanas se infecção extensa, resposta inadequada ou presença de doença arterial periférica grave. Na ausência de resolução após quatro semanas de antibioticoterapia, É RECOMENDADO reavaliar e reconsiderar novos estudos diagnósticos e alternativas terapêuticas. | I | C |
| R12 – NÃO É RECOMENDADO tratar úlceras não infectadas com antibioticoterapia profilática. | III | C |
| R13 – Durante a ressecção de osso por osteomielite, na investigação de infecção residual, É RECOMENDADO realizar a coleta de tecido ósseo adjacente ao osso retirado para cultura e histologia. Caso seja identificado um agente patogênico ou reconhecido um padrão de osteomielite, recomenda-se ampliar o tempo de antibioticoterapia por mais seis semanas. | I | B |
| R14 – No pé diabético infectado NÃO SE DEVE UTILIZAR oxigenoterapia hiperbárica ou oxigênioterapia tópica como terapia adjuvante, se a indicação for especificamente para tratar infecção. | III | B |
| R15 – NÃO É RECOMENDADO o uso de fatores de crescimento como tratamento adjuvante para tratar infecção em úlcera do pé diabético. | III | B |
| R16 – Em pacientes com úlceras infectadas, tratamentos adjuvantes de rotina, como antissépticos tópicos, curativos com prata, mel, terapia cutânea com bacteriófagos e terapia de pressão negativa, embora sua eficácia não esteja totalmente estabelecida, PODEM SER CONSIDERADOS, desde que com o uso concomitante da antibioticoterapia específica. | IIb | C |
Referências
- International Diabetes Federation. IDF Diabetes Atlas. 9th ed. Brussels, Belgium. 2019. Available from: www.diabetesatlas.org.
- Raspovic KM, Wukich DK. Self-reported quality of life and diabetic foot infections. J Foot Ankle Surg. 2014;53:716-9.
- Peters EJ, Childs MR, Wunderlich RP, Harkless LB, Armstrong DG, Lavery LA. Functional status of persons with diabetes-related lower-extremity amputations. Diabetes Care. 2001;24:1799-804.
- Lavery LA, Armstrong DG, Murdoch DP, Peters EJ, Lipsky BA. Validation of the Infectious Diseases Society of America’s diabetic foot infection classification system. Clin Infect Dis. 2007;44:562-5.
- Ndosi M, Wright-Hughes A, Brown S, et al. Prognosis of the infected diabetic foot ulcer: a 12-month prospective observational study. Diabet Med. 2018;35:78-88.
- Tan TW, Shih CD, Concha-Moore KC, et al. Disparities in outcomes of patients admitted with diabetic foot infections. PLoS One. 2019;14:e0211481.
- Zha ML, Cai JY, Chen HL. A bibliometric analysis of global research production pertaining to diabetic foot ulcers in the past ten years. J Foot Ankle Surg. 2019;58:253-9.
- Paisley AN, Kalavalapalli S, Subudhi CP, Chadwick PR, Chadwick PJ, Young B. Real time presence of a microbiologist in a multidisciplinary diabetes foot clinic. Diabetes Res Clin Pract. 2012;96:e1-3.
- Jafari JM, Firouzabadi MS, Morteza IM, et al. Can procalcitonin be an accurate diagnostic marker for the classification of diabetic foot ulcers? Int J Endocrinol Metab. 2014 Jan12(1):e13376. doi: 10.5812/ijem.13376.
- Uckay I, Jornayvaz FR, Lebowitz D, Gastaldi G, Gariani K, Lipsky BA. An overview on diabetic foot infections, including issues related to associated pain, hyperglycemia and limb ischemia. Curr Pharm Des. 2018;24:1243-54.
- Lipsky BA, Pecoraro RE, Larson SA, Hanley ME, Ahroni JH. Outpatient management of uncomplicated lower- extremity infections in diabetic patients. Arch Intern Med. 1990;150:790-7.
- Commons RJ, Raby E, Athan E, et al. Managing diabetic foot infections: a survey of Australasian infectious diseases clinicians. J Foot Ankle Res. 2018;11:13.
- Barwell ND, Devers MC, Kennon B, et al. Diabetic foot infection: antibiotic therapy and good practice recommendations. Int J Clin Pract. 2017;71.
- Armstrong DG, Lipsky BA, Polis AB, Abramson MA. Does dermal thermometry predict clinical outcome in diabetic foot infection? Analysis of data from the SIDESTEP* trial. Int Wound J. 2006;3:302-7.
- Gardner SE, Frantz RA. Wound bioburden and infection-related complications in diabetic foot ulcers. Biol Res Nurs. 2008;10:44-53.
- Gardner SE, Hillis SL, Frantz RA. Clinical signs of infection in diabetic foot ulcers with high microbial load. Biol Res Nurs. 2009;11:119-28.
- Lázaro-Martínez JL, Tardáguila-García A, García-Klepzig JL. Diagnostic and therapeutic update on diabetic foot osteomyelitis. Endocrinología, Diabetes y Nutrición. (English ed.) 2017;64:100-8.
- Ramanujam CL, Han D, Zgonis T. Medical imaging and laboratory analysis of diagnostic accuracy in 107 consecutive hospitalized patients ith diabetic foot osteomyelitis and partial foot amputations. Foot Ankle Spec. 2018;11:433-43.
- Senneville E. Editorial commentary: probe-to-bone test for detecting diabetic foot osteomyelitis: rapid, safe, and accurate-but for which patients? Clin Infect Dis. 2016;63:949-50.
- Alvaro-Afonso FJ, Lazaro-Martinez JL, Aragon-Sanchez J, Garcia-Morales E, Garcia-Alvarez Y, Molines-Barroso RJ. Inter-observer reproducibility of diagnosis of diabetic foot osteomyelitis based on a combination of probe-to-bone test and simple radiography. Diabetes Res Clin Pract. 2014;105:e3-5.
- Grayson ML, Gibbons GW, Balogh K, Levin E, Karchmer AW. Probing to bone in infected pedal ulcers. A clinical sign of underlying osteomyelitis in diabetic patients. 1995:721-3.
- Lam K, van Asten SA, Nguyen T, La Fontaine J, Lavery LA. Diagnostic accuracy of probe to bone to detect osteomyelitis in the diabetic foot: a systematic review. Clin Infect Dis. 2016;63:944-8.
- Dinh MT, Abad CL, Safdar N. Diagnostic accuracy of the physical examination and imaging tests for osteomyelitis underlying diabetic foot ulcers: meta-analysis. Clin Infect Dis. 2008;47:519-27.
- Baker JC, Demertzis JL, Rhodes NG, Wessell DE, Rubin DA. Diabetic musculoskeletal complications and their imaging mimics. Radiographics. 2012;32:1959-74.
- Chatha DS, Cunningham PM, Schweitzer ME. MR imaging of the diabetic foot: diagnostic challenges. Radiol Clin North Am. 2005;43:747-59, ix.
- Cildag MB, Ertugrul BM, Koseoglu OF, Cildag S, Armstrong DG. Angiographic assessment of atherosclerotic load at the lower extremity in patients with diabetic foot and charcot neuro-arthropathy. J Chin Med Assoc. 2018;81:565-70.
- Cildag MB, Ertugrul MB, Koseoglu OF, Armstrong DG. A Factor increasing venous contamination on bolus chase three-dimensional magnetic resonance imaging: Charcot neuroarthropathy. J Clin Imaging Sci. 2018;8:13.
- Ertugrul BM, Lipsky BA, Savk O. Osteomyelitis or Charcot neuro-osteoarthropathy? Differentiating these disorders in diabetic patients with a foot problem. Diabet Foot Ankle. 2013;4.
- Martin Noguerol T, Luna Alcala A, Beltran LS, Gomez Cabrera M, Broncano Cabrero J, Vilanova JC. Advanced MR imaging techniques for differentiation of neuropathic arthropathy and osteomyelitis in the diabetic foot. Radiographics. 2017;37:1161-80.
- Lauri C, Tamminga M, Glaudemans AWJM, et al. Detection of osteomyelitis in the diabetic foot by imaging techniques: a systematic review and meta-analysis comparing MRI, white blood cell sphy, and FDG-PET. Diabetes Care. 2017;40:1111-20.
- Rastogi A, Bhattacharya A, Prakash M, et al. Utility of PET/CT with fluorine-18-fluorodeoxyglucose-labeled autologous leukocytes for diagnosing diabetic foot osteomyelitis in patients with Charcot’s neuroarthropathy. Nucl Med Commun. 2016;37:1253-9.
- Arnon-Sheleg E, Keidar Z. Diabetic foot infection: the role of PET/CT imaging. Curr Pharm Des. 2018;24:1277-86.
- Yousaf S, Dawe EJC, Saleh A, Gill IR, Wee A. The acute Charcot foot in diabetics: diagnosis and management. EFORT Open Rev. 2018;3:568-73.
- Gariani K, Lebowitz D, von Dach E, Kressmann B, Lipsky BA, Uckay I. Remission in diabetic foot infections: duration of antibiotic therapy and other possible associated factors. Diabetes Obes Metab. 2019;21:244-51.
- Dinh MT, Abad CL, Safdar N Diagnostic accuracy of the physical examination and imaging tests for osteomyelitis underlying diabetic foot ulcers: meta-analysis. Clin Infect Dis. 2008 Aug 15;47(4):519-527. doi: 10.1086/590011.
- Lee, YJ, Sadigh S, Mankad K, Kapse N, Rajeswaran G. The imaging of osteomyelitis. Quant Imaging Med Surg. 2016 Apr;6(2):184-98. doi: 10.21037/qims.2016.04.01.
- Beroukhim G, Shah R, Bucknor MD. Factors predicting positive culture in CT-guided bone biopsy performed for suspected osteomyelitis. AJR Am J Roentgenol. 2019;212:620-4.
- Wu JS, Gorbachova T, Morrison WB, Haims AH. Imaging-guided bone biopsy for osteomyelitis: are there factors associated with positive or negative cultures? AJR Am J Roentgenol. 2007;188:1529-34.
- Anagnostopoulos A, Bossard DA, Ledergerber B, et al. Perioperative antibiotic prophylaxis has no effect on time to positivity and proportion of positive samples: a cohort study of 64 Cutibacterium acnes bone and joint infections. J Clin Microbiol. 2018;56.
- Agarwal V, Wo S, Lagemann GM, Tsay J, Delfyett WT. Image-guided percutaneous disc sampling: impact of antecedent antibiotics on yield. Clin Radiol. 2016;71:228-34.
- Couturier A, Chabaud A, Desbiez F, et al. Comparison of microbiological results obtained from per-wound bone biopsies versus transcutaneous bone biopsies in diabetic foot osteomyelitis: a prospective cohort study. Eur J Clin Microbiol Infect Dis. 2019.
- Senneville E, Melliez H, Beltrand E, et al. Culture of percutaneous bone biopsy specimens for diagnosis of diabetic foot osteomyelitis: concordance with ulcer swab cultures. Clin Infect Dis. 2006;42:57-62.
- Senneville E, Morant H, Descamps D, et al. Needle puncture and transcutaneous bone biopsy cultures are inconsistent in patients with diabetes and suspected osteomyelitis of the foot. Clin Infect Dis. 2009;48:888-93.
- Aslangul E, M’Bemba J, Caillat-Vigneron N, et al. Diagnosing diabetic foot osteomyelitis in patients without signs of soft tissue infection by coupling hybrid 67Ga SPECT/CT with bedside percutaneous bone puncture. Diabetes Care. 2013;36:2203-10.
- Letertre-Gibert P, Desbiez F, Vidal M, et al. Blood cultures after bone biopsy in diabetic foot osteomyelitis. Diagn Microbiol Infect Dis. 2017;89:78-9.
- Meyr AJ, Singh S, Zhang X, et al. Statistical reliability of bone biopsy for the diagnosis of diabetic foot osteomyelitis. J Foot Ankle Surg. 2011;50:663-7.
- Elmarsafi T, Kumar A, Cooper PS, et al. Concordance between bone pathology and bone culture for the diagnosis of osteomyelitis in the presence of Charcot neuro-osteoarthropathy. J Foot Ankle Surg. 2018;57:919-23.
- Ertugrul MB, Baktiroglu S, Salman S, et al. Pathogens isolated from deep soft tissue and bone in patients with diabetic foot infections. J Am Podiatr Med Assoc. 2008;98:290-5.
- Zuluaga AF, Galvis W, Jaimes F, Vesga O. Lack of microbiological concordance between bone and non-bone specimens in chronic osteomyelitis: an observational study. BMC Infect Dis. 2002;2:2-8.
- Noor S, Raghav A, Parwez I, Ozair M, Ahmad J. Molecular and culture based assessment of bacterial pathogens in subjects with diabetic foot ulcer. Diabetes Metab Syndr. 2018;12:417-21.
- Percival SL, Malone M, Mayer D, Salisbury AM, Schultz G. Role of anaerobes in polymicrobial communities and biofilms complicating diabetic foot ulcers. Int Wound J. 2018;15:776-82.
- Malone M, Johani K, Jensen SO, et al. Next generation DNA sequencing of tissues from infected diabetic foot ulcers. EBioMedicine. 2017;21:142-9.
- Malone M, Gosbell IB, Dickson HG, Vickery K, Espedido BA, Jensen SO. Can molecular DNA-based techniques unravel the truth about diabetic foot infections? Diabetes Metab Res Rev. 2017;33.
- Charles PG, Uckay I, Kressmann B, Emonet S, Lipsky BA. The role of anaerobes in diabetic foot infections. Anaerobe. 2015;34:8-13.
- Dumville JC, Lipsky BA, Hoey C, Cruciani M, Fiscon M, Xia J. Topical antimicrobial agents for treating foot ulcers in people with diabetes. Cochrane Database Syst Rev. 2017;6:CD011038.
- Aragon-Sanchez J, Lipsky BA. Modern management of diabetic foot osteomyelitis. The when, how and why of conservative approaches. Expert Rev Anti Infect Ther. 2018;16:35-50.
- Berthol N, Robineau O, Boucher A, et al. Two-step sequential approach for concomitant skin and soft tissue infection and osteomyelitis complicating the diabetic foot. Diabetes Care. 2017;40:e170-e1.
- Spellberg B, Lipsky BA. Systemic antibiotic therapy for chronic osteomyelitis in adults. Clin Infect Dis. 2012;54:393- 407. (155)
- Abbas M, Uckay I, Lipsky BA. In diabetic foot infections antibiotics are to treat infection, not to heal wounds. Expert Opin Pharmacother. 2015;16:821-32.
- Gardner SE, Haleem A, Jao YL, et al. Cultures of diabetic foot ulcers without clinical signs of infection do not predict outcomes. Diabetes Care. 2014;37:2693-701.
- Kowalski TJ, Matsuda M, Sorenson MD, Gundrum JD, Agger WA. The effect of residual osteomyelitis at the resection margin in patients with surgically treated diabetic foot infection. J Foot Ankle Surg. 2011;50:171-5.
- Atway S, Nerone VS, Springer KD, Woodruff DM. Rate of residual osteomyelitis after partial foot amputation in diabetic patients: a standardized method for evaluating bone margins with intraoperative culture. J Foot Ankle Surg. 2012;51:749-52.
- Hachmoller A. Outcome of minor amputations at the diabetic foot in relation to bone histopathology: a clinical audit. Zentralbl Chir. 2007;132:491-6.
- Mijuskovic B, Kuehl R, Widmer AF, et al. Culture of bone biopsy specimens overestimates rate of residual osteomyelitis after toe or forefoot amputation. J Bone Joint Surg Am. 2018;100:1448-54.
- Schmidt BM, McHugh JB, Patel RM, Wrobel JS. Prospective analysis of surgical bone margins after partial foot amputation in diabetic patients admitted with moderate to severe foot infections. Foot Ankle Spec. 2018: 1938640018770285.
- Mathieu D. Role of hyperbaric oxygen therapy in the management of lower extremity wounds. Int J Low Extrem Wounds. 2006;5:233-5.
- Mader JT, Brown GL, Guckian JC, Wells CH, Reinarz JA. A mechanism for the amelioration by hyperbaric oxygen of experimental staphylococcal osteomyelitis in rabbits. J Infect Dis. 1980;142:915-22.
- Park MK, Myers RA, Marzella L. Oxygen tensions and infections: modulation of microbial growth, activity of antimicrobial agents, and immunologic responses. Clin Infect Dis. 1992;14:720-40.
- Memar MY, Ghotaslou R, Samiei M, Adibkia K. Antimicrobial use of reactive oxygen therapy: current insights. Infect Drug Resist. 2018;11:567-76.
- Cimsit M, Uzun G, Yildiz S. Hyperbaric oxygen therapy as an anti-infective agent. Expert Rev Anti Infect Ther. 2009;7:1015-26.
- Memar MY, Yekani M, Alizadeh N, Baghi HB. Hyperbaric oxygen therapy: antimicrobial mechanisms and clinical application for infections. Biomed Pharmacother. 2019;109:440-7.
- Savvidou OD, Kaspiris A, Bolia IK, et al. Effectiveness of hyperbaric oxygen therapy for the management of chronic osteomyelitis: a systematic review of the literature. Orthopedics. 2018;41:193-9.
- Faunø Thrane J, Ovesen T. Scarce evidence of efficacy of hyperbaric oxygen therapy in necrotizing soft tissue infection: a systematic review. Infect Dis. (Lond) 2019; 51:485.
- Cruciani M, Lipsky BA, Mengoli C, de Lalla F. Granulocyte-colony stimulating factors as adjunctive therapy for diabetic foot infections. Cochrane Database Syst Rev. 2013;CD006810. doi:CD006810.
- Dissemond J, Bottrich JG, Braunwarth H, Hilt J, Wilken P, Munter KC. Evidence for silver in wound care – meta- analysis of clinical studies from 2000-2015. J Dtsch Dermatol Ges. 2017;15:524-35.
- Tsang KK, Kwong EW, Woo KY, To TS, Chung JW, Wong TK. The anti-inflammatory and antibacterial action of nanocrystalline silver and manuka honey on the molecular alternation of diabetic foot ulcer: a comprehensive literature review. Evid Based Complement Alternat Med. 2015;2015:218283.
- Malone M, Johani K, Jensen SO, et al. Effect of cadexomer iodine on the microbial load and diversity of chronic non-healing diabetic foot ulcers complicated by biofilm in vivo. J Antimicrob Chemother. 2017;72:2093-101.
- Schwartz JA, Lantis 2nd JC, Gendics C, Fuller AM, Payne W, Ochs D. A prospective, non comparative, multicenter study to investigate the effect of cadexomer iodine on bioburden load and other wound characteristics in diabetic foot ulcers. Int Wound J. 2013;10:193-9.
- Edmonds M, Lázaro-Martínez JL, Alfayate-García JM, Martini J, Petit J-M, Rayman G, et al. Sucrose octasulfate dressing versus control dressing in patients with neuroischaemic diabetic foot ulcers (Explorer): an international, multicentre, double-blind, randomised, controlled trial. The Lancet Diabetes & Endocrinology. 2018;6(3):186-96. doi: 10.1016/s2213-8587(17)30438-2
- Lázaro-Martínez JL, Edmonds M, Rayman G, Apelqvist J, Van Acker K, Hartemann A, et al. Optimal wound closure of diabetic foot ulcers with early initiation of TLC-NOSF treatment: post-hoc analysis of Explorer. J Wound Care. 2019 Jun 2;28(6):358-367. doi: 10.12968/jowc.2019.28.6.358. PMID: 31166858.
- Kateel R, Adhikari P, Augustine AJ, Ullal S. Topical honey for the treatment of diabetic foot ulcer: A systematic review. Complement Ther Clin Pract. 2016;24:130-3.
- Kateel R, Bhat G, Baliga S, Augustine AJ, Ullal S, Adhikari P. Antibacterial action of tropical honey on various bacteria obtained from diabetic foot ulcer. Complement Ther Clin Pract. 2018;30:29-32.
- Jull AB, Cullum N, Dumville JC, Westby MJ, Deshpande S, Walker N. Honey as a topical treatment for wounds. Cochrane Database Syst Rev. 2015: CD005083.
- Morozova VV, Kozlova YN, Ganichev DA, Tikunova NV. Bacteriophage treatment of infected diabetic foot ulcers. Methods Mol Biol. 2018;1693:151-8.
- Fish R, Kutter E, Wheat G, Blasdel B, Kutateladze M, Kuhl S. Compassionate use of bacteriophage therapy for foot ulcer treatment as an effective step for moving toward clinical trials. Methods Mol Biol. 2018;1693:159-70.
- Liu Z, Dumville JC, Hinchliffe RJ, et al. Negative pressure wound therapy for treating foot wounds in people with diabetes mellitus. Cochrane Database Syst Rev. 2018;10:CD010318.
- Borys S, Hohendorff J, Frankfurter C, Kiec-Wilk B, Malecki MT. Negative pressure wound therapy use in diabetic foot syndrome-from mechanisms of action to clinical practice. Eur J Clin Invest. 2019:e13067.
- Kim PJ, Attinger CE, Crist BD, et al. Negative pressure wound therapy with instillation: review of evidence and recommendations. Wounds. 2015;27:S2-S19.
- Dale AP, Saeed K. Novel negative pressure wound therapy with instillation and the management of diabetic foot infections. Curr Opin Infect Dis. 2015;28:151-7.
- Morley S, Griffiths J, Philips G, et al. Phase IIa randomized, placebo-controlled study of antimicrobial photodynamic therapy in bacterially colonized, chronic leg ulcers and diabetic foot ulcers: a new approach to antimicrobial therapy. Br J Dermatol. 2013;168:617-24.
- Tardivo JP, Adami F, Correa JA, Pinhal MA, Baptista MS. A clinical trial testing the efficacy of PDT in preventing amputation in diabetic patients. Photodiagnosis Photodyn Ther. 2014;11:342-50.
- Tardivo JP, Serrano R, Zimmermann LM, et al. Is surgical debridement necessary in the diabetic foot treated with photodynamic therapy? Diabet Foot Ankle. 2017;8:1373552.
- Mannucci E, Genovese S, Monami M, et al. Photodynamic topical antimicrobial therapy for infected foot ulcers in patients with diabetes: a randomized, double-blind, placebo-controlled study–the D.A.N.T.E (Diabetic Ulcer Antimicrobial New Topical Treatment Evaluation) study. Acta Diabetol. 2014;51:435-40.
- Lipsky BA, Senneville E, Abbas ZG, Aragón-Sánchez J, Diggle M, Embil JM, et al. Guideline on the diagnosis and treatment of foot infection in persons with diabetes (IWGDF 2019 update). Diabetes-Metabolism Research and Reviews. Vol. 36, 2020. Int J Low Extrem Wounds.
Cite este artigo
Mattos L, Admoni S, Parisi M, Custódio J, Bertoluci M. Infecção no pé diabético. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-20, ISBN: 978-85-5722-906-8.

