Autores: Maria Cristina de Oliveira Izar, Francisco Antonio Helfenstein Fonseca, André Árpád Faludi, Daniel Branco de Araújo
Editor chefe: Marcello Bertoluci
Última revisão em: 06/01/2022
DOI: 10.29327/557753.2022-16 | Cite este Artigo
Introdução
A hipertensão arterial (HA) é uma doença crônica não transmissível multifatorial, caracterizada por elevação persistente da pressão arterial sistólica (PAS) maior ou igual a 140 mmHg e/ou da pressão arterial diastólica (PAD) maior ou igual a 90 mmHg e que depende de fatores genéticos, epigenéticos, ambientais e sociais, sendo classificada pelos níveis pressóricos. Ver tabela 1.
As aferições da pressão arterial (PA) devem ser obtidas com técnica adequada, em pelo menos duas ocasiões diferentes, na ausência de medicações anti-hipertensivas, quando para diagnóstico. A validação das medidas deve ser por meio de medidas da pressão arterial (PA) fora do consultório, com monitorização ambulatorial da pressão arterial (MAPA), monitorização residencial da pressão arterial (MRPA) ou por automedida da pressão arterial (AMPA).1
Em indivíduos adultos, acima de 18 anos, a PA é definida como ótima ou normal, e a HA é classificada como pré-hipertensão ou HA em estágios de I a III, conforme apresentado na Tabela 1.
Com relação ao risco cardiovascular, pessoas com diabetes (DM) são consideradas de alto risco, mesmo na fase de pré-hipertensão, independentemente da presença de fatores de risco, lesões de órgão-alvo, doença renal do diabetes (DRD) estágio 3 ou doença cardiovascular (DCV).
Tabela 1. Classificação da hipertensão arterial em indivíduos a partir de 18 anos de idade, de acordo com a medição da PA no consultório.
| Classificação | PAS (mmHg) | PAD (mmHg) |
| ÓTIMA | < 120 | < 80 |
| NORMAL | 120-129 | 80-84 |
| PRÉ-HIPERTENSÃO | 130-139 | 85-89 |
| ESTÁGIO I | 140-159 | 90-99 |
| ESTÁGIO II | 160-179 | 100-109 |
| ESTÁGIO III | ≥ 180 | ≥ 110 |
Tabela 2. Metas pressóricas e recomendação para início de tratamento da HA em pessoas com DM.
| População |
Meta de tratamento |
Quando iniciar tratamento farmacológico. |
Observação | ||
| PAS | PAD | PAS | PAD | ||
|
DM sem DAC |
<130 | <80 | ≥140 | ≥90 | Iniciar monoterapia |
| ≥160 | ≥100 | Iniciar terapia dupla | |||
|
DM com DAC |
<130 | <80 | ≥140 | ≥90 |
Evitar reduzir PA para abaixo de 120/70 |
|
DM com albuminúria |
<130 | <80 | ≥130 | ≥80 |
IECA/BRA preferidos (doses máximas toleradas) |
|
DM HAS estágio III |
<140 | <90 | Terapia dupla | Redução gradual da PA | |
|
DM em idoso >80 saúdavel |
130-139 | 70-79 | ≥140 | ≥90 | Usar medidas de consultório |
|
DM em idoso frágil |
140-149 | 70-79 | ≥160 | ≥90 | Atenção para NAC |
Siglas: PA: pressão arterial; PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; IECA: inibidor da enzima conversora da angiotensina; BRA: bloqueador do receptor da angiotensina II; NAC: neuropatia autonômica cardiovascular. As medidas estão expressas em mmHg. A classificação é definida de acordo com a PA no consultório e pelo nível mais elevado de PAS ou PAD. A HA sistólica isolada é caracterizada por PAS ≥ 140 mmHg e PAD ≥ 90 mmHg. A HA diastólica isolada é caracterizada por PAS < 140 mmHg e PAD ≥ 90 mmHg. As recomendações para as pessoas com hipertensão arterial e diabetes levam em consideração os estágios de hipertensão, a idade, a presença de lesões em órgãos-alvo (LOA) e a presença de doença arterial coronária e doença renal crônica.1–2
Figura 1. Fluxograma decisório para a escolha de fármacos no tratamento da HA em pacientes com DM.
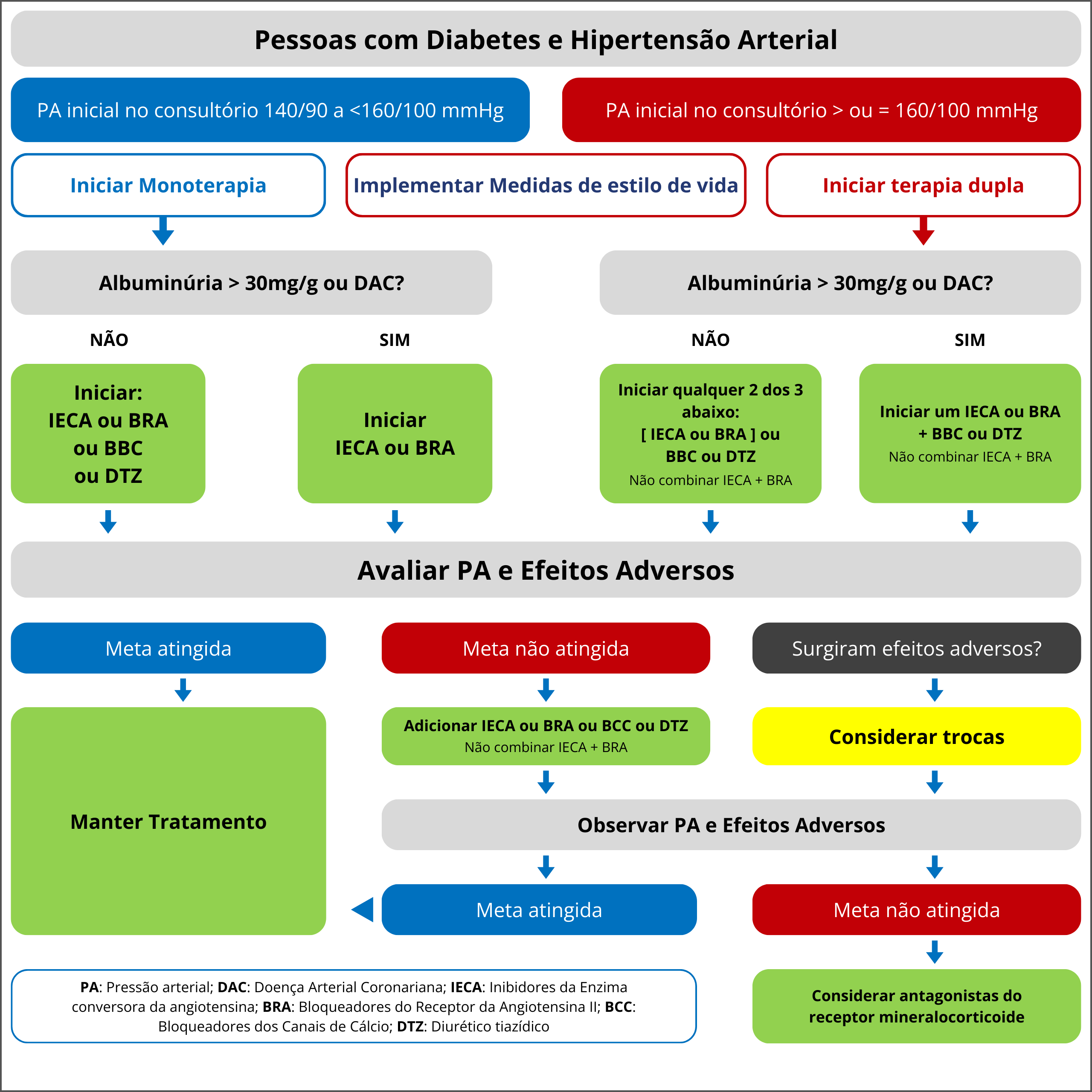
Recomendações
Metas de tratamento
R1. Em pessoas com diabetes SEM doença coronariana clínica, DEVE SER CONSIDERADO, como meta de tratamento, pressão arterial sistólica (PAS) < 130 mmHg, e pressão arterial diastólica (PAD) < 80 mmHg, se bem toleradas.
| Classe IIa | Nível B |
● O estudo ACCORD-BP3 randomizou 4.733 pessoas com DM2 e comparou a redução da pressão arterial sistólica para uma meta < 120 mmHg (tratamento intensivo) vs. < 140 mmHg (tratamento convencional). A média da PAS obtida no primeiro ano de tratamento foi de 119 mmHg e de 133 mmHg, respectivamente nos tratamentos intensivo e convencional. O desfecho primário (3P-MACE: morte cardiovascular, infarto fatal e infarto não-fatal) não foi reduzido significativamente após 4,7 anos de seguimento [HR 0,88 (IC 95% 0,73 a 1,06)]; p = 0,20). A taxa de mortalidade anual por qualquer causa também não foi diferente, respectivamente 1,28% e 1,19% [HR 1,07 (IC 95% 0,85 a 1,35)]; p = 0,55). No entanto, os eventos adversos graves foram mais frequentes no grupo intensivo (3,3%) do que no grupo convencional (1,3%), com p < 0,001. Assim, os resultados do estudo não apoiam metas mais baixas do que 120 mmHg de pressão sistólica nesta população.
● Uma análise secundária pré-especificada4 do estudo ACCORD-BP3 mostrou que, ao combinar o controle glicêmico intensivo com o controle intensivo da pressão arterial, a taxa de desfechos cardiovasculares maiores foi significativamente reduzida em comparação com o controle padrão da pressão arterial e da glicemia.
● Em uma metanálise que incluiu 42 ensaios clínicos randomizados, envolvendo 144.220 indivíduos, foram comparadas diferentes faixas de PAS para definir o melhor alvo terapêutico para reduzir DCV e mortalidade por todas as causas. Em 30 desses ensaios havia pessoas com diabetes. Os indivíduos foram analisados em subgrupos de acordo com a média esperada de PAS em nove estratos, a saber: 120-124 mmHg; 125-129 mmHg; 130-134 mmHg; 135-139 mmHg; 140-144 mmHg; 145-149 mmHg; 150-154 mmHg; 155-159 mmHg e > 160 mmHg. Houve associação linear entre a PAS média e o risco de DCV e mortalidade. O menor risco foi no estrato mais baixo (120 mmHg – 124 mmHg). Os indivíduos que obtiveram PAS 120-124 mmHg tiveram HR para mortalidade por todas as causas de 0,73 (IC 95% 0,58-0,93), em comparação com aqueles no estrato PAS 130-134 mmHg; [HR 0,59 (IC 95% 0,45 a 0,77)]. O estudo concluiu que a redução dos níveis de PAS para abaixo de 130 mmHg está associada a reduções significativas na DCV e na mortalidade por todas as causas.5
● O estudo observacional ARIC (Atherosclerosis Risk In Communities), com 11.565 adultos, analisou as associações entre PAD e níveis de troponina cardíaca altamente sensível, bem como associações prospectivas entre PAD e eventos cardiovasculares. Em comparação com os indivíduos que apresentaram PAD 80 mmHg a 89 mmHg no início do estudo, o odds-ratio ajustado para troponina ≥ 14 ng/L foi de 2,2 e de 1,5 em pessoas com PAD < 60 mmHg e com 60 mmHg a 69 mmHg, respectivamente. A PAD baixa no início do estudo também esteve associada de forma independente a dano miocárdico progressivo, com base na alteração anual estimada na troponina ao longo de seis anos. Além disto, PAD < 60 mmHg esteve associada à maior incidência de DAC e à mortalidade, embora não com acidente vascular encefálico. A associação entre PAD e incidência de DAC foi maior quando troponina basal ≥ 14 ng/L (valor de p para interação < 0,001). As associações de PAD baixa com prevalência de troponina e incidência de DAC foram mais pronunciadas entre os indivíduos com PAS basal ≥ 120 mmHg. O estudo concluiu que, entre adultos com PAS ≥ 120 mmHg (e, portanto, pressão de pulso elevada), PAD baixa esteve associada a dano no miocárdio e a eventos cardiovasculares.
Nota importante 1:
Ao considerar um tratamento para atingir pressão arterial sistólica abaixo de 130 mmHg, é prudente garantir que os níveis de pressão arterial diastólica não se situem abaixo de 70 mmHg e, em particular, não inferior a 60 mmHg.8
R2. Em pessoas com diabetes e doença coronariana clínica, DEVE SER CONSIDERADO manter a pressão arterial abaixo de 130/80 mmHg, porém evitando reduções para abaixo de 120/70 mmHg.
| Classe IIa | Nível B |
● Como a perfusão coronária ocorre principalmente durante a fase de diástole, os indivíduos com DAC podem ter maior risco de eventos se a PAD ficar abaixo de níveis críticos. Uma análise secundária de dados do estudo INVEST (International Verapamil-Trandolapril Study),6 incluindo 22.576 pessoas com hipertensão e DAC, avaliou se a pressão arterial baixa estaria associada ao excesso de mortalidade e morbidade nesta população. A análise mostrou aumento progressivo do risco do desfecho primário, mortalidade por todas as causas e infarto, mas não para o AVE com a PAD baixa. Conclui-se que a redução excessiva na PAD deve ser evitada em pessoas com DAC sob tratamento anti-hipertensivo.6
● Os dados de 22.672 pessoas com DAC estável de 45 países incluídos no registro CLARIFY (Cardiovascular event rates and mortality according to achieved systolic and diastolic blood pressure in patients with stable coronary artery disease: an international cohort study) e tratadas para hipertensão foram analisados para verificar se existiria relação entre os níveis de pressão arterial alcançados e os eventos cardiovasculares. A PAS e a PAD foram aferidas e categorizadas por incrementos de 10 mmHg. O desfecho primário foi composto de morte cardiovascular, IAM ou AVE. As razões de risco foram estimadas pelo modelo proporcional de Cox ajustado, utilizando-se dados de subgrupos de PAS de 120 mmHg a 129 mmHg e de PAD de 70 mmHg a 79 mmHg como referências. O estudo concluiu que, em pessoas com hipertensão e DAC estável, PAS < 120 mmHg e PAD < 70 mmHg estavam associadas a maiores taxas para os desfechos cardiovasculares, incluindo mortalidade, reforçando o conceito do fenômeno da curva J. Assim, é aconselhável cautela no tratamento com drogas anti-hipertensivas neste grupo de indivíduos.7
Metas e limiar de tratamento
Idosos
R3. Em pessoas idosas acima dos 80 anos, com diabetes, DEVE SER CONSIDERADA a condição global e a pressão arterial de consultório para definição das metas de pressão arterial. O limiar de tratamento farmacológico no idoso hígido é ≥ 140/90 mmHg, com meta de PA sistólica de 130 mmHg a 139 mmHg e de PA diastólica de 70 mmHg a 79 mmHg.
| Classe IIa | Nível B |
- O estudo SPRINT12 mostrou redução de 24% no risco para desfecho primário em pessoas idosas (idade ≥ 75 anos) alocadas no braço de tratamento de PA mais intenso (média de PAS obtida: 123,4 mmHg) em relação ao grupo de redução padrão de PAS (pressão arterial média alcançada: 134,8 mmHg). Isto ocorreu independentemente do grau de fragilidade e sem um aumento no número de eventos adversos, em relação ao restante da população estudada.12 O fato sugere que os objetivos da pressão arterial para os idosos devam ser definidos do mesmo modo que para outros adultos. No entanto, deve-se notar que a redução da pressão arterial deve ser realizada com cuidado, considerando comorbidades e uso de medicamentos múltiplos.
- Análise dos dados finais do estudo SPRINT12–13 com indivíduos acima de 75 anos de idade, incluindo dados de alguns eventos ainda não adjudicados e seguimento pós-estudo, foram recentemente publicados. Entre os 9.361 participantes que apresentavam risco aumentado de doença cardiovascular, mas que não possuíam diabetes ou história de AVE prévio, randomizados para tratamento de PA mais intenso (pressão arterial sistólica < 120 mmHg) ou grupo de redução padrão de PAS (pressão arterial sistólica < 140 mmHg), o desfecho primário composto (infarto do miocárdio ou outras síndromes coronárias agudas, AVE, insuficiência cardíaca aguda descompensada ou morte de causa cardiovascular) e desfechos primários adicionais ao final da intervenção foram avaliados após o fechamento do estudo para a análise primária. Também foram analisados os eventos e pós-estudo até julho de 2016.13 Após o seguimento de 3,33 anos, as taxas do desfecho primário e de morte cardiovascular foram menores no braço de tratamento de PA intensivo, em relação ao grupo de redução padrão (desfecho primário: 1,77% por ano vs. 2,40% por ano; HR 0,73; IC 95%, 0,63 a 0,86; mortalidade total: 1,06% por ano vs. 1,41% por ano; HR 0,75; IC 95%, 0,61 a 0,92). Os eventos adversos sérios (hipotensão, alterações eletrolíticas, falência ou injúria renal aguda e síncope) foram mais frequentes no braço de tratamento de PA mais intenso. Quando combinadas as análises durante e após o término do estudo (3,88 anos no total), o mesmo padrão de benefício e eventos adversos foi observado. No entanto, as taxas de insuficiência cardíaca não diferiram entre os grupos. 13
R4. Em idosos frágeis, DEVE SER CONSIDERADO os limiares de tratamento de PAS ≥ 160 mmHg e de PAD ≥ 90 mmHg, sendo a meta pressórica para a PAS de 140 mmHg a 149 mmHg e para a PAD, de 70 mmHg a 79 mmHg, visando redução de mortalidade, AVE e IC e efeitos adversos do tratamento.
| Classe IIa | Nível C |
● Para idosos acima de 80 anos hipertensos não há evidências claras de benefícios para se manter níveis de PAS abaixo de 140 mmHg. Mas há maior probabilidade de eventos adversos, especialmente nos idosos frágeis. Para evitar hipotensão postural, as metas pressóricas devem ser mantidas em níveis mais elevados em relação aos idosos robustos.
Nota importante 2: Neuropatia autonômica cardiovascular (NAC)
Pacientes com diabetes e diagnóstico de alto risco de neuropatia autonômica cardiovascular deverão ter suas metas individualizadas, para evitar hipotensão postural.
R5. Em pessoas com diabetes e hipertensão estágio III (pressão arterial igual ou superior a 180/110 mmHg), É RECOMENDADO a meta inicial de PA < 140/90 mmHg.
| Classe I | Nível A |
● Em uma metanálise, Thomopoulos et al.14 investigaram se o tratamento para reduzir a pressão arterial beneficiaria todos os graus de hipertensão e se determinaria os níveis-alvo de pressão arterial para maximizar os resultados dos desfechos. Reduções significativas dos desfechos foram encontradas independentemente do grau de hipertensão. Nenhuma tendência foi observada em relação às mudanças na relação de risco com o aumento da pressão arterial basal.
● Em 32 estudos clínicos randomizados, com 128.232 indivíduos, as reduções relativas e absolutas do risco para os desfechos foram significativas para as diferenças de PAS, com pontos de corte de 150 mmHg e 140 mmHg. Abaixo de 130 mmHg, apenas o AVE e a mortalidade por todas as causas foram significativamente reduzidas. Houve tendência significativa para maior redução absoluta de risco nos desfechos para menores pontos de corte da PAS.
● Em 29 estudos clínicos randomizados, envolvendo 107.665 indivíduos, os desfechos foram significativamente reduzidos em pontos de corte de PAD de 90 mmHg e 80 mmHg. Depois de excluir os estudos com PAD basal < 90 mmHg, apenas a redução do risco de AVE foi significativa para PAD: < 80 mmHg.
● Em conclusão, as metanálises destacam o tratamento com redução da PA em todos os graus de hipertensão, do risco baixo ao moderado, com a redução da PAS/PAD para menos de 140/90 mmHg. Alcançar PA < 130/80 mmHg parece seguro, mas apenas adiciona redução adicional para o AVE.14
R6. Em pessoas com diabetes e albuminúria (Alb/cre >30 mg/g), É RECOMENDADO que as metas de pressão arterial sistólica e de pressão arterial diastólica sejam estabelecidas abaixo de 130 mmHg e 80 mmHg, respectivamente, para atenuar a progressão da doença renal do diabetes.
| Classe I | Nível B |
● No ensaio clínico randomizado ADVANCE,15 11.140 pessoas com diabetes tipo 2 e hipertensão foram randomizadas para receber combinação fixa de perindopril e indapamida ou placebo, além da terapia atual. Os desfechos primários foram compostos de eventos macrovasculares e microvasculares (morte por DCV, AVE não fatal ou infarto do miocárdio não fatal), de novos casos de doença renal ou piora da doença e de retinopatia diabética. A análise foi por intenção de tratar. Os desfechos macrovasculares e microvasculares foram analisados em conjunto e separadamente. Os indivíduos alocados para a terapia ativa apresentaram redução média de PAS de 5,6 mmHg e redução média de PAD de 2,2 mmHg, em comparação com o grupo placebo. O RR para o desfecho macrovascular ou microvascular foi reduzido em 9% (861 ou 15,5% no grupo ativo vs. 938 ou 16,8% no grupo placebo; [HR 0,91 (IC 95% 0,83 a 1,00)]; p = 0,04). As reduções separadas para os eventos macrovasculares e microvasculares foram semelhantes, mas não independentemente significantes (macrovascular: 0,92, 0,81-1,04; p = 0,16; microvascular: 0,91, 0,80-1,04; p = 0,16).
● No estudo randomizado IRMA-2,16 590 indivíduos hipertensos, com diabetes tipo 2 e albuminúria (> 30 mg/g), foram incluídos para receber 150 mg e 300 mg de irbesartan por dia, durante dois anos. O desfecho primário foi o tempo de duplicação da creatinina, desenvolvimento de doença renal terminal ou morte por qualquer causa. Dez (5,2%) dos 194 indivíduos no grupo de 300 mg e 19 (9,7%) dos 195 indivíduos no grupo de 150 mg atingiram o desfecho primário, em comparação com 30 (14,9%) dos 201 indivíduos no grupo placebo [HR 0,30 (IC 95% 0,14 a 0,61)]; p < 0,001 e [HR 0,61 (IC 95% 0,34 a 1,08)]; p = 0,081 para os dois grupos irbesartan, respectivamente). A pressão arterial média durante o curso do estudo foi de 144/83 mmHg no grupo placebo, de 143/83 mmHg no grupo de 150 mg e de 141/83 mmHg no grupo de 300 mg (p = 0,004), para a comparação da PAS entre o grupo placebo e os grupos combinados de irbesartan).16
Escolha dos fármacos
R7. Em pessoas com diabetes, sem albuminúria e sem doença cardiovascular estabelecida, a escolha da terapia farmacológica para hipertensão DEVE SER CONSIDERADA com base na eficácia, na tolerabilidade, na presença de comorbidades e no custo, estando incluídos preferentemente os diuréticos, os inibidores da enzima conversora da angiotensina (IECAs), os bloqueadores dos receptores da angiotensina (BRAs) e os bloqueadores dos canais de cálcio (BCCs).
| Classe IIa | Nível A |
● O ensaio clínico randomizado ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial),17 estudo duplo-cego, controlado por medicamentos anti-hipertensivos e hipolipemiantes para prevenção das doenças cardiovasculares, avaliou 33.357 participantes (idade ≥ 55 anos) com hipertensão e pelo menos um fator de risco adicional para DCV, em 623 centros norte-americanos, para determinar se os bloqueadores dos canais de cálcio ou os IECAs diminuiriam a incidência de DAC ou outros eventos cardiovasculares vs. tratamento com um diurético. O desfecho primário combinado incluiu DAC fatal ou IAM não fatal, analisado por intenção de tratar. Os desfechos secundários foram para mortalidade por todas as causas, AVE, DAC combinada (desfecho primário, revascularização coronária ou angina com hospitalização) e DCV combinada (DAC combinada com AVE, angina tratada sem hospitalização, insuficiência cardíaca e doença arterial periférica). O desfecho primário ocorreu com 2.956 participantes, sem diferença entre os grupos de tratamento. Em comparação com a clortalidona (taxa em seis anos de 11,5%), os [RRs foram 0,98 (IC 95% 0,90 a 1,07)] para anlodipina (taxa em seis anos de 11,3%) e 0,99 (IC 95% 0,91 a 1,08) para lisinopril (taxa em seis anos de 11,4%). Do mesmo modo, a mortalidade por todas as causas não diferiu entre os grupos. Para anlodipina vs. clortalidona, os desfechos secundários foram semelhantes, exceto por uma taxa maior de insuficiência cardíaca em seis anos com anlodipina (10,2% vs. 7,7%; [RR 1,38 (IC 95% 1,25 a 1,52)]. Para lisinopril vs. clortalidona, o lisinopril apresentou maiores taxas de DCV combinadas em seis anos (33,3% vs. 30,9%; [RR 1,10 (IC 95% 1,05 a 1,16)]; AVE (6,3% vs. 5,6%; [RR 1,15 (IC 95% 1,02 a 1,30)] e insuficiência cardíaca congestiva (8,7% vs. 7,7%; [RR 1,19 (IC 95% 1,07 a 1,31)].17
● Uma reanálise do estudo ALLHAT18 para determinar se o tratamento com um bloqueador dos canais de cálcio ou com um IECA diminuiria as complicações clínicas, em comparação com o tratamento com um diurético tiazídico para DM, na TFG e na normoglicemia, não forneceu evidência de superioridade para o tratamento com bloqueadores dos canais de cálcio ou IECA, em comparação com o diurético do tipo tiazídico, durante o tratamento anti-hipertensivo inicial nas populações estudadas.18
● Uma metanálise19 analisou 354 ensaios clínicos randomizados, duplo-cego, controlados com placebo, utilizando diuréticos tiazídicos, betabloqueadores, IECA, antagonistas dos receptores da angiotensina II e bloqueadores dos canais de cálcio em dose fixa. As reduções, quando comparadas com as observadas nos grupos placebos, na PAS e na PAD, e a prevalência de efeitos adversos, de acordo com a dose expressa como múltiplo das doses padrão (recomendadas) dos medicamentos, foram os principais achados. Todas as cinco classes produziram reduções similares na pressão arterial, com redução média de PAS e PAD de 9,1 mmHg e de 5,5 mmHg, respectivamente, com doses padrão, e de 7,1 mmHg e de 4,4 mmHg, respectivamente (20% menor), com metade da dose padrão. As drogas reduziram a pressão arterial em todos os níveis, sobretudo em níveis pressóricos mais elevados. Para níveis pressóricos elevados acima de 10 mmHg, a redução foi de 1,0 mmHg para PAS e 1,1 mmHg para PAD. Os efeitos de redução de PA em diferentes classes de drogas foram aditivos. O tratamento combinado com baixas doses aumentou a eficácia e reduziu os efeitos adversos. A partir da média de pressão arterial em pessoas com AVE (150/90 mmHg), três medicamentos em dose média foram utilizados para reduzir a pressão arterial em 20 mmHg na PAS e 11 mmHg na PAD, reduzindo o risco de AVE em 63% e o risco de eventos isquêmicos coronários em 46%, na faixa etária entre 60 e 69.19
R8. Em pessoas com diabetes e albuminúria acima de 30 mg/g ou doença cardiovascular estabelecida, É RECOMENDADO o uso de um inibidor da enzima conversora da angiotensina ou de um bloqueador do receptor da angiotensina, para redução de desfechos renais e cardiovasculares.
| Classe I | Nível A |
● O ensaio clínico randomizado duplo-cego com a losartana (RENAAL)20 investigou se a albuminúria poderia ser marcadora de eficácia nefroprotetora por meio de intervenção no sistema renina-angiotensina em pessoas com doença renal do diabetes. Foi utilizado o desfecho primário composto renal: duplicação da creatinina sérica, doença renal terminal ou morte em 1.513 indivíduos com DM2 e nefropatia. O efeito do nível basal de albuminúria e a resposta antiproteinúrica à terapia sobre o desfecho renal (ou desfecho primário composto) foram examinados. A redução da albuminúria foi associada a um efeito proporcional na proteção renal. Quanto maior a redução, maior a proteção renal. O efeito antiproteinúrico da losartana explicou um componente importante de seu efeito nefroprotetor específico. A redução da albuminúria residual para nível o mais baixo possível deve ser vista como um objetivo para tratamentos nefroprotetores.
● O ensaio IDNT (The Irbesartan Diabetic Nephropathy Trial)21 abordou se associações entre a proteinúria basal e redução com irbesartana, anlodipina ou controle, com reduções similares na pressão arterial, reduziriam a incidência cumulativa de desfechos renais. O risco de insuficiência renal dobrou para cada duplicação do nível de proteinúria basal [HR 2,04 (IC 95% 1,87 a 2,22)]; p < 0,001. Para cada redução de metade do nível de proteinúria entre o período basal e 12 meses de tratamento, o risco de insuficiência renal foi reduzido em mais de metade [HR 0,44 (IC 95% 0,40 a 0,49)]; p < 0,001. A redução do risco de insuficiência renal foi significativamente maior para irbesartana vs. anlodipina (p = 0,048), mas não para o grupo controle (p = 0,245), para alterações proporcionais na proteinúria. A redução da proteinúria nos primeiros 12 meses de terapia com irbesartana esteve associada a 36% do efeito renoprotetor total observado. A redução da proteinúria utilizando um agente BRA deve ser considerada um importante objetivo terapêutico na renoproteção.21
● O estudo MICRO-HOPE22 investigou se o IECA ramipril poderia reduzir o risco de doenças cardiovasculares e renais em pessoas com diabetes. Um subgrupo de 3.577 pessoas com diabetes incluídos no HOPE (Heart Outcomes Prevention Evaluation) com idade igual ou superior a 55 anos, com evento cardiovascular prévio ou pelo menos outro fator de risco cardiovascular, sem proteinúria clínica, insuficiência cardíaca ou fração de ejeção baixa e que não estavam tomando IECA, foi aleatoriamente designado para receber ramipril (10 mg/dia) ou placebo e vitamina E ou placebo, em desenho fatorial 2×2. O desfecho primário combinado foi infarto do miocárdio, AVE ou morte cardiovascular. A nefropatia clinicamente manifesta foi o principal resultado. O estudo foi interrompido seis meses antes do previsto (após 4,5 anos) por causa de um benefício consistente do ramipril em comparação com o placebo. O ramipril reduziu o risco para o desfecho primário combinado em 25% (IC 95% 12-36; p = 0,0004), infarto do miocárdio em 22% (IC 95% 6-36), AVE em 33% (IC 95% 10-50), morte cardiovascular em 37% (IC 95% 21-51), mortalidade total em 24% (IC 95% 8-37), revascularização em 17% (IC 95% 2-30) e presença de nefropatia em 24% (IC 95% 3-40; p = 0,027). Após ajustes para mudanças na PAS (2,4 mmHg) e PAD (1,0 mmHg), o ramipril ainda reduziu o risco do desfecho primário combinado em 25% (IC 95% 12-36; p = 0,0004). Ramipril foi benéfico para eventos cardiovasculares e para a nefropatia manifesta em pessoas com diabetes. O estudo concluiu que o benefício cardiovascular foi maior que o atribuível à diminuição da pressão arterial, representando um efeito vasculoprotetor e renoprotetor para pessoas com diabetes.
R9. Quando necessário, a terapia farmacológica dupla com a combinação de um IECA ou um BRA e um bloqueador dos canais de cálcio diidropiridínico (BCC), DEVE SER CONSIDERADA para atingir meta de pressão arterial.
| Classe IIa | Nível B |
● O estudo ACCOMPLISH (Avoiding Cardiovascular Events Through COMbination Therapy in Patients Living With Systolic Hypertension)23 foi projetado para determinar qual terapia de combinação em pessoas com hipertensão e diabetes diminuiria os eventos cardiovasculares de forma mais eficaz. Os dados dos resultados nos desfechos para o IECA benazepril, combinados com anlodipina (B + A) ou hidroclorotiazida (B + H), foram analisados separadamente para o subgrupo de pessoas com diabetes como desfecho pré-especificado. Um total de 6.946 indivíduos com diabetes foram randomizados para tratamento com B + A ou B + H. Um subgrupo de 2.842 pessoas com diabetes com risco muito alto (eventos cardiovasculares anteriores ou AVE) também foi analisado, assim como 4.559 pessoas sem diabetes. O desfecho primário foi um composto de morte cardiovascular, infarto do miocárdio, AVE, hospitalização por angina, ressuscitação após parada cardíaca e revascularização coronária. No subgrupo de pessoas com diabetes, a média de pressão arterial nos grupos B + A e B + H foi de 131,5/72,6 mmHg e de 132,7/73,7 mmHg, respectivamente. Ao longo de 30 meses de acompanhamento, houve 307 (8,8%) e 383 (11,0%) eventos primários [HR 0,79 (IC 95% 0,68 a 0,92)]; p = 0,003. Para os indivíduos com diabetes em risco muito alto, houve 195 (13,6%) e 244 (17,3%) eventos primários [HR 0,77 (IC 95% 0,64 a 0,93)]; p = 0,007. Nos indivíduos sem diabetes, houve 245 (10,8%) e 296 (12,9%) eventos primários [HR 0,82 (IC 95% 0,69 a 0,97)]; p = 0,020. Nos participantes com diabetes, a terapia B + A apresentou benefícios coronarianos claros para os eventos clínicos agudos (p = 0,013) e revascularizações (p = 0,024). Em pessoas com diabetes e hipertensão, o bloqueador dos canais de cálcio anlodipina foi superior à hidroclorotiazida, quando adicionado a um bloqueador do sistema renina-angiotensina para redução de eventos cardiovasculares.
R10. Combinações de três ou mais fármacos (IECA ou BRA com BCC associados a um diurético tiazídico) DEVEM SER CONSIDERADAS para atingir as metas de pressão arterial, quando a terapia dupla não for suficiente.
| Classe IIa | Nível B |
● A metanálise de Psaty24 resumiu a evidência dos ensaios clínicos disponíveis referentes à segurança e à eficácia de várias terapias anti-hipertensivas utilizadas como agentes de primeira linha para os desfechos das DCVs e mortalidade por todas as causas. A metanálise foi utilizada para combinar comparações diretas dentro do ensaio entre medicamentos e evidências indiretas de outros ensaios. As comparações indiretas que preservaram os achados randomizados dentro do ensaio foram construídas a partir de ensaios que tinham um tratamento em comum. Os dados foram combinados de 42 estudos clínicos, que incluíram 192.478 indivíduos randomizados para sete estratégias principais de tratamento, incluindo placebo. Para todos os desfechos, os diuréticos com baixa dose foram superiores ao placebo para DAC [RR 0,79 (IC 95% 0,69 a 0,92)], insuficiência cardíaca congestiva [RR 0,51 (IC 95% 0,42 a 0,62)], AVE [RR 0,71 (IC 95% 0,63 a 0,81)], eventos cardiovasculares [RR: 0,76 (IC 95% 0,69 a 0,83)], mortalidade cardiovascular [RR 0,81 (IC 95% 0,73 a 0,92)] e mortalidade geral [RR 0,90 (IC 95% 0,84 a 0,96)]. Nenhuma das estratégias de tratamento de primeira linha − betabloqueadores, IECA, bloqueadores dos canais de cálcio, bloqueadores alfa e BRA − foi significativamente melhor do que diuréticos em baixa dose para qualquer resultado. Em comparação com os BCCs, os diuréticos em baixa dose estiveram associados a riscos reduzidos de eventos cardiovasculares [RR 0,94 (IC 95% 0,89 a 1,00)] e insuficiência cardíaca congestiva [RR 0,74 (IC 95% 0,67 a 0,81)]. Em comparação com os IECAs, os diuréticos em baixa dose estiveram associados a riscos reduzidos de insuficiência cardíaca congestiva [RR 0,88 (IC 95% 0,80 a 0,96)], eventos cardiovasculares [RR 0,94 (IC 95% 0,89 a 1,00)] e AVE [RR 0,86 (IC 95% 0,77 a 0,97)]. Em comparação com os betabloqueadores, os diuréticos em baixa dose estiveram associados a um risco reduzido de eventos cardiovasculares [RR 0,89 (IC 95% 0,80 a 0,98)]. Em comparação com os alfabloqueadores, os diuréticos em baixa dose estiveram associados a riscos reduzidos de insuficiência cardíaca congestiva [RR 0,51 (IC95% 0,43 a 0,60)] e de eventos cardiovasculares [RR 0,84 (IC 95% 0,75 a 0,93)]. As alterações da pressão arterial foram semelhantes entre os tratamentos. Os diuréticos em baixa dose foram o tratamento de primeira linha mais efetivos para prevenir a ocorrência de morbidade e mortalidade cardiovascular.
Nota importante 3: Antagonistas do receptor mineralocorticoide
O uso de fármacos antagonistas do receptor mineralocorticoide é indicado nos casos de controle inadequado da PA com três classes de anti-hipertensivos. (Hipertensão arterial resistente e hipertensão arterial secundária devem ser afastadas.)
R11. O uso combinado de IECA e BRA ou bloqueador de renina NÃO É RECOMENDADO, em razão de maior risco de perda de função renal, síncope e hipercalemia.
| Classe III | Nível A |
- O estudo ALTITUDE25 avaliou se o uso de alisquireno reduziria os eventos cardiovasculares e renais em pessoas com diabetes tipo 2 e DRC, doenças cardiovasculares ou ambos. O estudo foi interrompido prematuramente após a segunda análise interina de eficácia, pois, após acompanhamento médio de 32,9 meses, o desfecho primário (composto do tempo para morte cardiovascular ou primeira ocorrência de parada cardíaca com ressuscitação, infarto do miocárdio não fatal, AVE não fatal, hospitalização não planejada por insuficiência cardíaca, doença renal em fase terminal, morte atribuível à insuficiência renal ou necessidade de terapia dialítica renal iniciada, transplante renal ou duplicação do nível de creatinina sérica a partir dos dados basais) ocorreu em 783 pessoas (18,3%) alocadas para receber o alisquireno, em comparação com 732 (17,1%) alocadas para placebo (HR 1,08 IC 95% 0,98-1,20; p = 0,12). Assim, os dados não suportam a adição de alisquireno à terapia padrão com bloqueio do sistema renina-angiotensina em pessoas com diabetes tipo 2 que estejam sob alto risco para eventos cardiovasculares e renais.25
- O estudo ASTRONAUT26 foi projetado para investigar se a adição de alisquireno à terapia padrão reduziria as taxas de morte cardiovascular ou readmissão entre indivíduos com insuficiência cardíaca congestiva (hospitalização por insuficiência cardíaca). Os indivíduos elegíveis tinham ≥ 18 anos, com fração de ejeção do ventrículo esquerdo de 40% ou menos, peptídeos natriuréticos Tipo B (BNP) elevados (≥ 400 pg/mL ou NT-proBNP ≥ 1.600 pg/mL) e sinais e sintomas de sobrecarga de volume. Todos os participantes receberam 150 mg de alisquireno (aumentado para 300 mg quando tolerado) ou placebo diariamente, além da terapia padrão. A droga do estudo foi continuada após a alta durante uma média de 11,3 meses. As principais medidas para os desfechos foram: morte cardiovascular ou re-hospitalização por insuficiência cardíaca congestiva aos 6 meses e aos 12 meses. No total, 1.639 indivíduos foram randomizados, com 1.615 indivíduos incluídos na coorte de análise de eficácia final (808 alisquireno e 807 placebo). Na randomização, as pessoas receberam diuréticos (95,9%), betabloqueadores (82,5%), IECA ou BRA (84,2%) e antagonistas dos receptores mineralocorticóides (57,0%). Para os desfechos atribuíveis, observou-se um total de 24,9% de eventos nos indivíduos que receberam alisquireno (77 mortes por DCV e 153 internações por insuficiência cardíaca congestiva) e 26,5% nos indivíduos que receberam placebo (85 mortes por DCV e 166 internações por insuficiência cardíaca congestiva) no desfecho primário aos seis meses [(HR 0,92 (IC 95% 0,76 a 1,12)]; p = 0,41. Aos 12 meses, as taxas de eventos foram de 35,0% para o grupo alisquireno (126 mortes por DCV e 212 internações por insuficiência cardíaca congestiva) e de 37,3% para o grupo placebo (137 mortes por DCV e 224 internações por insuficiência cardíaca congestiva, [HR 0,93 (IC 95%: 0,79 a 1,09)]; p = 0,36. As taxas de hipercalemia, hipotensão e insuficiência renal foram maiores no grupo alisquireno do que no grupo placebo. Entre os indivíduos hospitalizados por insuficiência cardíaca com fração de ejeção do ventrículo esquerdo reduzida, o início do alisquireno, além da terapia padrão, não reduziu a morte cardiovascular e nem a readmissão por insuficiência cardíaca congestiva aos 6 meses ou 12 meses após a alta.
- Em pessoas com doença vascular ou diabetes de alto risco e sem insuficiência cardíaca, os IECAs reduzem a mortalidade e a morbidade por causas cardiovasculares, mas o papel dos BRAs nesses indivíduos é desconhecido. O IECA ramipril, o BRA telmisartan e uma combinação das duas drogas em pessoas com doença vascular ou diabetes com alto risco foram comparados no estudo ONTARGET.27 Foram alocados 8.576 indivíduos para receber 10 mg de ramipril por dia, 8.542 para receber 80 mg de telmisartan por dia e 8.502 para receber ambos os medicamentos. O resultado para o desfecho primário (morte por causas cardiovasculares, infarto do miocárdio, AVE ou hospitalização por insuficiência cardíaca) ocorreu em 16,5% dos indivíduos no grupo ramipril, 16,7% no grupo telmisartan e 16,3% no grupo terapia combinada (diferenças não foram estatisticamente significantes). No entanto, mais eventos adversos foram observados em indivíduos randomizados para terapia combinada. Em conclusão, a combinação dos dois fármacos esteve associada a maiores taxas de eventos adversos, sem evidências de grandes benefícios.
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1. Em pessoas com diabetes SEM doença coronariana clínica, DEVE SER CONSIDERADO, como meta de tratamento, pressão arterial sistólica (PAS) < 130 mmHg, e pressão arterial diastólica (PAD) < 80 mmHg, se bem toleradas. | IIa | B |
| R2. Em pessoas com diabetes e doença coronariana clínica, DEVE SER CONSIDERADO manter a pressão arterial abaixo de 130/80 mmHg, porém evitando reduções para abaixo de 120/70 mmHg. | IIa | B |
| R3. Em pessoas idosas acima dos 80 anos, com diabetes, DEVE SER CONSIDERADO a condição global e a pressão arterial de consultório para definição das metas de pressão arterial. O limiar de tratamento farmacológico no idoso hígido é ≥ 140/90 mmHg, com meta de PA sistólica de 130 mmHg a 139 mmHg e de PA diastólica de 70 mmHg a 79 mmHg. | IIa | B |
| R4. Em idosos frágeis, DEVE SER CONSIDERADO os limiares de tratamento de PAS ≥ 160 mmHg e de PAD ≥ 90 mmHg, sendo a meta pressórica para a PAS de 140 mmHg a 149 mmHg e para a PAD, de 70 mmHg a 79 mmHg, visando redução de mortalidade, AVE e IC e efeitos adversos do tratamento. | IIa | C |
| R5. Em pessoas com diabetes e hipertensão estágio III (pressão arterial igual ou superior a 180/110 mmHg), É RECOMENDADO a meta inicial de PA < 140/90 mmHg. | I | A |
| R6. Em pessoas com diabetes e albuminúria (Alb/cre > 30 mg/g), É RECOMENDADO que as metas de pressão arterial sistólica e de pressão arterial diastólica sejam estabelecidas abaixo de 130 mmHg e 80 mmHg, respectivamente, para atenuar a progressão da doença renal do diabetes. | I | B |
| R7. Em pessoas com diabetes, sem albuminúria e sem doença cardiovascular estabelecida, a escolha da terapia farmacológica para hipertensão DEVE SER CONSIDERADA com base na eficácia, na tolerabilidade, na presença de comorbidades e no custo, estando incluídos preferentemente os diuréticos, os inibidores da enzima conversora da angiotensina (IECAs), os bloqueadores dos receptores da angiotensina (BRAs) e os bloqueadores dos canais de cálcio (BCCs). | IIa | A |
| R8. Em pessoas com diabetes e albuminúria acima de 30 mg/g ou doença cardiovascular estabelecida, É RECOMENDADO o uso de um inibidor da enzima conversora da angiotensina ou de um bloqueador do receptor da angiotensina, para redução de desfechos renais e cardiovasculares. | I | A |
| R9. Quando necessário, a terapia farmacológica dupla com a combinação de um IECA ou um BRA e um bloqueador dos canais de cálcio diidropiridínico (BCC), DEVE SER CONSIDERADA para atingir meta de pressão arterial. | IIa | B |
| R10. Combinações de três ou mais fármacos (IECA ou BRA com BCC associados a um diurético tiazídico) DEVEM SER CONSIDERADAS para atingir as metas de pressão arterial, quando a terapia dupla não for suficiente. | IIa | B |
| R11. O uso combinado de IECA e BRA ou bloqueador de renina NÃO É RECOMENDADO, em razão de maior risco de perda de função renal, síncope e hipercalemia. | III | A |
Referências
- Barroso WKS, Rodrigues CIS, Bortolotto LA, Mota-Gomes MA, Brandão AA, Feitosa ADM, et al. Brazilian Guidelines of Hypertension – 2020. Arq Bras Cardiol. 2021 Mar;116(3):516-658. doi: 10.36660/abc.20201238.
- Bertoluci MC, Moreira RO, Faludi A, Izar MC, Schaan BD, Valério CM, et al. Brazilian guidelines on prevention of cardiovascular disease in patients with diabetes: a position statement from the Brazilian Diabetes Society (SBD), the Brazilian Cardiology Society (SBC) and the Brazilian Endocrinology and Metabolism Society (SBEM). Diabetol Metab Syndr. 2017 Jul 14;9:53. doi: 10.1186/s13098-017-0251-z. eCollection 2017.
- Cushman WC, Evans GW, Byington RP, Goff DC Jr, Grimm RH Jr, Cutler JA, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362:1575–85.
- Margolis KL, O’Connor PJ, Morgan TM, Buse JB, Cohen RM, Cushman WC, et al. Outcomes of combined cardiovascular risk factor management strategies in type 2 diabetes: the ACCORD randomized trial. Diabetes Care. 2014;37:1721–8.
- Bundy JD, Li C, Stuchlik P, Bu X, Kelly TN, Mills KT, et al. Systolic blood pressure reduction and risk of cardiovascular disease and mortality: a systematic review and network meta-analysis. JAMA Cardiol. 2017. doi: 10.1001/jamacardio.2017.1421.
- Messerli FH, Mancia G, Conti CR, Hewkin AC, Kupfer S, Champion A, et al. Dogma disputed: can aggressively lowering blood pressure in hypertensive patients with coronary artery disease be dangerous? Ann Intern Med. 2006;144:884–93.
- Vidal-Petiot E, Ford I, Greenlaw N, Ferrari R, Fox KM, Tardif JC, et al. Cardiovascular event rates and mortality according to achieved systolic and diastolic blood pressure in patients with stable coronary artery disease: an international cohort study. Lancet. 2016;388:2142–52.
- McEvoy JW, Chen Y, Rawlings A, Hoogeveen RC, Ballantyne CM, Blumenthal RS, et al. Diastolic blood pressure, subclinical myocardial damage, and cardiac events: implications for blood pressure control. J Am Coll Cardiol. 2016;68:1713–22.
- Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008;358:1887–98.
- Warwick J, Falaschetti E, Rockwood K, Mitnitski A, Thijs L, Beckett N, et al. No evidence that frailty modifies the positive impact of antihypertensive treatment in very elderly people: an investigation of the impact of frailty upon treatment effect in the HYpertension in the Very Elderly Trial (HYVET) Study, a double-blind, placebo-controlled study of antihypertensives in people with hypertension aged 80 and over. BMC Med. 2015;13:78.
- Hulley SB, Furberg CD, Gurland B, McDonald R, Perry HM, Schnaper HW, et al. Systolic Hypertension in the Elderly Program (SHEP): antihypertensive efficacy of chlorthalidone. Am J Cardiol. 1985;56:913–20.
- Wright JT Jr, Williamson JD, Whelton PK, Snyder JK, Sink KM, Rocco MV, et al. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med. 2015;373:2103–16.
- SPRINT Research Group; Lewis CE, Fine LJ, Beddhu S, Cheung AK, Cushman WC, Cutler JA, et al. Final report of a trial of intensive versus standard blood-pressure control. N Engl J Med. 2021 May 20;384(20):1921–30.
- Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 2. Effects at different baseline and achieved blood pressure levels–overview and meta-analyses of randomized trials. J Hypertens. 2014;32:2296–304.
- Patel A, MacMahon S, Chalmers J, Neal B, Woodward M, Billot L, et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomized controlled trial. Lancet. 2007;370:829–40.
- Parving HH, Lehnert H, Brochner-Mortensen J, Gomis R, Andersen S, Arner P. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med. 2001;345:870–8.
- ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The antihypertensive and lipid-lowering treatment to prevent heart attack trial: major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic. JAMA. 2002;288:2981–97.
- Whelton PK, Barzilay J, Cushman WC, Davis BR, Iiamathi E, Kostis JB, et al. Clinical outcomes in antihypertensive treatment of type 2 diabetes, impaired fasting glucose concentration, and normoglycemia: antihypertensive and lipid-lowering treatment to prevent heart attack trial (ALLHAT). Arch Intern Med. 2005;165:1401–9.
- Law MR, Wald NJ, Morris JK, Jordan RE. Value of low dose combination treatment with blood pressure lowering drugs: analysis of 354 randomized trials. BMJ. 2003;326:1427.
- de Zeeuw D, Remuzzi G, Parving HH, Keane WF, Zhang Z, Shahinfar S, et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int. 2004;65:2309–20.
- Atkins RC, Briganti EM, Lewis JB, Hunsicker LG, Braden G, Champion de Crespigny PJ, et al. Proteinuria reduction and progression to renal failure in patients with type 2 diabetes mellitus and overt nephropathy. Am J Kidney Dis. 2005;45:281–7.
- Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet. 2000;355:253–9.
- Weber MA, Bakris GL, Jamerson K, Weir M, Kjeldsen SE, Devereux RB, et al. Cardiovascular events during differing hypertension therapies in patients with diabetes. J Am Coll Cardiol. 2010;56:77–85.
- Psaty BM, Lumley T, Furberg CD, Schellenbaum G, Pahor M, Alderman MH, Weiss NS. Health outcomes associated with various antihypertensive therapies used as first-line agents: a network meta-analysis. JAMA. 2003;289:2534–44.
- Parving HH, Brenner BM, McMurray JJ, de Zeeuw D, Haffner SM, Solomon SD, et al. Cardiorenal endpoints in a trial of aliskiren for type 2 diabetes. N Engl J Med. 2012;367:2204–13.
- Gheorghiade M, Bohm M, Greene SJ, Fonarow GC, Lewis EF, Zannad F, et al. Effect of aliskiren on post-discharge mortality and heart failure readmissions among patients hospitalized for heart failure: the ASTRONAUT randomized trial. JAMA. 2013;309:1125–35.
- Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, Schumacher H, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med. 2008;358:1547–59.
Cite este artigo
Izar M, Fonseca F, Faludi A, Araújo D, Bertoluci M. Manejo da hipertensão arterial no diabetes. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-16, ISBN: 978-85-5722-906-8.

