Autores: Ana Teresa Santomauro, Augusto Cezar Santomauro Jr, Aline Bodart Pessanha, Roberto Abrão Raduan, Emerson Cestari Marino, Rodrigo Nunes Lamounier
Editor Chefe: Marcello Bertoluci
Última revisão em: 27/03/2023
DOI: 10.29327/5238993.2023-6 | Cite este Artigo
Introdução
Definição
A cetoacidose diabética (CAD) é uma complicação aguda que ocorre tipicamente no diabetes tipo 1 (DM1), embora também possa ocorrer em pacientes com DM tipo 2 (DM2). É definida pela presença de hiperglicemia, acidose metabólica e cetose, cujo critério diagnóstico é definido no quadro 11.
| Quadro 1. Critérios diagnósticos da CAD |
|
Desde a década de 1950, com a evolução do arsenal terapêutico, como antibioticoterapia, ênfase no processo de hidratação, controle eletrolítico e uso de insulina regular, a taxa de mortalidade da CAD caiu para aproximadamente 10%2. Atualmente, em centros de excelência no tratamento de CAD, a mortalidade é inferior a 1%, podendo, contudo, ser maior do que 5% em indivíduos idosos ou com doenças graves1. Quando evolui para edema cerebral, a mortalidade chega a atingir 30% ou mais dos pacientes. A incidência é variável, entre 4 a 8 episódios por 1.000 pessoas com DM1,3.
Diagnóstico diferencial
O diagnóstico diferencial da CAD inclui crises hiperglicêmicas, outras causas de cetose, acidose, hiperosmolalidade e coma. Os principais diagnósticos diferenciais estão descritos no quadro 22,4.
| Quadro 2. Diagnóstico Diferencial da CAD |
|
Quadro clínico
O quadro clínico da CAD inicia com sinais e sintomas típicos (quadro 3) poliúria, polidipsia, perda de peso, náuseas, dor abdominal, vômitos e progride rapidamente, causando sonolência, torpor e, finalmente, coma. Ao exame físico, em consequência dos diferentes graus de acidose, pode ocorrer hiperpnéia (respiração de Kussmaul). Há desidratação com pele seca e fria, língua seca, hipotonia dos globos oculares, extremidades frias, agitação, fácie hiperemiada, hipotonia muscular, pulso rápido e pressão arterial variando desde normal até o choque hipovolêmico. Em algumas situações, são verificadas dilatação, atonia e estase gástrica com maior incidência de vômitos. O atraso no início do tratamento da acidose e da desidratação pode evoluir com choque hipovolêmico e morte4,5.
| Quadro 3. Sinais e Sintomas da CAD |
|
Fatores precipitantes
Os eventos precipitantes em pacientes com CAD estão descritos no quadro 4. Os mais comuns são as infecções, (geralmente pneumonia ou infecções do trato urinário) e descontinuação da terapia com insulina. Outras condições menos frequentes são: uso de álcool, trauma, embolia pulmonar, infarto agudo do miocárdio, medicamentos que alteram metabolismo de carboidratos como glicocorticóides, diuréticos tiazídicos em altas doses, agentes simpaticomiméticos (dobutamina e terbutalina) e agentes antipsicóticos “atípicos” como clozapina, olanzapina, risperidona e quetiapina, além de drogas ilícitas como a cocaína. Problemas psiquiátricos e comportamentais, como transtornos alimentares, omissão proposital de insulina, além do mau uso ou funcionamento dos dispositivos de infusão subcutânea contínua de insulina são causas importantes nos jovens1–3,6–8.
| Quadro 4. Fatores precipitantes da CAD |
|
Avaliação do paciente com suspeita de CAD
Classificação da gravidade
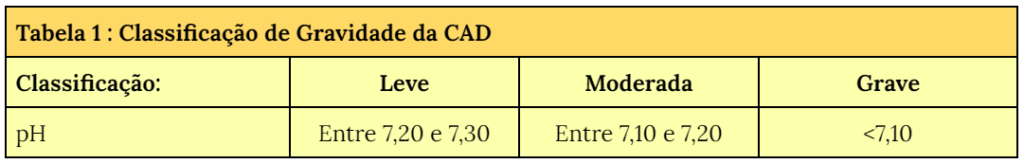
A gravidade da CAD pode ser classificada em leve, moderada ou grave, sendo baseada no pH venoso (Tabela 1)¹. Outras características clínicas e laboratoriais também indicam CAD grave, como descrito no quadro 5. As principais complicações9–11 e causas de morte da CAD1–3 estão no quadro 6.
Nota importante 1: Edema cerebral
- O edema cerebral clinicamente significativo geralmente se desenvolve nas primeiras 12 horas após o início do tratamento, mas pode ocorrer ou antes do início do tratamento ou, raramente, pode se desenvolver até 24 a 48 horas após o início do tratamento¹².
- Os sinais e sintomas de edema cerebral incluem:
- Início ou piora progressiva da cefaleia após o início do tratamento .
- Alteração do estado neurológico, incluindo irritabilidade, confusão, incapacidade de despertar, incontinência.
- Sinais neurológicos específicos como paralisias de nervos cranianos, papiledema).
- A tríade de Cushing (aumento da pressão arterial, bradicardia e depressão respiratória) é um sinal tardio, mas importante, de aumento da pressão intracraniana.
- Diminuição da saturação de oxigênio.
- Na suspeita de edema cerebral, sugere-se utilizar manitol 0,25 a 0,5g/kg para aumentar a pressão oncótica do plasma.
Cálculos de correção de sódio, osmolaridade plasmática e ânion gap
Nota importante 2: Correção do sódio sérico
- Devido à propriedade osmótica da glicose, a hiperglicemia leva ao deslocamento de água livre para o espaço extracelular, provocando hemodiluição e queda da natremia. Dessa forma, recomenda-se ajustar a natremia de acordo com a concentração de glicose.
- Utiliza-se o fator de correção de 1,6 meq/L na concentração sérica de sódio para cada aumento de 100 mg/dL na concentração plasmática de glicose¹³.
- Na+ corrigido = (Na aferido) + 1,6 x [(glicose em mg/dL – 100)/100]
- Quando a concentração de glicose é > 400mg/dL, um fator de correção de 2,4 meq/L na concentração de sódio por aumento de 100 mg/dL na glicemia deve ser utilizado14.
- Quanto maior o estado de hiperglicemia de um paciente, mais o fator de correção de 1,6 diverge da concentração estimada de sódio após a correção da hiperglicemia. Sendo assim, em alterações glicêmicas leves (<400 mg/dL), pode ser utilizado 1,6. Já em pacientes com alterações mais intensas, o 2,4 é mais fidedigno.
Nota importante 3: Cálculos necessários na CAD
- Antes de iniciar o tratamento determinar13–15:
- Osm plasmática = 2x(Na aferido) + [glicemia (mg/dL)/18] + [Ureia (mg/dl)/2,8]
- Osm plasmática efetiva = 2 x (Na aferido) + [glicemia (mg/dL)/18]
- Ânion gap (AG) = Na aferido – (Cl + HCO3) – normal: 4 a 12
Tratamento
O tratamento deve ser iniciado tão logo a CAD seja diagnosticada, e as metas terapêuticas sejam atingidas o quanto antes, visando a estabilização do paciente e a diminuição da sua morbimortalidade. A CAD é um quadro grave e potencialmente fatal, onde o atraso no início do tratamento pode levar a piores desfechos, com admissões realizadas com pacientes com pH mais baixo, maior depleção hidroeletrolítica e maior incidência de complicações relacionadas, como insuficiência respiratória e edema cerebral16.
As metas do tratamento da CAD estão descritas no Quadro 61,9:
Reposição de volume
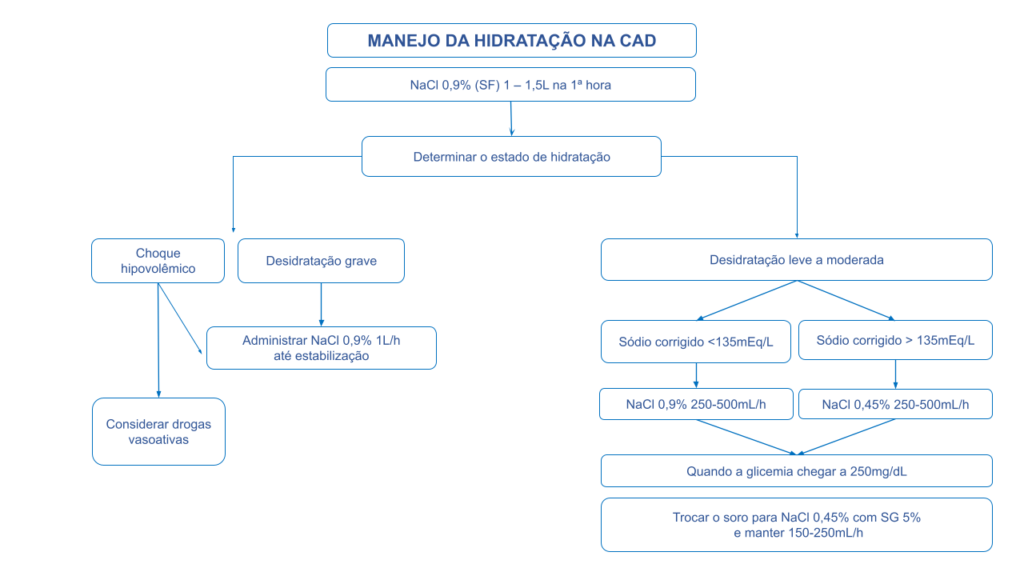
Os objetivos da reposição volêmica são: repor o déficit de água (que é estimado em aproximadamente 100 mL/Kg de peso), manter a pressão arterial, melhorar a perfusão tissular e renal, reduzir a glicemia9,17. Para correção da desidratação, na ausência de comprometimento das funções cardíaca e renal, deve-se proceder a infusão de solução salina isotônica de cloreto de sódio (NaCl) 0,9%, em média 15 a 20 mL/kg na primeira hora, buscando-se restabelecer a perfusão periférica. A escolha subsequente de fluidos dependerá da evolução dos eletrólitos séricos e da diurese9,17.
Reposição de eletrólitos
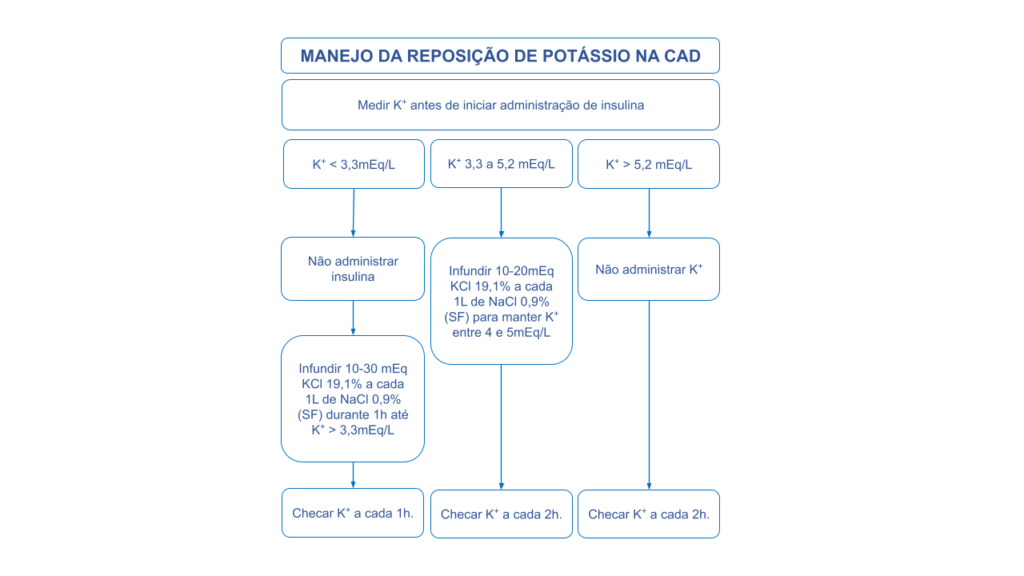
A avaliação dos níveis de potássio sempre deve ser feita antes da insulinização9. Com a função renal normal, ou seja, com presença de débito urinário, inicia-se a infusão de 10 a 30 mEq/L de cloreto de potássio (KCl) a 19,1% por hora, com a proposta de manter o potássio sérico entre 4 e 5 mEq/L.
A administração de bicarbonato de sódio intravenoso de rotina não demonstrou melhora clínica na resolução da acidose, na duração do plano de tratamento e na mortalidade em pacientes com CAD9; e, em geral, não é recomendado, especialmente em crianças. A recomendação do uso de bicarbonato de sódio reserva-se a casos graves de pacientes adultos com acidose e pH < 6,9. Caso seja indicado, a dose preconizada em adultos é de 50 a 100 mmol diluídos em solução isotônica de 200 a 400 mL para reduzir o potencial risco de hipocontratilidade cardíaca e arritmias9.
A hipofosfatemia leve é um achado comum e geralmente assintomático durante a terapia da CAD. Não se indica reposição de sais de fosfato de rotina, em parte devido ao risco de hipocalcemia, não havendo evidências suficientes que demonstrem a melhora do prognóstico quando em comparação com o não uso. Em raras situações de extrema depleção de fosfato, que podem evoluir com manifestações clínicas graves, como insuficiência cardíaca congestiva, insuficiência respiratória aguda, anemia hemolítica e outras condições clínicas associadas à hipóxia, a reposição adequada do eletrólito, com fosfato de pótássio ou glicerofosfato 20 a 30 mEq por litro de fluido IV, torna-se imperiosa e costuma evoluir com bom prognóstico18.
Insulinoterapia
O início do tratamento deve ser feito com baixa dose de insulina regular intravenosa em todos os pacientes com CAD moderado a grave que tenham potássio sérico ≥3,3 mEq/L. A única indicação para atrasar o início da terapia com insulina é se o potássio sérico estiver abaixo de 3,3 mEq/L, uma vez que a insulina piorará a hipocalemia ao direcionar o potássio para as células9.
O tratamento pode ser iniciado com uma infusão contínua de insulina regular de 0,1 unidades/kg por hora. Nessa dose, espera-se que diminua a concentração de glicose sérica em aproximadamente 50 a 70 mg/dL/hora. A variação da glicemia fora desse intervalo indica a necessidade de ajuste na taxa de infusão de insulina intravenosa9.
Com a evolução do tratamento, quando a glicemia na CAD atingir 200 a 250 mg/dL, deve-se iniciar soro glicosado 5% associado à insulina regular IV, a qual deve ter a taxa de infusão diminuída para evitar hipoglicemia durante o tratamento da CAD9.
Critérios de resolução
Consideramos como critérios de resolução, o controle do fator precipitante associado à melhora dos parâmetros metabólicos, como vistos no Quadro 81,9.
Assim que o paciente conseguir alimentar-se e estiver bem controlado, dos pontos de vista clínico e laboratorial, inicia-se insulinoterapia basal com insulina humana de ação intermediária ou com análogos de insulina de longa ação, em associação a múltiplas injeções de insulina regular ou a análogos de insulina de ação rápida antes das refeições19.
Uma vez iniciada a insulinoterapia, parte do beta-hidroxibutirato é convertida em acetoacetato, encontrando uma falsa impressão de cetose persistente por horas ou dias, não sendo a cetonúria, portanto, um bom método para medir a eficiência do tratamento20,21.
Recomendações
Critério diagnóstico
R1 É RECOMENDADO utilizar o critério diagnóstico de CAD que inclui glicemia > 200 mg/dL acidose metabólica (pH venoso < 7,3 e/ou bicarbonato sérico < 15 mEq/L) e cetonemia >3 mmol/L para reduzir falsos negativos e aumentar a acurácia diagnóstica.
| Classe I | Nível C |
- O estudo observacional de Munro mostrou que, em um período de 7 anos, em uma unidade de emergência onde ocorreram 211 episódios de cetoacidose, 16 (7,6%) se apresentaram com glicemias abaixo de 200mg/dL. Todos eram jovens com média de 18 anos de idade e com diagnóstico prévio de diabetes “dependente de insulina”²².
- A documentação de acidose com presença de cetonas é necessária para diagnóstico diferencial com outras causas de acidose metabólica e outras emergências hiperglicêmicas.
- Anteriormente à maior disponibilidade de tiras reagentes para cetonemia capilar, utilizava-se também o valor de Ânion-Gap acima de 12 para definir CAD, que pode ser um parâmetro em casos de indisponibilidade do teste.
- Há casos de CAD euglicêmica, o que pode ser observado especialmente em gestantes, pacientes com abuso de álcool, doença renal crônica em estágio terminal e usuários de inibidores de SGLT2, abordado em capítulo específico nesta diretriz²³.
Cetonemia
R2 É RECOMENDADO prioritariamente a determinação de cetonemia em relação à cetonúria pela maior acurácia tanto para diagnóstico como para acompanhar o tratamento da CAD.
| Classe I | Nível C |
- Uma revisão sistemática com 5 estudos e 2019 pacientes identificou maior acurácia com a pesquisa de beta-hidroxibutirato no sangue capilar do que com a dosagem de cetonúria para diagnóstico de CAD20.
- Resultados falsamente negativos de cetonúria podem ocorrer quando a urina fica exposta ao ar por longos períodos, ou quando estiver muito ácida, como ocorre após ingestão de grandes quantidades de vitamina C. Além disso, o captopril e a N-acetilcisteína, que interagem com o nitroprussiato usado na reação bioquímica necessária para medição de corpos cetônicos na urina, pode também interferir na cetonúria²¹.
Tiras reagentes de cetonas
R3 DEVE SER CONSIDERADO o uso do teste de tiras reagentes de cetonas em sangue capilar para acelerar as decisões em relação ao diagnóstico e tratamento da CAD.
| Classe IIa | Nível C |
- O teste para detecção de cetonas em sangue capilar tem uma sensibilidade de 98% e uma especificidade de 79%, em comparação com o teste de urinálise de cetona, que tem uma sensibilidade de 98% e especificidade de 35%20,21.
Valor de corte de cetonemia
R4 É RECOMENDADO utilizar o valor de corte de cetonemia igual ou superior a 3 mmol/L para diagnóstico de CAD e considerar os níveis entre 1,5 e 3 mmol/L como em risco aumentado para CAD, sendo necessária confirmação com gasometria venosa.
| Classe I | Nível C |
- Taboulet e cols. demonstraram em um estudo retrospectivo de 529 pacientes que a cetonemia capilar > 3mmol/L tem uma sensibilidade de 100% e especificidade de 94% para CAD. O estudo mostrou correlação entre a cetonúria e a cetonemia, de forma que uma cetonemia de 1+ equivale a 0,5 mmol/L (IQR: 0.1–0.9), 2+ a 0,7 mmol/L (IQR: 0.2–1.8) e 3+ a 3 mmol/L (IQR: 1.4–5.2)24.
- Arora e cols. demonstraram em um estudo retrospectivo de 516 pacientes que a associação de cetonemia capilar acima de 1,5mmol/L com uma glicemia acima de 250 mg/dL tem uma sensibilidade de 98,1% e uma especificidade de 78,6% para o diagnóstico de CAD, com um valor preditivo negativo de 99,7% quando abaixo de 1,5mmol/L²¹.
- Esse painel considera que embora o valor de corte de 3mmol/L seja mais preciso isoladamente para o diagnóstico, não é possível excluir em absoluto a possibilidade de CAD em pacientes com cetonemia capilar entre 1,5 e 3,0mmol/L, como foi demonstrado nos estudos acima, o que seria equivalente a 2+ no exame de cetonúria. Por este motivo, nesta faixa, é importante avaliar este resultado em conjunto com a gasometria, o ânion gap e os parâmetros clínicos.
- O corte de 3mmol/L apresenta melhor correlação com bicarbonato <18 mEq/L, e alta especificidade, sendo um forte indicador de CAD quando utilizado isoladamente, com valor preditivo negativo e positivo próximos a 100%21,24,25.
Nota importante 4: Anion GAP e gasometria
- Um valor de Ânion-Gap acima de 12 , é um parâmetro útil para definir CAD quando a cetonemia estiver entre 1,5 e 3 mmol/L.
Nota importante 5: Cetonúria não deve ser utilizada para monitorar resposta ao tratamento na CAD
- O exame de urina com cetona mede apenas acetona e acetoacetato e não o beta-hidroxibutirato, que é produzido em uma proporção de 20:1 na CAD, tornando-o o cetoácido primário mais importante.
- Uma vez iniciada a insulinoterapia, parte do beta-hidroxibutirato é convertida em acetoacetato, dando uma falsa impressão de cetose persistente por horas ou dias. A cetonúria, portanto, não é um bom método para avaliar a eficiência do tratamento20,21.
Reposição de volume
R5 É RECOMENDADO uma reposição de volume total de aproximadamente 100 mL/Kg de peso para o déficit de água estimado, para manter a pressão arterial, melhorar a perfusão tissular e renal e reduzir a glicemia.
| Classe I | Nível C |
- O efeito da reidratação em pessoas com cetoacidose nos hormônios contra-reguladores antes de receber insulina foi avaliado em um pequeno experimento em comparação com pessoas com hiperglicemia sem cetoacidose. A reidratação melhorou as alterações metabólicas associadas aos hormônios contrarreguladores e resistência à insulina periférica. Desta forma, uma reidratação adequada sustenta e otimiza a ação da insulina26.
Solução salina isotônica
R6 Na ausência de comprometimento das funções cardíaca e renal, É RECOMENDADO proceder à infusão de solução salina isotônica de cloreto de sódio (NaCl) 0,9%, em média 15 a 20 mL/kg na primeira hora, buscando-se restabelecer a perfusão periférica. A escolha subsequente de fluidos dependerá da evolução dos eletrólitos séricos e da diurese.
| Classe I | Nível B |
- Em um estudo prospectivo randomizado controlado, Caputo e colaboradores investigaram a taxa ótima de hidratação em 27 pacientes com CAD. Os indivíduos foram randomizados para receber 1.000 ml/h ou 500 ml/h de solução salina 0,9%. Ambos os grupos eram bioquimicamente semelhantes no início do tratamento e responderam de forma comparável ao tratamento sem diferença na taxa de resolução dos distúrbios eletrolíticos27.
Soluções balanceadas
R7 O uso de soluções balanceadas na reposição de fluidos intravenosos DEVE SER CONSIDERADO, por corrigir a hipovolemia e a hiperosmolaridade, e estar associado a taxas mais rápidas de resolução da CAD em comparação com a salina isotônica, com menor risco de acidose hiperclorêmica.
| Classe IIa | Nível A |
- Uma meta-análise de ensaios clínicos randomizados feita por Catahay e colaboradores, analisou estudos randomizados que compararam o uso de soluções isotônicas com soluções eletroliticamente balanceadas (ringer lactato) para avaliar o tempo de resolução da CAD. Foi encontrado um risco relativo de 1,46 (IC 95% [1,10-1,94], p=0,009) em favor das soluções balanceadas, com 12% de heterogeneidade. O uso de soluções balanceadas foi associado a taxas mais rápidas de resolução da CAD em comparação com soluções salinas isotônicas28.
- Na população pediátrica, Kuppermann e colaboradores avaliaram diferentes formas de reposição de fluidos em pacientes com menos de 18 anos que se apresentaram no pronto-socorro com CAD. Foram comparadas a administração de NaCl 0,9% 10mL/Kg em infusão rápida (metade do déficit de água nas primeiras 12 horas e o restante nas próximas 24 horas) ou em infusão lenta (toda a reposição feita em 48 horas) e também a administração de NaCl 0,45% com as mesmas taxas de infusão, rápida ou lenta. Em conclusão, neste estudo prospectivo e randomizado, nem a taxa de administração nem o teor de cloreto de sódio de fluidos intravenosos influenciaram significativamente os resultados neurológicos da cetoacidose diabética em crianças29.
Hipernatremia
R8. Se o paciente com CAD apresentar hipernatremia (Na corrigido ≥ 150 mEq/L), DEVE SER CONSIDERADO o uso de solução salina hipotônica de NaCl 0,45%, 250-500mL/h.
| Classe IIa | Nível C |
- Em um estudo de revisão clássico de Hillman, é descrito que mais da metade dos pacientes em CAD tem um sódio plasmático na admissão maior que 150 mEq/L, e quando associado a hiperglicemia, resulta em hiperosmolaridade grave. Dessa forma, nessas situações o uso de soluções isotônicas (NaCl 0,9%) ao invés de soluções hipotônicas (NaCl 0,45%) está associado a uma maior mortalidade30.
A figura 1 ilustra a conduta na reposição de fluidos na CAD.
Figura 1. Reposição de fluidos na CAD
Reposição de Eletrólitos
R9. É RECOMENDADO a determinação dos níveis de potássio (K) antes do início da insulina e instituir correção imediata, quando indicada.
| Classe I | Nível C |
Potássio
R10. Quando o nivel de potássio sérico estiver abaixo de 5,2 mEq/l e houver débito urinário adequado, É RECOMENDADO iniciar infusão de de cloreto de potássio (KCl) 10 a 30 mEq/L por hora, para manter o potássio sérico entre 4 e 5 mEq/L.
| Classe I | Nível C |
- A avaliação dos níveis de potássio sempre deve ser feita antes da insulinização9.
- Um estudo prospectivo de 29 casos de CAD mostrou que 82% dos pacientes eram normocalêmicos ou hipercalêmicos. No entanto, durante a terapia, 63% deles desenvolveram hipocalemia³¹.
- Ocasionalmente, pacientes com CAD podem se apresentar com um potássio sérico inicial abaixo de 3,3 mEq/L. Eles devem receber reposição de potássio e a terapia com insulina deve ser adiada até que o K esteja acima de 3,3 mEq/L, para evitar arritmias cardíacas, fraqueza dos músculos respiratórios ou mesmo parada cardíaca9,32,33.
Nota importante 6: Dosagem de potássio na gasometria
- A dosagem de potássio na gasometria venosa, apesar de ser mais rápida e fácil, não substitui a dosagem plasmática34.
A figura 2 descreve a conduta frente ao potássio na CAD.
Figura 2. Manejo da reposição de potássio na CAD
Insulinoterapia
R11. Na CAD moderada a grave, É RECOMENDADO iniciar insulinoterapia quando o potássio estiver acima de 3,3 mEq/L ,com uma infusão contínua de insulina regular na dose de 0,1 unidades/kg por hora.
| Classe I | Nível B |
- Em um clássico estudo clínico randomizado, 20 paciente pediátricos com CAD foram divididos para receber insulina em infusão IV contínua de baixa dose ou injeções subcutâneas (SC) intermitentes de alta dose. Não houve diferenças estatisticamente significativas na taxa de correção da cetoacidose, taxa de redução da glicose plasmática ou declínio na osmolaridade plasmática, mas a incidência e a gravidade da hipocalemia aumentaram nos pacientes que receberam insulina subcutânea. Conclui-se que a infusão IV contínua de baixa dose de insulina é pelo menos tão eficaz no tratamento da cetoacidose diabética quanto o uso de injeção C intermitente de alta dose35.
- Outro estudo clássico que comparou a infusão IV de baixa dose de insulina com a administração SC intermitente de altas doses foi o de Heber e colaboradores, onde 21 pacientes com CAD foram igualmente randomizados para receber essas duas terapias. Os níveis basais de glucagon, cortisol e hormônio do crescimento foram elevados em ambos os grupos. Os níveis de cortisol e hormônio do crescimento não caíram com a terapia em nenhum dos grupos, mas os níveis de glucagon caíram paralelamente aos níveis de glicose em ambos os grupos. Não houve diferença no tempo necessário para que os níveis de glicose caíssem abaixo de 250 mg/dL entre os grupos. Considerando que ambos os métodos de terapia pareciam ser igualmente eficazes, a infusão de baixa dose tinha as vantagens de facilidade de administração, uma taxa previsível e relativamente linear de queda dos níveis de glicose e capacidade de ser interrompida abruptamente em caso de hipoglicemia36.
- Um estudo prospectivo randomizou 45 pacientes com CAD para receber terapia com insulina de baixa dose por via intravenosa, via intramuscular ou subcutânea. Foi observado que em comparação com insulina intramuscular e subcutânea, insulina intravenosa produziu um declínio mais significativo na hiperglicemia e cetonemia nas primeiras 2 horas de tratamento, mas os três grupos apresentaram resposta semelhante após 8 h de tratamento37.
- O uso de insulina EV em baixa dose (0,1 U/kg/h em infusão contínua) se mostrou tão eficaz quanto o uso de altas doses de insulina IV para a resolução de CAD e por isso tem sido utilizado há mais de 4 décadas38.
R12. Em pacientes com CAD, DEVE SER CONSIDERADO o início da insulinoterapia em infusão contínua, sem bolus intravenoso inicial.
| Classe IIa | Nível B |
- Evidências recentes mostram que o uso de dose de bolus de insulina IV antes de se iniciar a infusão contínua de insulina não é necessária39–43.
- Kitabchi e colaboradores compararam o uso de uma dose de bolus de 0,07 unidades/kg por hora, seguida da infusão contínua de 0,07 unidades/kg por hora vs. iniciar diretamente a infusão contínua de 0,07 ou 0,14 unidades/kg por hora. Não houve diferença de tempo para alcançar a resolução de CAD entre essas diferentes abordagens43.
- Estudos retrospectivos que compararam a utilização ou não do bolus, também não mostraram diferença no desfecho da CAD40,41.
Nota importante 7: Escolha da insulina
- Insulina regular IV e análogos de insulina de ação rápida subcutânea são igualmente eficazes no tratamento de CAD moderada19.
- A escolha da insulina IV é baseada nas preferências institucionais, experiência clínica e preocupações com custos. Geralmente preferimos insulina regular, em vez de análogos de insulina de ação rápida, devido ao seu custo muito mais baixo.
- A insulina análoga de ação prolongada (glargina, detemir) ou a insulina humana de ação intermediária (NPH) são administradas após a recuperação da cetoacidose, antes da descontinuação da insulina IV, para garantir que a insulina adequada esteja disponível quando a insulina IV for descontinuada.
- Nesse cenário, não é recomendado a insulina degludeca, dada sua meia-vida de 25 horas e duração de 42 horas do efeito, pois levará pelo menos três a quatro dias para atingir o estado de equilíbrio dinâmico44.
- Em pacientes com CAD leve (particularmente devido a doses reduzidas ou omitidas de insulina basal), a insulina de ação intermediária ou longa pode ser administrada no início do tratamento, junto com a insulina de ação rápida19.
Nota importante 8: Variação da glicemia.
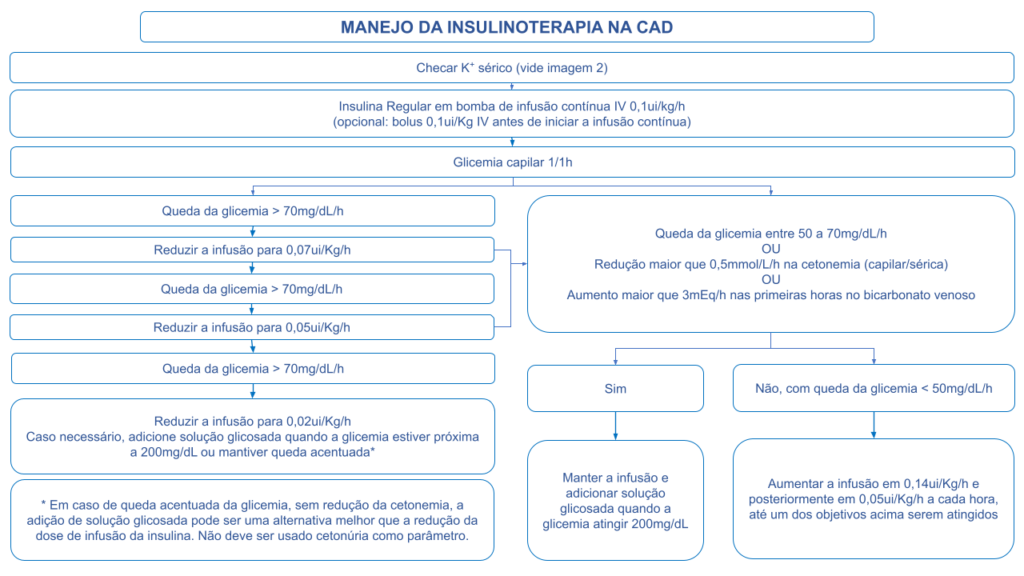
- As doses de insulina regular IV citadas no sumário acima geralmente diminuem a concentração de glicose sérica em aproximadamente 50 a 70 mg/dL/hora9. Doses mais altas geralmente não produzem um efeito de redução da glicose mais proeminente, provavelmente porque os receptores de insulina estão totalmente saturados e ativados pelas doses mais baixas9. No entanto, se a glicose sérica não cair em pelo menos 50 a 70 mg/dL do valor inicial na primeira hora, o acesso IV deve ser verificado para ter certeza de que a insulina está sendo fornecida. Vale a pena lembrar também sobre a adsorção da insulina no equipo, de forma que é recomendado desprezar 10% do volume inicial e substituir o conjunto a cada 6 horas39. Depois que essas possibilidades forem eliminadas, a taxa de infusão de insulina deve ser dobrada a cada hora até que um declínio constante na glicose sérica dessa magnitude seja alcançado.
- A queda da glicemia é resultado tanto da atividade da insulina quanto dos efeitos benéficos da reposição volêmica. A reposição de volume sozinha pode reduzir inicialmente a glicose sérica em 35 a 70 mg/dL/hora, devido à combinação da expansão do líquido extracelular; redução da osmolalidade plasmática; aumento das perdas urinárias resultantes da melhora da perfusão renal e filtração glomerular; e redução dos níveis de “hormônios do estresse”, que se opõem aos efeitos da insulina9.
- Em pacientes com perfusão periférica prejudicada, devemos utilizar sangue arterial ou venoso para aferição da glicemia, em vez do capilar.
Nota importante 9: Hipoglicemia durante a CAD.
- Com a evolução do tratamento, quando a glicemia na CAD atingir 200 a 250 mg/dL, deve-se iniciar soro glicosado 5% associado à insulina regular IV contínua ou SC a cada 4 horas, até a resolução da CAD e diminuir a taxa de infusão de insulina para 0,02 a 0,05 unidades/kg por hora.
- Para evitar que a glicemia fique abaixo de 200mg/dL, ajuste a infusão de insulina e utilize solução glicosada, titulando as 2 infusões, para que a glicemia mantenha-se neste nível e não ocorra hipoglicemia, evitando que a infusão de insulina seja desligada, atrasando potencialmente a resolução da cetoacidose9,19,45.
Nota importante 10: Início da infusão contínua de insulina IV.
- Além da meta de diminuição da glicemia, outros parâmetros podem ser usados para o acompanhamento clínico dos pacientes em tratamento de CAD, caso estejam disponíveis: redução de 0,5 mmol/L por hora dos níveis de cetonemia e aumento de 3 mEq/L por hora nos níveis de bicarbonato46,47.
Nota importante 11: Uso de algoritmos automatizados no manejo da CAD.
- Em alguns serviços, pode haver a disponibilidade de algoritmos automatizados em computador que auxiliam no manejo da CAD no que diz respeito ao ajuste da taxa de infusão da insulina IV, titulação de dose e na transição para insulinoterapia subcutânea.
- Em um estudo americano que comparou o algoritmo Glucommander com o método tradicional, geralmente feito em formulários e relatórios de papel, foi visto uma menor taxa de hipoglicemia, um tempo de normalização da glicemia e do bicarbonato mais rápido e um menor tempo de internação. Isso pode ter ramificações para sistemas hospitalares e organizações de saúde no benefício de economia de custos, no que diz respeito a titulação de insulina para tratamento de CAD. Entretanto, a validade desse achado terá que ser demonstrada por estudos prospectivos e a disponibilidade desses sistemas automatizados ainda não é uma realidade de todos os hospitais do nosso país48.
Nota importante 12: Titulação da infusão de insulina
- O Hospital deve possuir um procedimento padrão para ajuste de dose de insulina IV, para não haver diferença de conduta entre os turnos e pacientes. Esta padronização pode ser feita com aplicativos, como colocado anteriormente, ou com tabelas.
- Um exemplo que poderia ser adotado é basear-se nos diversos estudos que compararam doses de infusão de insulina na CAD, alternando entre eles, como sugerido na Figura 340,41,43,49,50.
A figura 3 mostra o algoritmo de utilização da terapia com insulina na CAD
Figura 3. Manejo da terapia com insulina na CAD
Análogos de ação rápida
R13. O uso de insulina análoga de ação rápida subcutânea PODE SER CONSIDERADO no tratamento da CAD leve.
| Classe IIb | Nível B |
- Em um estudo prospectivo, randomizado e aberto feito por Umpierrez e colaboradores, foi comparada a eficácia e a segurança da insulina asparte administrada por via SC a um protocolo padrão de infusão IV de baixa dose de insulina regular em pacientes com CAD leve e não complicadavem um total de 45 pacientes. Não houve diferenças estatísticas na duração média do tratamento e na quantidade total de administração de insulina até a correção da hiperglicemia ou até a resolução da cetoacidose. Não houve mortalidade, não houve diferenças no tempo de internação ou no número de eventos hipoglicêmicos entre os grupos de tratamento45.
- Na CAD leve, a comparação direta da terapia com insulina intramuscular, subcutânea e IV para pacientes com CAD hemodinamicamente estáveis mostra eficácia e segurança semelhantes9.
Nota importante 13: Protocolos de insulina SC
- Protocolos de insulina subcutânea estão sendo usados com frequência crescente para tratar pacientes com CAD leve a moderada durante a pandemia de COVID-19, quando a insulina intravenosa pode não ser prática devido à necessidade de limitar a frequência de contato da equipe com os pacientes. Nesse cenário, a dosagem e o monitoramento são realizados a cada duas a quatro horas.
- Pacientes com CAD leve podem ser tratados com segurança com análogos de insulina de ação rápida subcutânea na enfermaria ou pronto socorro, mas apenas quando uma equipe adequada está disponível para monitorar cuidadosamente o paciente e verificar, por exemplo a glicemia capilar, a cada hora, entre as outras monitorizações plasmáticas necessárias45.
- O tratamento da CAD com insulina subcutânea não foi avaliado em pacientes gravemente enfermos.
Bicarbonato
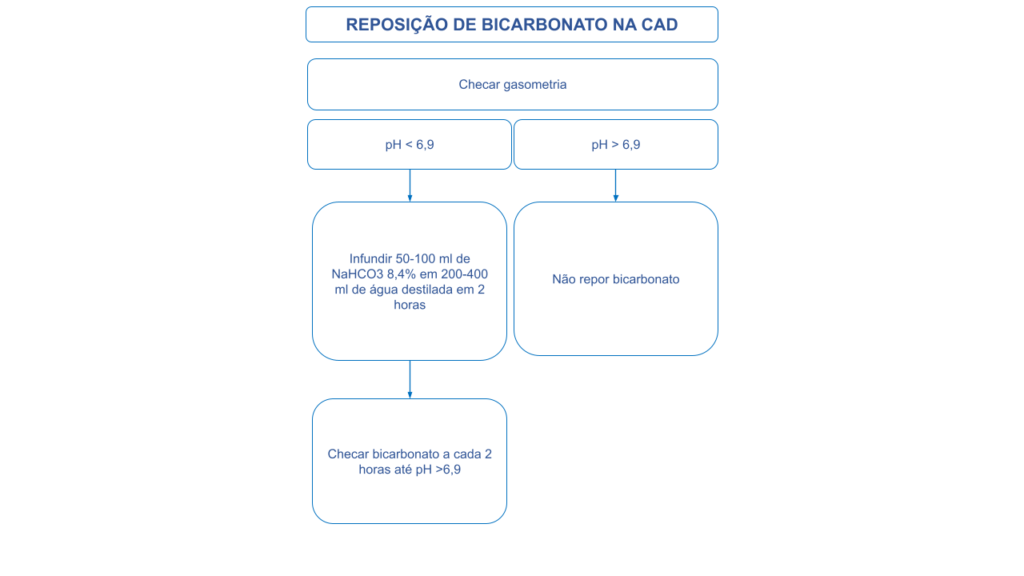
R14. O uso de bicarbonato de sódio PODE SER CONSIDERADO, quando o pH estiver abaixo de 6,9, para reduzir o potencial risco de hipocontratilidade cardíaca e arritmias.
| Classe IIb | Nível B |
- A administração de bicarbonato de sódio intravenoso de rotina não demonstrou melhora clínica na resolução da acidose, na duração do plano de tratamento e na mortalidade em pacientes com CAD9. Estudos prospectivos randomizados e controlados não demonstraram nenhum benefício da terapia com bicarbonato em pacientes com CAD com pH > 6,951–53.
- Em um estudo clínico, 39 pacientes com CAD severa (pH < 7,1) foram randomizados para receber bicarbonato ou não. Os valores de pH variaram entre 6,83 e 7,08. A dose de bicarbonato utilizada no grupo intervenção foi de 120 +/- 40 mmoL. Nenhuma diferença pode ser demonstrada entre os dois grupos em relação aos parâmetros clínicos ou o tempo de normalização dos distúrbios bioquímicos51.
- Em um estudo randomizado com 21 adultos, a administração de bicarbonato não conferiu vantagens na taxa de declínio da glicose ou cetonemia ou na taxa de aumento do pH ou nível sérico de bicarbonato no sangue ou líquido cefalorraquidiano. Também não houve diferenças significativas na taxa de resolução da CAD entre os dois grupos52.
- Em outro experimento clínico randomizado com 32 pacientes, a terapia com bicarbonato foi associada com atraso na queda de corpos cetônicos totais, lactato sanguíneo e relação lactato:piruvato53.
Nota importante 14: Dose de reposição de bicarbonato
- A recomendação do uso de bicarbonato de sódio é reservada para casos graves em pacientes adultos com acidose grave com pH < 6,9. Quando indicada, a dose preconizada em adultos é de 50 a 100 mmol diluídos em solução isotônica de 200 a 400 mL para reduzir o potencial risco de hipocontratilidade cardíaca e arritmias9.
- Atente-se para a chance de hipocalemia durante a administração do bicarbonato de sódio54.
- Os riscos do uso inapropriado é a alcalose metabólica, a acidose liquórica paradoxal, o edema cerebral, a anoxia tecidual, e o atraso na normalização do lactato e da cetonemia9,53,54.
A figura 4, mostra a conduta frente ao valor de bicarbonato na CAD.
Figura 4. Manejo da reposição de bicarbonato na CAD
Fosfato
R15. O uso de fosfato DEVE SER CONSIDERADO apenas na hipofosfatemia grave (concentração de fosfato sérico abaixo de 1 mg/dL) ou em pacientes com anemia, insuficiência cardíaca congestiva ou em condições clínicas associadas à hipóxia.
| Classe IIa | Nível B |
- Um estudo prospectivo que randomizou 30 pacientes com CAD para receber fosfato de potássio tamponado 12,5 mEq/h ou cloreto de potássio sozinho 12,5 mEq/h, mostrou que ambos os grupos tinham níveis comparáveis de 2,3-ácido difosfoglicérico ao final de 48 h. A terapia com fosfato, que não foi associada a nenhum efeito demonstrável sobre oxigenação tecidual ou resposta clínica, foi relacionada como causa de hipocalcemia em alguns pacientes55.
Nota importante 15: Dose de reposição de fosfato
- A terapia com fosfato não afeta a duração da CAD, a dose de insulina necessária para corrigir a acidose, os níveis anormais de enzimas musculares, a velocidade de redução da glicose ou a morbidade e mortalidade. Embora teoricamente atraente, a terapia com fosfato não é essencial da terapia para CAD na maioria dos pacientes56.
- A hipofosfatemia leve é um achado comum e geralmente assintomático durante a terapia da CAD. Não se indica reposição de sais de fosfato de rotina, devido ao risco de hipocalcemia, não havendo evidências suficientes que demonstrem melhora do prognóstico quando em comparação com o não uso.
- Em situações de extrema depleção de fosfato, que podem evoluir com manifestações clínicas graves, como insuficiência cardíaca congestiva, insuficiência respiratória aguda, anemia hemolítica e outras condições clínicas associadas à hipóxia, a reposição de fosfato de pótássio (ou glicerofosfato) 20 a 30 mEq por litro de fluido IV, é necessária18.
- O nível sérico de cálcio deve ser monitorado em pacientes recebendo infusão de fosfato9.
Critérios de Resolução
R16. É RECOMENDADO identificar os critérios de resolução da CAD e iniciar a transição da insulina intravenosa para subcutânea ao menos 2 horas antes da suspensão da infusão endovenosa.
| Classe I | Nível C |
- Este painel considera por opinião de experts como critérios de resolução o controle do fator precipitante, associado a melhora dos parâmetros metabólicos vistos no Quadro 81,9:
Nota importante 16: Transição de insulina Regular IV para SC
- Assim que o paciente conseguir alimentar-se e estiver bem controlado, dos pontos de vista clínico e laboratorial, inicia-se insulinoterapia basal com insulina humana de ação intermediária ou com análogos de insulina de longa ação, em associação a múltiplas injeções de insulina regular ou a análogos de insulina de ação rápida antes das refeições9,19. Os cuidados que devem ser seguidos antes de suspender insulina IV são prescrever esquema de insulina basal-bolus por via subcutânea (SC) e esperar cerca de 1 hora antes de desligar a bomba (ou aguardar 2 horas se utilizar insulina regular), que seria o tempo necessário para atingir um nível mínimo de insulina subcutânea após a administração57,58.
- A transição de insulina Regular IV para SC deve ser gradual para permitir o início da ação da insulina SC: manter IV 30 a 120 min após a primeira dose SC. Pode-se usar a dose prévia de insulina, caso paciente já utilizasse insulinoterapia antes do episódio de CAD. Nesse caso, recomenda-se dividir a dose em esquema basal-bolus de forma proporcional, ou seja 50% da dose para basal e 50% da dose para bolus.
- Se for a primo-descompensação, o cálculo da dose diária inicial de insulina pode ser feito de 2 formas: 0,4-0,8 U/kg de peso ou Taxa recente de infusão IV em U/h (média das últimas 4 a 6 horas de bom controle glicêmico) x 24. Em seguida, administrar 60-80% desta dose no modo basal/bolus proporcional; escolher de preferência as últimas horas quando estiver melhor da desidratação e da acidose.
Tabela de Recomendações
| Recomendações | Classe | Nível |
| R1 - É RECOMENDADO utilizar o critério diagnóstico de CAD que inclui glicemia > 200 mg/dL acidose metabólica (pH venoso < 7,3 e/ou bicarbonato sérico < 15 mEq/L) e cetonemia >3 mmol/L para reduzir falsos negativos e aumentar a acurácia diagnóstica. | I | C |
| R2 - É RECOMENDADO prioritariamente a determinação de cetonemia em relação à cetonúria pela maior acurácia tanto para diagnóstico como para acompanhar o tratamento da CAD. | I | C |
| R3 - DEVE SER CONSIDERADO o uso do teste de tiras reagentes de cetonas em sangue capilar para acelerar as decisões em relação ao diagnóstico e tratamento da CAD. | IIa | C |
| R4 - É RECOMENDADO utilizar o valor de corte de cetonemia igual ou superior a 3 mmol/L para diagnóstico de CAD e considerar os níveis entre 1,5 e 3 mmol/L como em risco aumentado para CAD, sendo necessária confirmação com gasometria venosa. | I | C |
| R5 - É RECOMENDADO uma reposição de volume total de aproximadamente 100 mL/Kg de peso para o déficit de água estimado, para manter a pressão arterial, melhorar a perfusão tissular e renal e reduzir a glicemia. | I | C |
| R6 - Na ausência de comprometimento das funções cardíaca e renal, É RECOMENDADO proceder à infusão de solução salina isotônica de cloreto de sódio (NaCl) 0,9%, em média 15 a 20 mL/kg na primeira hora, buscando-se restabelecer a perfusão periférica. A escolha subsequente de fluidos dependerá da evolução dos eletrólitos séricos e da diurese. | I | B |
| R7 - O uso de soluções balanceadas na reposição de fluidos intravenosos DEVE SER CONSIDERADO, por corrigir a hipovolemia e a hiperosmolaridade, e estar associado a taxas mais rápidas de resolução da CAD em comparação com a salina isotônica, com menor risco de acidose hiperclorêmica | IIa | A |
| R8 - Se o paciente com CAD apresentar hipernatremia (Na corrigido ≥ 150 mEq/L), DEVE SER CONSIDERADO o uso de solução salina hipotônica de NaCl 0,45%, 250-500mL/h. | IIa | C |
| R9 - É RECOMENDADO a determinação dos níveis de potássio (K) antes do início da insulina e instituir correção imediata, quando indicada. | I | C |
| R10 - Quando o nivel de potássio sérico estiver abaixo de 5,2 mEq/l e houver débito urinário adequado, É RECOMENDADO iniciar infusão de de cloreto de potássio (KCl) 10 a 30 mEq/L por hora, para manter o potássio sérico entre 4 e 5 mEq/L. | I | C |
| R11 - Na CAD moderada a grave, É RECOMENDADO iniciar insulinoterapia quando o potássio estiver acima de 3,3 mEq/L ,com uma infusão contínua de insulina regular na dose de 0,1 unidades/kg por hora. | I | B |
| R12 - Em pacientes com CAD, DEVE SER CONSIDERADO o início da insulinoterapia em infusão contínua, sem bolus intravenoso inicial. | IIa | B |
| R13 - PODE SER CONSIDERADO o uso de insulina análoga de ação rápida subcutânea no tratamento da CAD leve. | IIb | B |
| R14 - O uso de bicarbonato de sódio PODE SER CONSIDERADO, quando o pH estiver abaixo de 6,9, para reduzir o potencial risco de hipocontratilidade cardíaca e arritmias. | IIb | B |
| R15 - O uso de fosfato DEVE SER CONSIDERADO apenas na hipofosfatemia grave (concentração de fosfato sérico abaixo de 1 mg/dL) ou em pacientes com anemia, insuficiência cardíaca congestiva ou em condições clínicas associadas à hipóxia. | IIa | B |
| R16 - É RECOMENDADO identificar os critérios de resolução da CAD e iniciar a transição da insulina intravenosa para subcutânea ao menos 2 horas antes da suspensão da infusão endovenosa. | I | C |
Referências
- Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN. Hyperglycemic crises in adult patients with diabetes. Diabetes Care. julho de 2009;32(7):1335–43.
- Kitabchi AE, Umpierrez GE, Fisher JN, Murphy MB, Stentz FB. Thirty years of personal experience in hyperglycemic crises: diabetic ketoacidosis and hyperglycemic hyperosmolar state. J Clin Endocrinol Metab. maio de 2008;93(5):1541–52.
- Wang ZH, Kihl-Selstam E, Eriksson JW. Ketoacidosis occurs in both Type 1 and Type 2 diabetes–a population-based study from Northern Sweden. Diabet Med J Br Diabet Assoc. julho de 2008;25(7):867–70.
- Kitabchi AE, Umpierrez GE, Murphy MB, Kreisberg RA. Hyperglycemic crises in adult patients with diabetes: a consensus statement from the American Diabetes Association. Diabetes Care. dezembro de 2006;29(12):2739–48.
- Dhatariya KK, Umpierrez GE. Guidelines for management of diabetic ketoacidosis: time to revise? Lancet Diabetes Endocrinol. 2017;5(5):321–3.
- Kamalakannan D, Baskar V, Barton DM, Abdu T a. M. Diabetic ketoacidosis in pregnancy. Postgrad Med J. agosto de 2003;79(934):454–7.
- de Sá-Ferreira CO, da Costa CHM, Guimarães JCW, Sampaio NS, Silva L de ML, de Mascarenhas LP, et al. Diabetic ketoacidosis and COVID-19: what have we learned so far? Am J Physiol Endocrinol Metab. 1o de janeiro de 2022;322(1):E44–53.
- Akturk HK, Kahramangil D, Sarwal A, Hoffecker L, Murad MH, Michels AW. Immune checkpoint inhibitor-induced Type 1 diabetes: a systematic review and meta-analysis. Diabet Med J Br Diabet Assoc. setembro de 2019;36(9):1075–81.
- Nyenwe EA, Kitabchi AE. Evidence-based management of hyperglycemic emergencies in diabetes mellitus. Diabetes Res Clin Pract. dezembro de 2011;94(3):340–51.
- Edge JA, Jakes RW, Roy Y, Hawkins M, Winter D, Ford-Adams ME, et al. The UK case-control study of cerebral oedema complicating diabetic ketoacidosis in children. Diabetologia. setembro de 2006;49(9):2002–9.
- Greenberg RN, Scott LJ, Vaughn HH, Ribes JA. Zygomycosis (mucormycosis): emerging clinical importance and new treatments. Curr Opin Infect Dis. dezembro de 2004;17(6):517–25.
- Wolfsdorf JI, Glaser N, Agus M, Fritsch M, Hanas R, Rewers A, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Diabetic ketoacidosis and the hyperglycemic hyperosmolar state. Pediatr Diabetes. outubro de 2018;19 Suppl 27:155–77.
- Katz MA. Hyperglycemia-induced hyponatremia–calculation of expected serum sodium depression. N Engl J Med. 18 de outubro de 1973;289(16):843–4.
- Hillier TA, Abbott RD, Barrett EJ. Hyponatremia: Evaluating the Correction Factor for Hyperglycemia.
- Kellum JA. Clinical review: reunification of acid-base physiology. Crit Care Lond Engl. 5 de outubro de 2005;9(5):500–7.
- Varadarajan P, Suresh S. Delayed diagnosis of diabetic ketoacidosis in children—a cause for concern. Int J Diabetes Dev Ctries. 1o de junho de 2015;35(2):66–70.
- Perel P, Roberts I. Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochrane Database Syst Rev. 17 de outubro de 2007;(4):CD000567.
- Mégarbane B, Guerrier G, Blancher A, Meas T, Guillausseau PJ, Baud FJ. A possible hypophosphatemia-induced, life-threatening encephalopathy in diabetic ketoacidosis: a case report. Am J Med Sci. junho de 2007;333(6):384–6.
- Umpierrez GE, Jones S, Smiley D, Mulligan P, Keyler T, Temponi A, et al. Insulin analogs versus human insulin in the treatment of patients with diabetic ketoacidosis: a randomized controlled trial. Diabetes Care. julho de 2009;32(7):1164–9.
- Brooke J, Stiell M, Ojo O. Evaluation of the Accuracy of Capillary Hydroxybutyrate Measurement Compared with Other Measurements in the Diagnosis of Diabetic Ketoacidosis: A Systematic Review. Int J Environ Res Public Health. 23 de agosto de 2016;13(9):837.
- Arora S, Henderson SO, Long T, Menchine M. Diagnostic accuracy of point-of-care testing for diabetic ketoacidosis at emergency-department triage: {beta}-hydroxybutyrate versus the urine dipstick. Diabetes Care. abril de 2011;34(4):852–4.
- Munro JF, Campbell IW, McCuish AC, Duncan LJP. Euglycaemic Diabetic Ketoacidosis. Br Med J. 9 de junho de 1973;2(5866):578–80.
- Santomauro AT, Santomauro Junior AC, Raduan RA, Bertoluci M. Diagnóstico e Tratamento da Cetoacidose Diabética Euglicêmica. Em: Diretriz da Sociedade Brasileira de Diabetes – Ed 2022 [Internet]. Ed. 2022. [citado 12 de fevereiro de 2023]. Disponível em: https://diretriz.diabetes.org.br/diagnostico-e-tratamento-da-cetoacidose-diabetica-euglicemica-cad-e/
- Taboulet P, Deconinck N, Thurel A, Haas L, Manamani J, Porcher R, et al. Correlation between urine ketones (acetoacetate) and capillary blood ketones (3-beta-hydroxybutyrate) in hyperglycaemic patients. Diabetes Metab. abril de 2007;33(2):135–9.
- Nguyen KT, Xu NY, Zhang JY, Shang T, Basu A, Bergenstal RM, et al. Continuous Ketone Monitoring Consensus Report 2021. J Diabetes Sci Technol. maio de 2022;16(3):689–715.
- Waldhäusl W, Kleinberger G, Korn A, Dudczak R, Bratusch-Marrain P, Nowotny P. Severe hyperglycemia: effects of rehydration on endocrine derangements and blood glucose concentration. Diabetes. junho de 1979;28(6):577–84.
- Caputo DG, Villarejo F, Valle GB, Díaz Aguiar P, Apezteguia CJ. [Hydration in diabetic ketoacidosis. What is the effect of the infusion rate?]. Medicina (Mex). 1997;57(1):15–20.
- Catahay JA, Polintan ET, Casimiro M, Notarte KI, Velasco JV, Ver AT, et al. Balanced electrolyte solutions versus isotonic saline in adult patients with diabetic ketoacidosis: A systematic review and meta-analysis. Heart Lung J Crit Care. agosto de 2022;54:74–9.
- Kuppermann N, Ghetti S, Schunk JE, Stoner MJ, Rewers A, McManemy JK, et al. Clinical Trial of Fluid Infusion Rates for Pediatric Diabetic Ketoacidosis. N Engl J Med. 14 de junho de 2018;378(24):2275–87.
- Hillman K. Fluid resuscitation in diabetic emergencies–a reappraisal. Intensive Care Med. 1987;13(1):4–8.
- Martin HE, Smith K, Wilson ML. The fluid and electrolyte therapy of severe diabetic acidosis and ketosis; a study of twenty-nine episodes (twenty-six patients). Am J Med. março de 1958;24(3):376–89.
- Abramson E, Arky R. Diabetic acidosis with initial hypokalemia. Therapeutic implications. JAMA. 2 de maio de 1966;196(5):401–3.
- Robles FC, Laguna Neto D, Dias FG, Spressão M, Matos PN, Cordeiro JA, et al. Diabetic ketoacidosis: difference between potassium determined by blood gas analysis versus plasma measurement. Arq Bras Endocrinol Metabol. junho de 2011;55(4):256–9.
- Edwards GA, Kohaut EC, Wehring B, Hill LL. Effectiveness of low-dose continuous intravenous insulin infusion in diabetic ketoacidosis. A prospective comparative study. J Pediatr. novembro de 1977;91(5):701–5.
- Heber D, Molitch ME, Sperling MA. Low-dose continuous insulin therapy for diabetic ketoacidosis. Prospective comparison with “conventional” insulin therapy. Arch Intern Med. outubro de 1977;137(10):1377–80.
- Fisher JN, Shahshahani MN, Kitabchi AE. Diabetic ketoacidosis: low-dose insulin therapy by various routes. N Engl J Med. 4 de agosto de 1977;297(5):238–41.
- Gonzalez-Villalpando C, Blachley JD, Vaughan GM, Smith JD. Low- and high-dose intravenous insulin therapy for diabetic ketoacidosis. JAMA. 2 de março de 1979;241(9):925–7.
- Tran TTT, Pease A, Wood AJ, Zajac JD, Mårtensson J, Bellomo R, et al. Review of Evidence for Adult Diabetic Ketoacidosis Management Protocols. Front Endocrinol. 2017;8:106.
- Goyal N, Miller JB, Sankey SS, Mossallam U. Utility of initial bolus insulin in the treatment of diabetic ketoacidosis. J Emerg Med. maio de 2010;38(4):422–7.
- Brown HD, Tran RH, Patka JH. Effect of Bolus Insulin Administration Followed by a Continuous Insulin Infusion on Diabetic Ketoacidosis Management. Pharm Basel Switz. 7 de dezembro de 2018;6(4):E129.
- Karslioglu French E, Donihi AC, Korytkowski MT. Diabetic ketoacidosis and hyperosmolar hyperglycemic syndrome: review of acute decompensated diabetes in adult patients. BMJ. 29 de maio de 2019;365:l1114.
- Kitabchi AE, Murphy MB, Spencer J, Matteri R, Karas J. Is a priming dose of insulin necessary in a low-dose insulin protocol for the treatment of diabetic ketoacidosis? Diabetes Care. novembro de 2008;31(11):2081–5.
- Hirsch IB, Draznin B. Transition of Patients to and from Insulin Degludec: A Clinical Challenge. J Clin Endocrinol Metab. 1o de junho de 2020;105(6).
- Umpierrez GE, Cuervo R, Karabell A, Latif K, Freire AX, Kitabchi AE. Treatment of diabetic ketoacidosis with subcutaneous insulin aspart. Diabetes Care. agosto de 2004;27(8):1873–8.
- Loh TP, Saw S, Sethi SK. Bedside monitoring of blood ketone for management of diabetic ketoacidosis: proceed with care. Diabet Med J Br Diabet Assoc. junho de 2012;29(6):827–8.
- Misra S, Oliver NS. Utility of ketone measurement in the prevention, diagnosis and management of diabetic ketoacidosis. Diabet Med J Br Diabet Assoc. janeiro de 2015;32(1):14–23.
- Ullal J, Aloi JA, Reyes-Umpierrez D, Pasquel FJ, McFarland R, Rabinovich M, et al. Comparison of Computer-Guided Versus Standard Insulin Infusion Regimens in Patients With Diabetic Ketoacidosis. J Diabetes Sci Technol. janeiro de 2018;12(1):39–46.
- Nallasamy K, Jayashree M, Singhi S, Bansal A. Low-dose vs standard-dose insulin in pediatric diabetic ketoacidosis: a randomized clinical trial. JAMA Pediatr. novembro de 2014;168(11):999–1005.
- Gosmanov AR, Gosmanova EO, Dillard-Cannon E. Management of adult diabetic ketoacidosis. Diabetes Metab Syndr Obes Targets Ther. 2014;7:255–64.
- Viallon A, Zeni F, Lafond P, Venet C, Tardy B, Page Y, et al. Does bicarbonate therapy improve the management of severe diabetic ketoacidosis? Crit Care Med. dezembro de 1999;27(12):2690–3.
- Morris LR, Murphy MB, Kitabchi AE. Bicarbonate therapy in severe diabetic ketoacidosis. Ann Intern Med. dezembro de 1986;105(6):836–40.
- Hale PJ, Crase J, Nattrass M. Metabolic effects of bicarbonate in the treatment of diabetic ketoacidosis. Br Med J Clin Res Ed. 20 de outubro de 1984;289(6451):1035–8.
- Duhon B, Attridge RL, Franco-Martinez AC, Maxwell PR, Hughes DW. Intravenous sodium bicarbonate therapy in severely acidotic diabetic ketoacidosis. Ann Pharmacother. agosto de 2013;47(7–8):970–5.
- Fisher JN, Kitabchi AE. A randomized study of phosphate therapy in the treatment of diabetic ketoacidosis. J Clin Endocrinol Metab. julho de 1983;57(1):177–80.
- Wilson HK, Keuer SP, Lea AS, Boyd AE, Eknoyan G. Phosphate therapy in diabetic ketoacidosis. Arch Intern Med. março de 1982;142(3):517–20.
- Sharma AK, Taneja G, Kumar A, Sahu M, Sharma G, Kumar A, et al. Insulin analogs: Glimpse on contemporary facts and future prospective. Life Sci. 15 de fevereiro de 2019;219:90–9.
- Rodbard HW, Rodbard D. Biosynthetic Human Insulin and Insulin Analogs. Am J Ther. 2020;27(1):e42–51.
Cite este artigo
Ana Teresa Santomauro, Augusto Cezar Santomauro Jr, Aline Bodart Pessanha, Roberto Abrão Raduan, Emerson Cestari Marino, Rodrigo Nunes Lamounier. Diagnóstico e tratamento da Cetoacidose Diabética. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/5238993.2023-6, ISBN: 978-85-5722-906-8.