Autores: Melanie Rodacki, Milena Teles, Monica Gabbay, Rodrigo Lamounier
Editor de Seção: Renan Montenegro
Editor Chefe: Marcello Bertoluci
Última revisão em: 14/12/2023
DOI: 10.29327/557753.2022-1 | Cite este Artigo
Introdução
A classificação do diabetes mellitus (DM) permite o tratamento adequado e a definição de estratégias de rastreamento de comorbidades e complicações crônicas.1–2 A Sociedade Brasileira de Diabetes (SBD) recomenda a classificação baseada na etiopatogenia do diabetes, que compreende o diabetes tipo 1 (DM1), o diabetes tipo 2 (DM2), o diabetes gestacional (DMG) e os outros tipos de diabetes (Quadro 1)2. Outras classificações têm sido propostas, incluindo classificação em subtipos de DM levando em conta características clínicas como o momento do início do diabetes, a história familiar, a função residual das células beta, os índices de resistência à insulina, o risco de complicações crônicas, o grau de obesidade, a presença de autoanticorpos e eventuais características sindrômicas.3,4
O DM2 é o tipo mais comum. Está frequentemente associado à obesidade e ao envelhecimento. Tem início insidioso e é caracterizado por resistência à insulina e deficiência parcial de secreção de insulina pelas células ß,pancreáticas, além de alterações na secreção de incretinas. Apresenta frequentemente características clínicas associadas à resistência à insulina, como acantose nigricans e hipertrigliceridemia.
O DM1 é causado por destruição das células ß, geralmente autoimune, o que leva a uma deficiência grave da secreção de insulina. O DM 1 pode ser diagnosticado em qualquer idade. Embora seja o tipo mais comum de DM em crianças e adolescentes, dados recentes indicam que atualmente há mais casos novos de DM 1 diagnosticados na vida adulta do que na infância e adolescência. Pacientes com DM 1 diagnosticados na vida adulta muitas vezes são erroneamente classificados como DM2. A apresentação clínica clássica do DM 1 geralmente é abrupta, com maior propensão à cetose e cetoacidose, necessidade de insulinoterapia plena desde o diagnóstico ou após curto período. Pacientes com diagnóstico na vida adulta podem apresentar uma forma mais lentamente progressiva da doença, com evolução clínica mais branda.52
Quadro 1. Classificação do diabetes
| Características / Complicações | ||
| Diabetes tipo 1 | ||
| Imunomediado | ||
| Idiopático | ||
| Diabetes tipo 2 | ||
| Diabetes gestacional | ||
| Outros tipos de Diabetes | ||
|
Defeitos monogênicos na função das células ß pancreáticas
|
||
|
Defeitos genéticos na ação da insulina
|
||
|
Doenças do pâncreas exócrino
|
||
|
Associado a endocrinopatias
|
||
|
Secundário a drogas (quimicamente induzido):
|
||
|
Secundário a infecções
|
||
|
Formas incomuns de DM imunomediado
|
||
|
Outras síndromes genéticas associadas ao DM
|
||
Recomendações
R1 – O diagnóstico diferencial entre DM1 e DM2 DEVE SER CONSIDERADO apenas em bases clínicas. Exames complementares específicos só são necessários quando há dúvidas em relação ao diagnóstico. (ver quadro 2).
| Classe IIa | Nível B |
- Na maioria das vezes, as características clínicas são suficientes para diferenciação entre os principais tipos de DM. Shields et al.5 realizaram uma metanálise para avaliar a acurácia diagnóstica de preditores clínicos para diferenciação de DM1 e DM2. Embora composta por apenas 11 estudos e com considerável heterogeneidade, demonstrou-se que a idade no diagnóstico, o uso de insulina, o tempo para início de insulinoterapia e o índice de massa corporal foram preditores independentes e bons para diferenciação entre os dois tipos principais de diabetes, em especial a combinação de idade ao diagnóstico e tempo para início de insulina.
- O Royal College of General Practitioners National Health Service Diabetes (RCGO/NHS) sugere que pacientes com idade menor do que 35 anos e tempo de insulina menor do que 6 meses sejam classificados como DM1. As exceções são o DM2 propenso à cetose em crianças e adolescentes e o diabetes monogênico.6
- Em adultos jovens, a apresentação clínica nem sempre é suficiente para classificação do DM, pois pode haver sobreposição significativa das características clínicas de DM1 e DM2 nesta faixa etária.7
- Ke et al.8 demonstraram em uma população predominantemente de DM2 em Hong Kong (n = 15.300), que a classificação baseada apenas na apresentação clínica teve boa performance em pacientes diagnosticados com menos de 20 anos, mas teve menor sensibilidade e menor valor preditivo positivo nos pacientes mais velhos. Dessa forma, a investigação complementar para classificação adequada pode ser necessária com mais frequência nesta faixa etária.
- O sistema AABBCC tem sido proposto para auxiliar no diagnóstico diferencial entre DM1 e DM2 e está apresentado no quadro 3.
Quadro 2: Apresentações que necessitam diagnóstico diferencial entre DM 1 e DM 2 com exames complementares
| • Apresentação clínica insidiosa em crianças e adolescentes, especialmente com acantose nigricans, obesidade e disglicemia leve. |
| • Apresentação abrupta em adultos, especialmente sem hiperglicemia prévia recente, sem fator desencadeante para hiperglicemia (como medicamentos hiperglicemiantes ou infecções), sem obesidade e/ou com história de autoimunidade pessoal ou familiar. |
| • Necessidade de início de insulinoterapia nos primeiros anos após o diagnóstico em adultos para controle glicêmico adequado. |
| • Cetoacidose diabética ao diagnóstico em adultos, evoluindo subsequentemente com baixas doses de insulina, especialmente em associação com obesidade. |
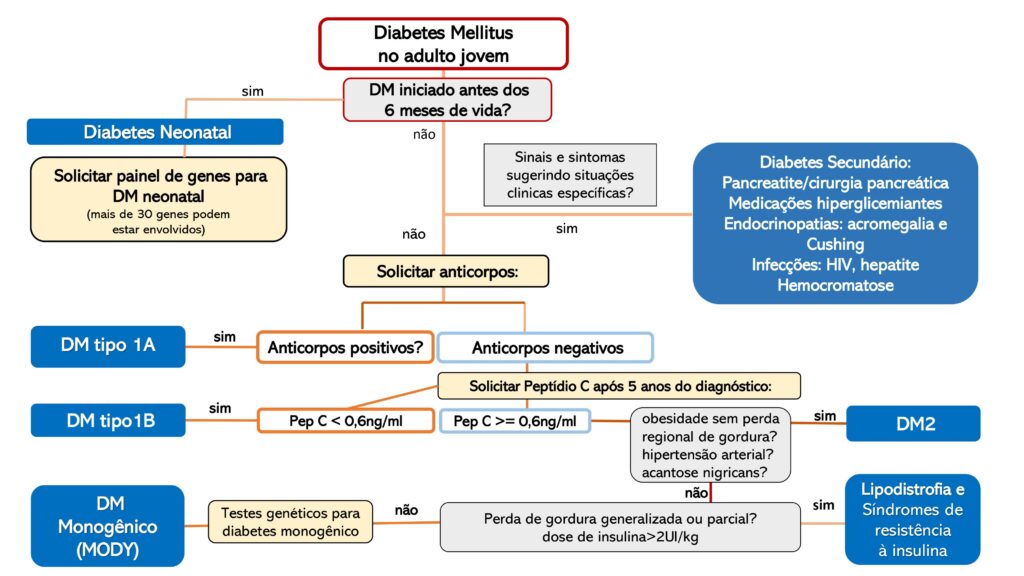
R2 – Em casos de suspeita clínica de DM1 em adultos, É RECOMENDADO a solicitação de autoanticorpos. O resultado positivo confirma o diagnóstico de DM1.
| Classe I | Nível B |
- A diferenciação fenotípica entre DM1 e DM2 pode ser desafiadora em alguns casos, tanto em adultos como em crianças.9
- Carr et al.10 demonstraram um modelo clínico combinando idade no diagnóstico, IMC e análise de autoanticorpos o qual apresentou boa capacidade de detecção de DM1 na maioria dos casos, com base em estudos histopatológicos. Além disso, demonstrou que a dosagem de peptídeo C foi capaz de identificar e auxiliar a classificação correta dos casos em que houve discrepância entre o diagnóstico clínico e histopatológico. Sendo assim, a dosagem de autoanticorpos e do peptídeo C são úteis na investigação complementar de casos de DM em que haja dúvidas quanto à classificação.10
- Lynam et al.11 demonstraram que, embora a idade no diagnóstico e o IMC sejam bons preditores e independentes para a diferenciação de DM1 e DM2, há vantagens na adição de biomarcadores na classificação do DM. Em uma coorte com 1.352 pacientes, modelos sucessivos adicionando anti-GAD, anti IA-2 e testes genéticos para determinação do escore para risco genético de DM1 demonstraram que a adição de cada um desses itens resultou em melhorias significativas na discriminação entre DM1 e DM2. Dessa forma, os biomarcadores podem ser considerados para melhorar a precisão da classificação do DM. Como a dosagem de anticorpos é mais disponível para uso clínico, ao contrário dos testes genéticos, é razoável indicar inicialmente a dosagem de autoanticorpos nos casos em dúvida diagnóstica.11
- 8% dos pacientes diagnosticados com DM2 após os 50 anos não têm sobrepeso ou obesidade, porém, os dados mostram que o ganho de peso está também relacionado a um maior risco de diabetes tipo 1 , inclusive entre crianças e adolescentes. Estudo recente mostrou, nos EEUU, prevalência de 62% de sobrepeso ou obesidade em pessoas com DM1, sendo este percentual de 84% entre aqueles com DM2.53
- Estudos recentes têm mostrado aumento da incidência e prevalência do DM1 em adultos, sendo que a mediana do diagnóstico estimada em 30 anos, com 60% dos casos diagnosticados após os 20 anos. O pico de incidência é entre 10 e 14 anos de idade, mas há incidência constante ao longo dos anos na vida adulta, com segundo pico de incidência entre 65-70 anos de idade. Em 2021, a estimativa era de no mundo haver mais pessoas com DM1 com mais de 60 anos do que com menos de 20 anos de idade.54
- Além do anti-GAD e do anti-IA2, também são úteis o anti-ZnT8 e o anti-insulina, embora os anticorpos anti-insulina sejam pouco frequentes em adultos.12–13
- A pesquisa de anticorpos é mais sensível se feita ao diagnóstico, ou nos primeiros 3 anos seguintes, estando presente em 60-80% daqueles com diagnóstico de DM1 na vida adulta. Nos anos subsequentes, os títulos caem e grande parte dos pacientes não têm anticorpos mensuráveis. O anticorpo mais frequentemente positivo em adultos é anti GAD.55,56
Nota importante 1: Autoanticorpos
- Logo após o início da insulinoterapia (5 a 7 dias), a maior parte dos pacientes desenvolvem anticorpos contra a insulina exógena, podendo haver interferência no teste do anticorpo anti-insulina, o que limita o uso para a classificação do DM.13
R3 – Em caso de dúvida diagnóstica quanto à classificação do DM com autoanticorpos negativos, é RECOMENDADA, quando disponível, a dosagem de peptídeo C randômico. Se o peptídeo C randômico estiver < 0,6 ng/ml, no paciente com cinco anos ou mais de duração do DM, a classificação deverá ser DM tipo 1B. Caso o peptídeo C esteja > 0,6 ng/ml, DM2 ou diabetes monogênico devem ser considerados.
| Classe I | Nível C |
- A avaliação da função secretória das células ß pancreáticas com a dosagem de peptídeo C pode auxiliar na classificação correta do DM, pois geralmente pacientes com DM1 apresentam perda da capacidade de secreção de insulina, e pacientes com DM2 e diabetes monogênico apresentam maior capacidade secretória. Entretanto, isso nem sempre é verdadeiro e precisa ser levado em consideração na interpretação dos testes. Pacientes com DM1 de curta duração (< 5 anos de doença) podem apresentar função residual significativa das células ß pancreáticas.Já pacientes com DM2 de longa duração podem apresentar comprometimento significativo da secreção de insulina, pela própria história natural da doença.14
- Jones et al.15 sugeriram a utilização do ponto de corte de 0,6 ng/ml ou 0,2 nmol/l para dosagem de Peptídeo C randômico para diferenciação entre DM1 com deficiência absoluta de secreção de insulina e DM2 ou DM monogênico.
- Isto foi corroborado por Carr et al.10 em estudo caso-controle clínico comparando a classificação do DM com PC e com avaliação pancreática por histopatologia.
- Fotopoulou et al.16 avaliaram o Peptídeo C randômico de 859 pacientes com diagnóstico clínico de DM1 entre 10 anos e 76 anos de idade e duração do DM maior do que 3 anos. Foi demonstrado que a dosagem de Peptideo C randômico foi menor do que 0,6 ng/ml ou 200 pmol/l em 86,8% dos pacientes com diagnóstico clínico de DM1. Entre os demais pacientes, uma parcela apresentava autoanticorpos que permitiram manter o diagnóstico inicial. Entretanto, em 6,8% do total de casos, houve reclassificação do tipo de DM para DM 2 ou DM monogênico.
Nota importante 2: Início da Insulinoterapia
- Na suspeita de DM1 o tratamento com insulina deve ser iniciado imediatamente, independentemente da confirmação laboratorial do diagnóstico.
Nota importante 3: Peptídeo C
- A dosagem do peptídeo C deve ser efetuada com o diabetes razoavelmente controlado, na ausência de hipoglicemias (glicemias > 100 mg/dL, de preferência) ou glicemias acima de 200 mg/dL. Deve ser realizada, de preferência, fora do jejum, em qualquer horário do dia. A dosagem sob estímulo com refeição mista, embora seja mais trabalhosa e cara, é o teste preferencial para pesquisa clínica.17
- O cálculo da conversão de unidades de dosagem do Peptideo C de ng/ml para pmol/L pode ser feita no site: C-Peptide conversion to pmol/L, nmol/L, ng/mL, ng/dL, ng/100mL, ng%, ng/L, µg/L. Online converter from conventional units to SI units | UNITSLAB.COM. Embora a dosagem seja mais útil para diagnóstico diferencial do DM 1 e DM2 após 3 a 5 anos de duração da doença, ela também pode ser uma ferramenta útil antes deste período, especialmente se houver níveis séricos muito baixos no início do quadro (o que é sugestivo de DM1) ou níveis séricos elevados em qualquer momento da doença (o que é sugestivo de resistência à insulina e DM2).
Nota importante 4: DM2 em adolescentes
- O diagnóstico de DM2 em crianças deve ser suspeitado em adolescentes com obesidade e afrodescendentes, com história familiar positiva para DM2, que apresentam hiperglicemia e/ou glicosúria em exame de rotina.18 A cetoacidose ao diagnóstico também pode estar presente em pacientes com DM2. Nestes casos, o diagnóstico diferencial com DM 1 será realizado pela história clínica, observação da evolução da doença e pela determinação de autoanticorpos.19 Em jovens com DM 2, os anticorpos não estão presentes e os níveis de peptídeo C são normais ou elevados.19
Figura 1. Fluxograma decisório para diagnóstico diferencial de diversos tipos de diabetes, em caso de dúvida diagnóstica.
Diabetes LADA:
R4 – É RECOMENDADO que pessoas adultas com diabetes e anticorpos positivos, as quais não necessitam de insulina por pelo menos seis meses após o diagnóstico, sejam classificadas como tendo diabetes autoimune latente do adulto (Latent Autoimmune Diabetes in Adults (LADA).
| Classe I | Nível C |
- Um número significativo de pacientes com DM diagnosticado na vida adulta (até 12% dos casos) apresenta diabetes autoimune lentamente progressivo, o que é conhecido como LADA.20
- A Organização Mundial da Saúde (OMS) sugere que o LADA seja uma forma híbrida de DM, com características de DM1 e DM2 sobrepostas. Este quadro geralmente é observado em adultos, mas raramente, crianças e adolescentes podem apresentar evolução similar.4
- Os critérios mais aceitos para diagnóstico de LADA são: 1) Idade de diagnóstico > 30 anos; 2) anticorpos positivos; 3) ausência de necessidade de insulina por pelo menos 6 meses após o diagnóstico..20,21 Por outro lado, apesar do critério de idade ao diagnóstico > 30 anos ser sugerido por alguns autores, diabetes autoimune lentamente progressivo também tem sido observado em adultos mais jovens e, mais raramente, em crianças e adolescentes.22 O anticorpo mais usado para o diagnóstico é o anti-GAD, pois é o mais frequente em adultos.
- O diagnóstico de LADA deve ser considerado em pacientes jovens com diagnóstico de DM sem necessidade inicial de insulina, especialmente com IMC dentro da normalidade. Sia et al.23 identificaram o IMC < 23 kg/m2 como o fator clínico preditivo mais importante para diferenciação de DM tipo 2 e DM auto imune em adultos (> 20 anos) com DM recém-diagnosticado, seguido de idade ao diagnóstico < 30 anos, triglicerídeos séricos < 98 mg/dl, HDL > 46 mg/dl, e HbA1c > 8,6%.
- Fourlanos et al.24 sugerem cinco critérios para suspeitar de LADA: idade ao diagnóstico < 50 anos; 2) sintomas agudos; 3) IMC < 25 kg/m2; 4) história pessoal de autoimunidade; e 5) história familiar de autoimunidade. Quando dois desses critérios estão presentes, há sensibilidade de 90% e especificidade de 71% para identificação de LADA com dosagem de autoanticorpos.24
Diabetes Monogênico (MODY):
R5 – É RECOMENDADO suspeitar de diabetes monogênico em pacientes com hiperglicemia de início antes dos 25 anos de idade, com diabetes surgindo na família antes dos 25 anos em duas ou três gerações. Os autoanticorpos devem ser negativos e o peptídeo C > 0,6 ng/mL, após 5 anos do diagnóstico de DM.
| Classe I | Nível B |
- A forma monogênica mais comum de DM é o diabetes tipo MODY (Maturity Onset Diabetes of the Young), autossômico dominante. Esta forma de DM é causada por defeitos em genes que direta ou indiretamente participam da secreção de insulina. As suas principais características são hiperglicemia de início precoce (< 25 anos), história familiar de DM antes de 25 anos em 2 a 3 gerações, autoanticorpos negativos e peptídeo C detectável (>0,6 ng/ml) após cinco anos do diagnóstico de DM (25,26).
- Testes genéticos são úteis para classificação adequada de DM nesses casos, já que a identificação de diabetes monogênico pode resultar em mudanças no tratamento proposto. Stankute et al.27 realizaram testes genéticos para pesquisa de diabetes monogênico em crianças e jovens com DM e anticorpos negativos. Nos pacientes em que DM monogênico foi identificado, foi possível a mudança prospectiva de tratamento em mais de 50% dos casos.
- Shields e colaboradores28 desenvolveram um modelo de predição de probabilidade de MODY (MODY Probability Calculator) utilizando uma combinação de dados clínico-laboratoriais de pacientes com diagnóstico de DM antes dos 30 anos de idade. O ponto de corte observado de probabilidade discriminatória (DM1 vs. DM2 vs. MODY) com sensibilidade ≥ 80% e especificidade ≥ 90% foi 50%. Esse modelo de predição, entretanto, foi validado apenas em indivíduos caucasianos de origem europeia.28 Em 2019, dois estudos preliminares29–30 , utilizando essa ferramenta na população brasileira, sugeriram que pontos de cortes iguais ou superiores a 60% seriam mais adequados para indicar o teste genético no Brasil. Mais estudos são necessários para determinar o ponto de corte ideal em não caucasianos.
Nota importante 5: Calculadora de probabilidade MODY
- A calculadora para risco de probabilidade de MODY pode ser usada para avaliação de risco. Sugere-se que pacientes com valor preditivo positivo > 60% sejam submetidos a testes genéticos. A calculadora está disponível no site abaixo e em plataformas mobile iOS e Android como o aplicativo Diabetes Diagnostics. https://www.diabetesgenes.org/exeter-diabetes-app/ModyCalculator
Nota importante 6: Pesquisa de MODY
- A pesquisa de mutações para pacientes com suspeita de MODY deve ser feita por via de painel de genes. Os tipos mais comuns de MODY são MODY-GCK, MODY-HNF1A e MODY-HNF4A e MODY-HNF1B. O MODY-GCK é caracterizado por hiperglicemia leve em jejum, assintomática e não progressiva, geralmente sem evolução para complicações micro e macrovasculares. Nos casos de MODY-HNF1A e HNF4A, geralmente há boa resposta a sulfonilureias por vários anos. Pacientes com MODY-HNF1B apresentam malformações urogenitais e em cerca de 50% dos casos pode não haver história familiar.
Nota importante 7: MODY-GCK
- Como muitos pacientes com mutações de GCK não têm história familiar de DM conhecida, uma vez que a hiperglicemia leve pode não ser detectada, recomendamos rastreamento em pessoas com fenótipo característico, mesmo na ausência de história familiar. Além disso, 7,3% dos casos de MODY podem ser mutações de novo.31. Como pacientes com mutações MODY-GCK apresentam fenótipo bem característico, na suspeita destes casos, a avaliação genética deve ser mais específica, sem o painel completo, incluindo apenas pesquisa de mutação do gene GCK por método de Sanger.
Quadro 3: Características dos diferentes tipos de MODY
| TIPO DE MODY | CARACTERÍSTICAS CLÍNICAS: |
| MODY-GCK | Mais comum. Hiperglicemia de jejum leve, desde o nascimento, assintomática, não progressiva e geralmente sem evolução para complicações micro e macrovasculares. |
| MODY-HNF4A | Comum. Boa resposta às sulfoniluréias. Associação com macrossomia fetal e hipoglicemia neonatal. |
| MODY-HNF1A | Comum. Hiperglicemia de início na infância/adolescência. Glicosúria maior do que esperado para a glicemia. Boa resposta às sulfoniluréias. |
| MODY-HNF1B | Comum. Em cerca de 50% dos casos pode não haver história familiar de diabetes. Malformações urogenitais, cistos renais. Pode haver atrofia pancreática, disfunção exócrina pancreática, malformações uterinas, gota ou hiperuricemia, testes de função hepática anormais, hipomagnesemia. |
| MODY-KCNJ11 | Resposta às sulfonilureias. |
| MODY-ABCC8 | Resposta às sulfonilureias. |
| MODY-PDX1 | Raro. Diabetes e agenesia parcial do pâncreas. |
| MODY-CEL | Poucos casos descritos. MODY associado a atrofia pancreática, dislipidemia e insuficiência exócrina. |
| MODY-NEUROD1 | Poucos casos descritos. |
| MODY-INS | Poucos casos descritos. |
| APPL1 | Poucos casos descritos. |
HNF: Hepatocyte nuclear factor; GCK: Glucoquinase; PDX1:pancreatic and duodenal homeobox 1),NEUROD1: Neurogenic differentiation 1; INS: Insulin; KCNJ11: Potassium Inwardly Rectifying Channel Subfamily J Member 11; ABCC8: ATP Binding Cassette Subfamily C Member 8; APPL1: Adaptor Protein, Phosphotyrosine Interacting With PH Domain And Leucine Zipper 1. Fonte: Adaptado de Hattersley25, Ellard32
R6 – É RECOMENDADO o rastreamento genético associadas ao diabetes neonatal para todas as crianças com hiperglicemia detectada antes dos 6 meses de idade, sem causa secundária evidente.
| Classe I | Nível B |
- Diabetes neonatal (DMN) é caracterizado por início de hiperglicemia persistente nos primeiros seis meses de vida e geralmente é causado por mutação em um único gene associado à secreção de insulina pelas células pancreáticas. Para diagnóstico de DM neonatal, outras causas de hiperglicemia neonatal devem ser descartadas, como medicações (ex: corticóide, agentes ß adrenérgicos), sepse, uso de nutrição parenteral. Após a exclusão desses fatores, testes genéticos devem ser recomendados, porque podem modificar a conduta e auxiliar na escolha do tratamento adequado.33
- A solicitação de painel genético para DMN proporciona a confirmação diagnóstica em mais de 80% dos casos.34 O diagnóstico adequado permite aconselhamento genético familiar e também pode permitir mudanças no tratamento, já que em cerca de 90% das crianças com mutações ativadoras nos genes dos canais de potássio KATP pode ser feita a alteração de insulina para sulfonilureia.33,35
Nota Importante 8: Diabetes neonatal
- Cerca de metade dos casos de DM neonatal precisa de tratamento durante toda a vida para controle da hiperglicemia (DMN permanente – DMNP). A outra metade, apresenta hiperglicemia controlada em algumas semanas ou meses (DMN transitório – DMNT), podendo reaparecer mais tarde (na infância). Aproximadamente dois terços dos casos de DMNT são causados por anormalidades de imprinting numa região do braço curto do cromossomo 6 (6q24). O restante dos casos é resultante de alterações nos genes que codificam os canais de potássio ATP-dependente da membrana da célula ß (ABCC8 e KCNJ11). Outros genes causadores são INS e HNF1B. Já o DMNP tem como principais causas os genes ABCC, KCNJ11 e INS. Em famílias com consanguinidade, mutações em homozigose dos genes GCK e EIF2AK3 (síndrome de Wolcott-Rallison) devem ser excluídas. Formas sindrômicas de DM neonatal podem estar relacionadas com alterações genéticas mais raras. Ocasionalmente, DMN está associado à autoimunidade com alterações em genes FOXP3, STAT3 e LBRA.
EIF2AK3: Eukaryotic Translation Initiation Factor 2 Alpha Kinase 3; LBRA: lipopolysaccharide (LPS)-responsive and beige-like anchor protein; FOXP3: Forkhead Box P3; STAT3: Signal Transducer And Activator Of Transcription 3
R7 – Para crianças com DM surgido antes dos 16 anos associado a diabetes insipidus, atrofia óptica e surdez, é RECOMENDADO realizar teste genético para síndrome de Wolfram.
| Classe I | Nível C |
- Síndrome de Wolfram cursa com DM, atrofia óptica, surdez neurossensorial e diabetes insipidus. Anormalidades do trato urinário, complicações neurológicas, gonadais e gastrointestinais também podem ser observadas. Distúrbio neurodegenerativo progressivo desenvolve-se na maioria dos casos.36
- A associação de atrofia óptica progressiva e DM antes dos 16 anos é muito sugestiva dessa condição autossômica recessiva. Pacientes com síndrome de Wolfram (SW) geralmente apresentam DM como primeira manifestação com média de idade de apresentação aos seis anos, seguido de perda visual, com média de idade de apresentação aos 11 anos. Esta condição pode ser diagnosticada equivocadamente como DM1, e a alteração visual pode ser atribuída à retinopatia. Cerca de 90% dos casos são decorrentes de mutações no gene WFS1. O teste genético em pacientes com SW promove a confirmação diagnóstica e o encaminhamento precoce para acompanhamento de comorbidades associadas, como oftalmológicas, neurológicas e auditivas.37
Diabetes Mitocondrial:
R8 – Teste genético para diagnóstico de diabetes mitocondrial é RECOMENDADO em casos de DM com surdez ou oftalmoplegia progressiva, de herança materna.
| Classe I | Nível C |
- Diabetes mitocondrial corresponde a menos de 1% de casos de diabetes mellitus em crianças e adolescentes. A forma mais comum de diabetes mitocondrial é causada pela mutação m.3243 A>G no DNA mitocondrial e deve ser suspeitada quando houver o aparecimento de diabetes mellitus associado à surdez, de herança familiar materna ou diabetes e oftalmoplegia externa progressiva. Casos mais graves associados a miopatia, encefalopatia e acidose láctica podem ser causados pela mesma mutação.38
- Diagnóstico apropriado permite reconhecimento e tratamento precoce de condições associadas, como doenças neurológicas. Além disso, pacientes com diabetes mitocondrial devem evitar uso de metformina, pelo risco potencial de acidose metabólica.39–40
Diabetes tipo 2 propenso à cetose:
R9 – Para pessoas com cetoacidose ao diagnóstico de DM, com evolução subsequente para baixa ou nenhuma necessidade de insulina, É RECOMENDADO a dosagem do peptídeo C e de autoanticorpos associados ao DM, especialmente na presença de obesidade e sinais clínicos de resistência à insulina.
| Classe I | Nível B |
- Cetoacidose diabética pode ocorrer não apenas nos casos de DM1, mas também em DM2, especialmente em populações multiétnicas. Em alguns casos, ocorre cetoacidose diabética ao diagnóstico, geralmente sem fator precipitante evidente, com anticorpos negativos (evidenciando ausência de autoimunidade) e peptídeo C detectável ou até mesmo dentro da normalidade, com evolução subsequente compatível com DM2, sendo geralmente possível a retirada de insulina e tratamento com outros agentes antidiabéticos.41–42 Esse quadro é denominado DM2 propenso a cetose.
- Balasubramanyam et al.43 avaliaram a acurácia e o valor preditivo da utilização da dosagem de autoanticorpos e peptídeo C duas semanas após resolução da cetoacidose para classificação de adultos com diabetes propenso à cetose. Identificaram sensibilidade e especificidade de 99,4% e 95,9%, respectivamente, para identificação da capacidade de secreção das células ß após 12 meses. Pacientes com autoanticorpos positivos devem ser classificados como DM1. Pacientes com anticorpos negativos e função residual de célula beta geralmente apresentam curso clínico compatível com DM2, enquanto pacientes sem função residual podem ter DM1 idiopático, distúrbios do desenvolvimento pancreático ou DM fulminante.
Diabetes secundário:
R10 – É RECOMENDADO que casos de pacientes com DM, anticorpos negativos e outras doenças pancreáticas, evidentes em testes de função pancreática e/ou exames de imagem compatíveis, sejam classificados como DM secundário a doenças pancreáticas (diabetes 3c).
| Classe I | Nível C |
- Diabetes associado a outras doenças pancreáticas, como inflamações (mais frequentemente causadas por etilismo ou litíase biliar), neoplasias, hemocromatose e cirurgias pancreáticas prévias, constituem 0,5% a 9,2% dos casos de DM.44–46 Comumente são erroneamente classificados como DM2. Não há critérios universalmente aceitos para o diagnóstico de diabetes secundário a doenças pancreáticas exócrinas, também conhecido como diabetes 3c.
- Frequentemente este tipo de DM cursa com rápida deterioração da função de células ß pancreáticas e labilidade do controle glicêmico.
Nota importante 9: Diabetes secundário
- No caso de dúvidas quanto à classificação de DM, deve ser sempre considerado a presença de sinais e sintomas relacionados a doenças do pâncreas exócrino (alcoolismo, cirurgia), uso de medicações hiperglicemiantes, endocrinopatias (acromegalia, síndrome de Cushing), infecções (HIV, hepatite B e C), hemocromatose ou outras condições capazes de levar a hiperglicemia.
Diabetes associado às lipodistrofias:
R11 – Em pessoas com DM que apresentem perda de gordura corporal generalizada ou parcial, deve-se suspeitar de lipodistrofias herdadas ou adquiridas. A prega cutânea em coxa < 22mm (mulheres) e < 10 mm (homens) sugere o diagnóstico. Em caso de suspeita de formas familiares, DEVE SER CONSIDERADA a realização de testes genéticos para diagnóstico.
| Classe IIa | Nível C |
- O DM pode estar associado a síndromes lipodistróficas, que constituem um grupo heterogêneo de doenças raras que cursam com perda do tecido adiposo na ausência de privação nutricional ou estado catabólico. As lipodistrofias podem ser congênitas ou adquiridas, parciais ou generalizadas, e frequentemente, se associam também com hipertrigliceridemia, esteatose hepática, disfunção gonadal e cardiopatia.47
- A forma mais comum de lipodistrofia é adquirida e associada ao HIV. Está associada ao tratamento com inibidores de protease (IP), principalmente ritonavir e lopinavir, e inibidores da transcriptase reversa (INTR), como lamivudina, zidovudina e estavudina.
- Aproximadamente 90% dos casos de lipodistrofia congênita generalizada são causados por mutações em homozigose ou heterozigose composta nos genes AGPAT2 e BSCL2. Outros genes podem estar associados a essa condição, como CAV1 e PTRF. 47–48
- A maioria das lipodistrofias parciais é causada por mutações em heterozigose nos genes LMNA e PPARG. Outros genes causadores são: AKT2 e PLIN1. Esses pacientes apresentam perda de gordura em membros inferiores e acúmulo variável em abdome, face e pescoço.47–48
- Na presença de sinais clínicos de lipodistrofia parcial ou generalizada em crianças ou adultos jovens, em associação com DM, testes genéticos são recomendados, devendo ser realizados sempre que possível. O diagnóstico adequado pode alterar a conduta, com indicação de terapia com leptina recombinante (metreleptina) em casos selecionados (lipodistrofia generalizada e formas parciais com leptinemia baixa), e auxiliar na identificação de comorbidades.48
Nota importante 10: Medida da Prega cutânea -Lipodistrofia
Nota importante 11: Densitometria-Lipodistrofia
- Quando houver dúvida quanto à presença de lipodistrofia, além da medida de prega cutânea, pode ser realizada avaliação por densitometria por dupla emissão de raios X (em inglês, dual energy x-ray absorptiometry [DEXA]), especialmente para lipodistrofia parcial associada ao DM (relação % de gordura tronco / % de gordura membros inferiores). Uma relação % gordura tronco / % gordura membros inferiores maior ou igual a 1,5 está presente em grande parte dos casos.51
Quadro 4: Abordagem AABBCC para a classificação do diabetes
| Parâmetro | Descrição |
| Age (idade) |
|
| Autoimunidade |
|
|
BMI (body mass index ou índice de massa corporal - IMC) |
|
| Background (origem) |
|
| Controle |
|
| Comorbidades |
|
Tabela de recomendações.
| Recomendações | Classe | Nível |
| R1 - O diagnóstico diferencial entre DM1 e DM2 DEVE SER CONSIDERADO apenas em bases clínicas. Exames complementares específicos só são necessários quando há dúvidas em realação ao diagnóstico. (ver quadro 2). | IIa | B |
| R2 – Em casos de suspeita clínica de DM1 em adultos, É RECOMENDADO a solicitação de autoanticorpos. O resultado positivo confirma o diagnóstico de DM1. | I | B |
| R3 – Em caso de dúvida diagnóstica quanto à classificação do DM com autoanticorpos negativos, é RECOMENDADA, quando disponível, a dosagem de peptídeo C randômico. Se o peptídeo C randômico estiver < 0,6 ng/ml, no paciente com cinco anos ou mais de duração do DM, a classificação deverá ser DM tipo 1B. Caso o peptídeo C esteja > 0,6 ng/ml, DM2 ou diabetes monogênico devem ser considerados. | I | C |
| R4 – É RECOMENDADO que pessoas adultas com diabetes e anticorpos positivos, as quais não necessitam de insulina por pelo menos seis meses após o diagnóstico, sejam classificadas como tendo diabetes autoimune latente do adulto (Latent Autoimmune Diabetes in Adults (LADA). | I | C |
| R5 – É RECOMENDADO suspeitar de diabetes monogênico em pacientes com hiperglicemia de início antes dos 25 anos de idade, com história familiar de diabetes surgindo antes de 25 anos em duas ou três gerações. Os autoanticorpos devem ser negativos e o peptídeo C detectável acima de 0,6 ng/ml após cinco anos do diagnóstico de DM. | I | B |
| R6 – É RECOMENDADO rastreamento de alterações genéticas associadas a diabetes neonatal para todas as crianças com hiperglicemia mantida de início antes dos seis meses de idade, sem causa secundária evidente. | I | B |
| R7 – Para pacientes com DM identificado antes dos 16 anos associado a diabetes insipidus, atrofia óptica e/ou surdez, é RECOMENDADO realizar teste genético para síndrome de Wolfram. | I | C |
| R8 – Teste genético para diagnóstico de diabetes mitocondrial É RECOMENDADO para casos de DM com surdez ou com oftalmoplegia externa progressiva de herança materna. | I | C |
| R9 – Para pessoas com cetoacidose ao diagnóstico de DM, com evolução subsequente para baixa ou nenhuma necessidade de insulina, É RECOMENDADO dosagem de peptídeo C e de autoanticorpos associados ao DM, especialmente na presença de obesidade e sinais clínicos de resistência à insulina. | I | B |
| R10 – É RECOMENDADO que casos de pacientes com DM, anticorpos negativos e outras doenças pancreáticas, evidentes em testes de função pancreática e/ou exames de imagem compatíveis, sejam classificados como DM secundário a doenças pancreáticas. | I | C |
| R11 – Em pessoas com DM que apresentem perda de gordura corporal generalizada ou parcial, deve-se suspeitar de lipodistrofias herdadas ou adquiridas. A prega cutânea em coxa < 22mm (mulheres) e < 10 mm (homens) sugere o diagnóstico. Em caso de suspeita de formas familiares, DEVE SER CONSIDERADA a realização de testes genéticos para diagnóstico. | IIa | C |
Referências
- Siller AF, Tosur M, Relan S, Astudillo M, McKay S, Dabelea D, Redondo MJ. Challenges in the diagnosis of diabetes type in pediatrics. Pediatr Diabetes. 2020 Jun 19. doi: 10.1111/pedi.13070.
- American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2014;37(Suppl. 1):S81-90.
- Ahlqvist E, Storm P, Käräjämäki A, Martinell M, Dorkhan M, Carlsson A, Vikman P, Prasad RB, Aly DM, Almgren P, Wessman Y, Shaat N, Spégel P, Mulder H, Lindholm E, Melander O, Hansson O, Malmqvist U, Lernmark Å, Lahti K, Forsén T, Tuomi T, Rosengren AH, Groop L. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018 May;6(5):361-9.
- Classification of diabetes mellitus. Geneva: World Health Organization; 2019. Licence: CC BY-NC-SA 3.0 IGO.
- Yeow TP, Aun ES, Hor CP, Lim SL, Khaw CH, Aziz NA. Challenges in the classification and management of Asian youth-onset diabetes mellitus- lessons learned from a single centre study. PLoS One. 2019 Jan 25;14(1):e0211210.
- Ke et al. Development and validation of algorithms to classify type 1 and 2 diabetes according to age at diagnosis using electronic health records. BMC Medical Research Methodology 2020;20:35
- Redondo MJ, Hagopian WA, Oram R, Steck AK, Vehik K, Weedon M, Balasubramanyam A, Dabelea D. The clinical consequences of heterogeneity within and between different diabetes types. Diabetologia. 2020 Oct;63(10):2040-8.
- Carr ALJ, Perry DJ, Lynam AL, Chamala S, Flaxman CS, Sharp SA, Ferrat LA, Jones AG, Beery ML, Jacobsen LM, Wasserfall CH, Campbell-Thompson ML, Kusmartseva I, Posgai A, Schatz DA, Atkinson MA, Brusko TM, Richardson SJ, Shields BM, Oram RA. Histological validation of a type 1 diabetes clinical diagnostic model for classification of diabetes. Diabet Med. 2020 Dec;37(12):2160-8.
- Lynam A, McDonald T, Hill A, Dennis J, Oram R, Pearson E, Weedon M, Hattersley A, Owen K, Shields B, Jones A. Development and validation of multivariable clinical diagnostic models to identify type 1 diabetes requiring rapid insulin therapy in adults aged 18-50 years. BMJ Open. 2019 Sep 26;9(9):e031586.
- Garnier L, Marchand L, Benoit M, Nicolino M, Bendelac N, Wright C, Moulin P, Lombard C, Thivolet C, Fabien N. Screening of ZnT8 autoantibodies in the diagnosis of autoimmune diabetes in a large French cohort. Clin Chim Acta. 2018 Mar;478:162-5.
- Dantas J, Mamede RMT, Malheiros J. Classificação do diabetes mellitus. In: Milech A, Oliveira JEP, Zajdenverg L, Rodacki M, et al. Rotinas de diagnóstico e tratamento do diabetes mellitus. Rio de Janeiro: AC Farmacêutica. 2014.
- Service FJ, Rizza RA, Zimmerman BR, Dyck PJ, O´Brien PC, Melton 3rd LJ. The classification of diabetes by clinical and C-peptide criteria. A prospective population-based study. Diabetes Care. 1997;20(2):198-201.
- Jones AG, Hattersley AT. The clinical utility of C-peptide measurement in the care of patients with diabetes. Diabet Med. 2013 Jul;30(7):803-17.
- Foteinopoulou E, Clarke CAL, Pattenden RJ, Ritchie SA, McMurray EM, Reynolds RM, Arunagirinathan G, Gibb FW, McKnight JA, Strachan MWJ. Impact of routine clinic measurement of serum C-peptide in people with a clinician-diagnosis of type 1 diabetes. Diabet Med. 2020 Nov 1;:e14449.
- Greenbaum CJ, Harrison LC, Immunology of Diabetes Society. Guidelines for intervention trials in subjects with newly diagnosed type 1 diabetes. Diabetes. 2003;52:1059–65.
- Copeland KC, Zeitler P, Geffner M, Guandalini C, Higgins J, Hirst K, et al. Characteristics of adolescents and youth with recent-onset type 2 diabetes: the TODAY cohort at baseline. J Clin Endocrinol Metab. 2011;96(1):159-67.
- Petersmann A. Definition, classification and diagnosis of diabetes mellitus. Exp Clin Endocrinol Diabetes. 2019;127(Suppl 1):S1–S7.
- Buzzetti R, Tuomi T, Mauricio D, Pietropaolo M, Zhou Z, Pozzilli P, Leslie RD. Management of latent autoimmune diabetes in adults: a consensus statement from an International Expert Panel. Diabetes. 2020 Oct;69(10):2037-47.
- Thomas NJ, Lynam AL, Hill AV, Weedon MN, Shields BM, Oram RA, McDonald TJ, Hattersley AT, Jones AG. Type 1 diabetes defined by severe insulin deficiency occurs after 30 years of age and is commonly treated as type 2 diabetes. Diabetologia. 2019 Jul;62(7):1167-72.
- Stenström G, Gottsäter A, Bakhtadze E, Berger B, Sundkvist G. Latent autoimmune diabetes in adults: definition, prevalence, beta-cell function, and treatment. Diabetes. 2005 Dec;54 (Suppl 2):S68-72.
- Sia HK, Tu ST, Liao PY, Lin KH, Kor CT, Yeh LL. Share. A convenient diagnostic tool for discriminating adult-onset glutamic acid decarboxylase antibody-positive autoimmune diabetes from type 2 diabetes: a retrospective study. PeerJ. 2020 Feb 14;8:e8610.
- Fourlanos S, Perry C, Stein MS, Stankovich J, Harrison LC, Colman PG. A clinical screening tool identifies autoimmune diabetes in adults. Diabetes Care. 2006 May;29(5):970-5.
- Hattersley AT, Greeley SAW, Polak M, Rubio-Cabezas O, Njølstad PR, Mlynarski W, Castano L, Carlsson A, Raile K, Chi DV, Ellard S, Craig ME. ISPAD Clinical Practice Consensus Guidelines 2018: The diagnosis and management of monogenic diabetes in children and adolescents. Pediatr Diabetes. 2018 Oct;19 (Suppl 27):47-63.
- Shields BM, McDonald TJ, Ellard S, Campbell MJ, Hyde C, Hattersley AT. The development and validation of a clinical prediction model to determine the probability of MODY in patients with young-onset diabetes. Diabetologia. 2012 May;55(5):1265-72
- Stankute I, Verkauskiene R, Blouin JL, Klee P, Dobrovolskiene R, Danyte E, Dirlewanger M, Santoni F, Razanskaite-Virbickiene D, Marciulionyte D, Jasinskiene E, Mockeviciene G, Schwitzgebel VM. Systematic genetic study of youth with diabetes in a single country reveals the prevalence of diabetes subtypes, novel candidate genes, and response to precision therapy. Diabetes. 2020 May;69(5):1065-71.
- Shields BM, Shepherd M, Hudson M, et al; UNITED study team. Population-based assessment of a biomarker-based screening pathway to aid diagnosis of monogenic diabetes in young-onset patients. Diabetes Care 2017;40(8):1017-25. doi:10.2337/dc17-0224.
- Tarantino RM, Abreu GM, Fonseca ACP, Kupfer R, Pereira MFC, Campos Júnior M, Zajdenverg L, Rodacki M. MODY probability calculator for GCK and HNF1A screening in a multiethnic background population. Arch Endocrinol Metab. 2020 Feb;64(1):17-23.
- Magalhaes ALF, Motta FT, Alcântara AEE, Franco PC, Cabral HR, Costa-Riquetto AD, et al. Probability of MODY in a cohort of 209 Brazilians with young onset diabetes. Pediatr Diabetes. 2019 Oct 29;20(S28):162.
- Stanik J, Dusatkova P, Cinek O, Valentinova L, Huckova M, Skopkova M, Dusatkova L, Stanikova D, Pura M, Klimes I, Lebl J, Gasperikova D, Pruhova S. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia. 2014;57:480-4.
- Ellard S, Colclough K, Patel KA, Hattersley AT. Prediction algorithms: pitfalls in interpreting genetic variants of autosomal dominant monogenic diabetes. Journal of Clinical Investigation 130 (1): 14–16. 2019 https://doi.org/10.1172/JCI133516.
- Pearson ER, Flechtner I, Njølstad PR, et al. Switching from insulin to oral sulfonylureas in patients with diabetes due to Kir6.2 mutations. N Engl J Med 2006; 355:467
- Besser RE, Flanagan SE, Mackay DG, Temple IK, Shepherd MH, Shields BM, Ellard S, Hattersley AT. Prematurity and genetic testing for neonatal diabete. Hattersley AT. Pediatrics. 2016;138(3) pii: e20153926.
- Rafiq M, Flanagan SE, Patch AM, et al. Effective treatment with oral sulfonylureas in patients with diabetes due to sulfonylurea receptor 1 (SUR1) mutations. Diabetes Care. 2008;31(2):204-9.
- Rigoli, L., Bramanti, P., Di Bella, C. et al. Genetic and clinical aspects of Wolfram syndrome 1, a severe neurodegenerative disease. Pediatr Res. 2018;83:9219. https://doi.org/10.1038/pr.2018.17
- Reinauer C, Meissner T, Roden M, et al. Low prevalence of patients with mitochondrial disease in the German/Austrian DPV diabetes registry. Eur J Pediatr. 2016;175(5):613-22.
- Murphy R, Turnbull DM, Walker M, Hattersley AT. Clinical features, diagnosis and management of maternally inherited diabetes and deafness (MIDD) associated with the 3243A>G mitochondrial point mutation. Diabet Med. 2008 Apr;25(4):383-99. doi: 10.1111/j.1464-5491.2008.02359.x. Epub 2008 Feb 18.
- Balasubramanyam A, Nalini R, Hampe C, Maldonado M. Syndromes of Ketosis-Prone Diabetes Mellitus. Endocrine Reviews. 2008;29(3):292-302.
- Ramaldes LAL, Santos SS, Sa JR, Dualib PM, Dib SA. The first series of cases of ketosis- prone type 2 diabetes (flatbush diabetes) in Brazilian adults. Archives of Endocrinology and Metabolism 2021; in press.
- Balasubramanyam A, Garza G, Rodriguez L et al. Accuracy and predictive value of classification schemes for ketosis-prone diabetes. Diabetes Care. 2006;29(12):2575-9. https://doi.org/10. 2337/dc06-0749
- Hart PA, Bellin MD, Andersen DK, Bradley D, Cruz-Monserrate Z, Forsmark CE, Goodarzi MO, Habtezion A, Korc M, Kudva YC, Pandol SJ, Yadav D, Chari ST; Consortium for the Study of Chronic Pancreatitis, Diabetes, and Pancreatic Cancer(CPDPC). Type 3c (pancreatogenic) diabetes mellitus secondary to chronic pancreatitis and pancreatic cancer. Lancet Gastroenterol Hepatol. 2016 Nov;1(3):226-37.
- Woodmansey C, McGovern AP, McCullough KA, Whyte MB, Munro NM, Correa AC, et al. Incidence, demographics, and clinical characteristics of diabetes of the exocrine pancreas (type 3c): a retrospective cohort study. Diabetes Care. 2017 Nov;40(11):1486-93.
- Ewald N, Kaufmann C, Raspe A, Kloer HU, Bretzel RG, Hardt PD. Prevalence of diabetes mellitus secondary to pancreatic diseases (type 3c). Diabetes Metab Res Rev. 2012 May;28(4):338-42.
- Brown RJ, Araujo-Vilar D, Cheung PT, Dunger D, Garg A, Jack M,et al. The diagnosis and management of Lipodystrophy Syndromes: a multi-society practice guideline. J Clin Endocrinol Metab. 2016 Dec;101(12):4500-11
- Handelsman Y, Oral EA, Bloomgarden ZT, Brown RJ, Chan JL, Einhorn D, et al; American Association of Clinical Endocrinologists. The clinical approach to the detection of lipodystrophy – an AACE consensus statement. Endocr Pract. 2013 Jan-Feb;19(1):107-16.
- Misra A, Peethambaram A, Garg A. Clinical features and metabolic and autoimmune derangements in acquired partial lipodystrophy: report of 35 cases and review of the literature. Medicine. 2004; 83:18-34
- Jackson AS, Pollock ML, Ward A. Generalized equations for predicting body density of women. Med Sci Sports Exerc. 1980;12:175-81.
- Valerio CM, Zajdenverg L, de Oliveira JE, Mory PB, Moyses RS, Godoy-Matos AF. Body composition study by dual-energy x-ray absorptiometry in familial partial lipodystrophy: finding new tools for an objective evaluation. Diabetol Metab Syndr. 2012 Aug 31;4(1):40. doi: 10.1186/1758-5996-4-40.
- Leslie RD, Evans-Molina C, Freund-Brown J, Buzzetti R, Dabelea D, Gillespie KM, Goland R, Jones AG, Kacher M, Phillips LS, Rolandsson O, Wardian JL, Dunne JL. Adult-Onset Type 1 Diabetes: Current Understanding and Challenges. Diabetes Care. 2021 Nov;44(11):2449-2456. doi: 10.2337/dc21-0770.
- Fang M, Jeon Y, Echouffo-Tcheugui JB, Selvin E. Prevalence and Management of Obesity in U.S. Adults With Type 1 Diabetes. Ann Intern Med. 2023 Mar;176(3):427-429. doi: 10.7326/M22-3078.
- Gabriel A Gregory*, Thomas I G Robinson*, Sarah E Linklater, Fei Wang, Stephen Colagiuri, Carine de Beaufort, Kim C Donaghue, International Diabetes Federation Diabetes Atlas Type 1 Diabetes in Adults Special Interest Group†, Dianna J Magliano, Jayanthi Maniam, Trevor J Orchard, Priyanka Rai, Graham D Ogle. Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study. Lancet Diabetes Endocrinol 2022; 10: 741–60.
- Lynam A, McDonald T, Hill A, et al. Development and validation of multivariable clinical diagnostic models to identify type 1 diabetes requiring rapid insulin therapy in adults aged 18–50 years. BMJ Open 2019;9:e031586. doi:10.1136/bmjopen-2019-031586
- Tatovic D, Jones AG, Evans C, Long AE, Gillespie K, Besser REJ, Leslie RD, Dayan CM; Type 1 diabetes UK Immunotherapy Consortium. Diagnosing Type 1 diabetes in adults: Guidance from the UK T1D Immunotherapy consortium. Diabet Med. 2022 Jul;39(7):e14862. doi: 10.1111/dme.
Cite este artigo
Rodacki M, Teles M, Gabbay M, Montenegro R, Bertoluci M, Rodrigo Lamounier. Classificação do diabetes. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-1, ISBN: 978-85-5722-906-8.