Autores: Lenita Zajdenverg, Cristina Façanha, Patrícia Medici Dualib, Airton Golbert, Carlos Antonio Negrato.
Editor Chefe: Marcello Bertoluci
Ultima revisão em: 28/01/2022
DOI: 10.29327/557753.2022-12 | Cite este Artigo
Introdução
Planejamento da gestação
O planejamento da gestação com controle glicêmico adequado é efetivo para reduzir riscos de malformações congênitas e a mortalidade perinatal.1–2
Mulheres com diabetes mellitus (DM) que estejam na menacme devem receber orientação da equipe de saúde para evitar a gestação não planejada. As pacientes e seus familiares devem ser informados sobre como o diabetes pode complicar a gestação e de que maneira a gestação pode agravar o diabetes e suas complicações (Quadro 1).
Idealmente, antes de descontinuar o uso do método contraceptivo, mulheres com DM que desejem engravidar devem estar com excelente controle metabólico. Um estudo que comparou terapia com múltiplas doses de insulina (MDI) com sistema de infusão contínua de insulina (SICI) não encontrou diferença nos desfechos gestacionais entre os dois métodos terapêuticos. Entretanto, a ausência de planejamento da gravidez e níveis mais elevados de HbA1c no primeiro trimestre foram preditores independentes de bebês GIG [OR: 4,99 ( IC 95% 1,12 a 21,0 p = 0,033)] e [OR: 3,02 (IC 95%, 1,19 a 7,65, p = 0,019)], respectivamente e de macrossomia [OR: 8,43 ( IC 95% 1,36 a 51,93 p = 0,021)] e [OR: 5,47 (IC 95% 1,77 a 16,87 p = 0,003)], respectivamente.3
Quadro 1. Orientações durante o planejamento da gestação de mulheres com diabetes.4
| Temas que devem ser abordados durante consulta de mulheres com DM em idade fértil não gestantes e seus familiares: |
|
Recomendações
R1. É RECOMENDADO aconselhar mulheres com DM para que planejem a gestação e orientá-las sobre a importância dos cuidados pré-concepcionais, com o objetivo de alcançar melhores desfechos perinatais.
| Classe I | Nível A |
- Uma metanálise e revisão sistemática que incluiu 5.903 mulheres com DM pré-gestacional mostrou que cuidados pré-concepcionais reduziram o risco de malformações em 71%, o risco de mortalidade perinatal em 54% e o risco de prematuridade em 5%. Os seguintes cuidados pré-gestacionais foram avaliados: controle glicêmico com insulina, dieta e antidiabéticos orais; aconselhamento e/ou educação de mulheres sobre complicações do diabetes durante a gestação, a importância do controle glicêmico com insulina e do automonitoramento do nível de glicose no sangue; rastreamento e tratamento pré-concepção das complicações crônicas do diabetes; uso de método contraceptivo eficaz até que a otimização do controle glicêmico seja alcançada; uso de ácido fólico no período pré-concepção; prática de exercício físico e / ou controle de peso pré-gestacional.1
R2. DEVE SER CONSIDERADO o nível ideal de HbA1c de 6,0% para engravidar, se utilizado o método de cromatografia líquida de alta eficiência (high performance liquid chromatography – HPLC). Em casos de inviabilidade do método HPLC, o nível de HbA1c deve estar o mais próximo possível de valores normais, sem a ocorrência de hipoglicemias.
| Classe IIa | Nível B |
- A presença de DM pré-gestacional aumenta significativamente o risco de malformações fetais. Uma metanálise de 52 estudos (36 controlados e 16 coortes) encontrou aumento da chance de 20 diferentes fenótipos de cardiopatias congênitas na prole de gestantes com DM pré-gestacional [OR: 3,18, (IC 95% 2,77 a 3,65)].5
- Dados prospectivos coletados em 933 gestações únicas complicadas por DM1 mostraram que o risco de resultados adversos graves em diferentes níveis de HbA1c, comparado com a população sem DM, foi significativamente maior quando HbA1c periconcepcional excedeu 6,9% e o risco tendeu a aumentar gradualmente com o aumento de HbA1c. Mulheres com HbA1c superior a 10,4% tinham aumento significativo da taxa de malformação congênita, aproximadamente quatro vezes maior que a população sem DM.6
- O planejamento adequado da gestação é um dos fatores mais importantes na redução do risco de defeitos congênitos em mães com DM pré-gestacional, porque a organogênese ocorre nas fases iniciais da gravidez.7
- O risco de complicações perinatais aumenta significativamente com o aumento da HbA1c.8
- Estudo sueco avaliou a incidência de malformações congênitas em 2.458 nascidos vivos de mães com DM1, com medida de HbA1c três meses antes e após a concepção, comparada com 1.159.865 bebês de mães sem DM. Os nascidos vivos de mulheres com DM1 tiveram mais que o dobro de risco de defeitos cardíacos. Este risco aumenta progressivamente quanto maior o nível da HbA1c medida três meses antes ou depois da concepção. A incidência de malformações cardíacas nos filhos de mulheres com DM1 foi de 33 por 1.000 nascimentos quando HbA1c < 6,5% [RR: 2,17 (IC 95% 1,37 a 3,42)]; de 49 por 1.000 quando HbA1c entre 6,5% e 7,7% [RR: 3,17 ( IC 95% 2,45 a 4,11)]; de 44 por 1.000 quando HbA1c entre 7,8% e 9,0% [RR: 2,79 (IC 95% 1,90 a 4,12)]; e de 101 por 1.000 quando HbA1c ≥ 9,1% [RR: 6,23 (IC 95% 4,32 a 9,00)]. Foram encontrados 50 casos de defeitos não cardíacos maiores nos filhos de mães com DM1 comparado a 18 casos em filhos de mães sem DM. A frequência de malformações maiores não cardíacas foi apenas contabilizada nos filhos nascidos vivos e teve poder estatístico limitado.8
- Outro estudo sueco avaliou 2.474 bebês nascidos de mulheres com DM1 e 1.165.216 bebês nascidos de mulheres sem diabetes. O nascimento prematuro ocorreu em 22,3% dos casos de mães com DM1 comparado a 4,7% dos casos de mães sem DM. O risco de parto prematuro foi maior em mulheres com DM1 comparado a mulheres sem DM1 com níveis de HbA1c três meses antes ou depois do início da gestação até 6,5% [RR: 2,83 (IC 95% 2,28 a 3,52)]. O risco de prematuridade aumentou significativamente com a HbA1c. A incidência de parto prematuro foi de 20,6% entre mães com nível de HbA1c entre 6,5% e 7,7% [RR: 4,22 (IC 95% 3,74 a 4,75)]; de 28,3% quando HbA1c entre 7,8% e 9,0% [RR: 5,56 (IC 95% 4,84 a 6,38)]; e de 37,5% quando HbA1c > 9% [RR: 6,91 (IC 95% 5,85 a 8,17)]. Níveis crescentes de HbA1c também foram associados aos desfechos secundários do estudo: bebês GIG, hipoglicemia, dificuldade respiratória, baixo índice de Apgar, morte neonatal e natimortalidade.9,10
- Resultados adversos (aborto espontâneo e terapêutico, natimorto, morte neonatal ou anomalias congênitas importantes detectadas no primeiro mês) foram relatados em 29% de 573 gestações em mulheres com DM1 acompanhadas entre 1985 e 2003 em uma cidade dinamarquesa. A prevalência desses resultados adversos variou seis vezes, de 12% (IC 95% 7,2 a 17) no mais baixo quintil de HbA1c no primeiro trimestre da gravidez até 79% (IC 95% 60 a 91) no mais alto quintil de exposição. A partir de níveis de HbA1c > 7%, houve associação linear entre a HbA1c do primeiro trimestre e risco de resultados adversos. Um aumento de 1% na HbA1c correspondeu a 5,5% de aumento no risco de resultado perinatal adverso. Os autores concluíram que existe uma associação entre HbA1c e o risco de resultados adversos na gestação.11
Nota importante 1: Risco elevado de hipoglicemia.
- Em caso de mulheres com risco elevado de hipoglicemia associado ao tratamento intensivo com insulina, é aceitável uma meta de HbA1c de até 6,5% no aconselhamento pré-concepcional.
R3. É RECOMENDADO aconselhar mulheres com HbA1c acima de 9% para evitarem a gestação até que alcancem melhor controle glicêmico.
| Classe I | Nível B |
- Em avaliação comparativa de nascidos vivos de mulheres com DM registrados na Suécia, entre 2003 e 2014, com filhos de mulheres sem DM, a HbA1c materna 90 dias antes ou após a concepção em níveis ≥ 9,1% aumentou em torno de seis vezes o risco de malformações cardíacas [RR: 6,23, (IC 95% 4,32 a 9,00)] e de prematuridade [RR: 6,91 (IC 95% 5,85 a 8,17)].8–9
Nota importante 2: Decisão de engravidar.
- Apesar de o risco de desfechos perinatais desfavoráveis aumentar de forma contínua quanto maior for o nível de HbA1c periconcepção, e de que o valor da HbA1c é limitado na previsão do resultado individual na gestação, considera-se que mulheres com DM devam ser aconselhadas a postergar a gestação até que níveis de HbA1c associados com menor risco de malformações e prematuridade sejam alcançados.
Metas e monitorização do controle glicêmico durante a gestação
Hemoglobina glicada (HbA1c)
A HbA1c está sujeita às alterações hematológicas próprias da gestação e não estão estabelecidos valores de referência para cada trimestre gestacional.12 A deficiência de ferro pode prolongar a sobrevivência das hemácias e pode levar ao aumento absoluto de 0,1% a 0,2% na HbA1c antes do tratamento com reposição do mineral.13 Por sua vez, os valores da HbA1c geralmente caem ao longo da gestação na maioria das mulheres, em razão do aumento da hematopoiese e da diminuição dos níveis de glicose no sangue em jejum, frequentemente observados na gestação.14 Apesar desses fatores, nas gestações de mulheres com DM pré-gestacional, níveis maiores de HbA1c no segundo e no terceiro trimestres estão associados a piores desfechos perinatais, como morte, pré-eclâmpsia, macrossomia e parto prematuro.15
R4. É RECOMENDADO para a mulher com DM pré-gestacional que a HbA1c seja medida na primeira consulta pré-natal.
| Classe I | Nível B |
- A medida da HbA1c no primeiro trimestre é parâmetro de avaliação de riscos maternos e fetais. Os riscos fetais aumentam progressivamente com a elevação das medidas de HbA1c no primeiro trimestre.11
- Um estudo de grande coorte de base populacional do Canadá, envolvendo 3.459 nascimentos de mulheres com DM pré-gestacional, mostrou que a redução de 0,5% da HbA1c naquelas que apresentavam na pré-concepção valores acima de 6,4% foi associada à redução relativa de 6% [RRA: 0,94 (IC 95% 0,89 a 0,98)] em qualquer anomalia, bem como diminuição relativa de 11% nas anomalias cardíacas [RRA: 0,89 (IC 95% 0,84 a 0,95)]. Além disso, houve redução de desfecho composto materno (40 desfechos da gestação, parto e pós-parto) associada à queda de 0,5% na HbA1c desde a pré-concepção até 21 semanas de gestação [RRA: 0,90 (IC 0,84 a 0,96)]; [DRA (diferença de risco absoluto) -0,64% (IC 95% 1,20 a 0,18)]. Esses resultados enfatizam a importância de melhor controle glicêmico antes e logo após a concepção.16
- O risco de desordens hipertensivas da gestação também está associado com a HbA1c medida no primeiro trimestre gestacional. Em metanálise de cinco estudos prospectivos observacionais, que incluiu gestantes com DM1, foi encontrado maior risco de pré-eclâmpsia para cada aumento de 1% de HbA1c durante o primeiro trimestre da gravidez [OR: 1,37 (IC 95% 1,24 a 1,51, I² = 0,0%)].17
R5. Com o objetivo de avaliar o risco de complicações e adesão ao monitoramento, PODE SER CONSIDERADO medir a HbA1c mensalmente na mulher com DM pré-gestacional, até que valores < 6% sejam atingidos, quando então poderá ser avaliada a cada dois ou três meses.
| Classe IIb | Nível B |
- Estudo prospectivo que acompanhou 725 gestantes com DM1, considerando como grupo de referência gestantes com DM1 e HbA1c entre a 26a semana e a 34a semana de idade gestacional < 6,0%, encontrou risco aumentado de bebês GIG [OR: 1,7 (IC 95% 1,0 a 3,0)] em gestações com HbA1c entre 6,0% e 6,4%; com HbA1c entre 6,5% e 6,9%, foi maior o risco de parto prematuro [OR: 2,5 (IC 95% 1,3 a 4,8)], pré-eclâmpsia [OR: 4,3 (IC 95% 1,7 a 10,8)] e hipoglicemia neonatal [OR: 2,9 (IC 95% 1,5 a 5,6)]. Esses dados sugerem que há utilidade clínica na medição regular de HbA1c durante a gestação da mulher com DM1.18
- A medida da HbA1c fornece informação retrospectiva das médias glicêmicas e não é adequada para avaliar o perfil e a variabilidade diária da glicose. A HbA1c não é ferramenta adequada para ajustes da terapia. Portanto, considera-se que a dosagem da HbA1c ao longo da gestação na mulher com DM pré-gestacional tem como objetivo avaliar o nível de risco de complicações da gestação e pode servir como auxiliar na verificação da adesão da gestante ao monitoramento da glicose. O monitoramento diário e frequente da glicose é a ferramenta mais adequada para tomada de decisão sobre ajustes da terapia da gestante com DM.
Nota importante 3: HbA1c e desfechos perinatais na mulher com DMG.
- Não está claro o papel da HbA1c como parâmetro do controle glicêmico no diabetes mellitus gestacional (DMG). São ainda necessárias pesquisas para determinar se a medida da HbA1c em diferentes estágios da gravidez pode fornecer informações que orientem a prática clínica e melhorem os desfechos perinatais. Na subanálise do estudo observacional HAPO (Hyperglycemia and Adverse Pregnancy Outcome Study), avaliou-se a HbA1c média medida na 26a semana de gestação em 21.064 gestantes. Após ajuste para a medida de glicose obtida no teste oral de tolerância à glicose (TOTG), a HbA1C não foi associada aos desfechos antropométricos neonatais.19 Em um pequeno estudo que avaliou 148 mulheres com HbA1c ≤ 6% ao diagnóstico de DMG, observou-se que medidas de HbA1c > 5,3%, tanto no diagnóstico quanto no final da gravidez, progressivamente aumentaram o risco de resultados perinatais adversos (hipertensão, bebês GIG e morbidade neonatal).20
Automonitorização da glicemia capilar
O automonitoramento frequente da glicose é ferramenta essencial para atingir controle do DM sem hipoglicemia significativa durante a gravidez. A monitorização da glicose é também utilizada para avaliar a eficácia e a adesão à terapêutica. A decisão de iniciar terapia farmacológica no DMG e os ajustes das doses de insulina na gestante com DM dependem do monitoramento adequado da glicose.
Todos os sistemas de avaliação de glicemia capilar dependem da eficiência do instrumento de medida das glicemias e também das habilidades e adesão das usuárias.21 Portanto, faz-se necessária a orientação inicial do uso de tais aparelhos por profissionais de saúde devidamente treinados para tal, bem como averiguação frequente e durante toda a gravidez de como esses instrumentos estão sendo utilizados.
Diversas condições podem alterar os resultados obtidos nas leituras das glicemias capilares, tais como alterações no hematócrito. Valores muito baixos deste parâmetro, ou seja, hematócrito < 30%, podem superestimar os valores de leitura das glicemias capilares. Já valores muito altos, geralmente acima de 55%, podem subestimar esses dados.22 Esses testes devem ser feitos nos dedos das mãos, não utilizando locais alternativos, uma vez que podem não identificar mudanças rápidas dos níveis de glicemia, o que é característico da gravidez com diabetes.
R6. É RECOMENDADO o automonitoramento diário da glicemia capilar, iniciando logo após o diagnóstico do DMG, devendo ser mantido até o parto. Gestantes em tratamento não farmacológico devem realizar perfil de quatro pontos (em jejum, uma hora após café, uma hora após almoço e uma hora após jantar). Gestantes em tratamento farmacológico devem realizar perfil de seis pontos (em jejum, uma hora após café, antes do almoço, uma hora após almoço, antes do jantar e uma hora após jantar).
| Classe I | Nível B |
- Um estudo prospectivo de mais de 2 mil mulheres com DMG observou que o automonitoramento intensivo (sete medidas) de glicose usando medidores de reflectância baseados na memória utilizados para intensificação do tratamento do DM, comparado com avaliação semanal da glicemia plasmática, foi associado a taxas mais baixas de macrossomia, cesarianas, distocia de ombro, natimortalidade e dias de internação em unidade de terapia intensiva neonatal.23 Outro estudo avaliou 66 pacientes com DMG que fizeram tratamento com insulina antes da 30ª semana. As maiores reduções de HbA1c foram observadas nos grupos com avaliação da glicemia pós-prandial (-3.0 ± 2.2% vs. 0.6 ± 1.6 %), assim como menor peso dos bebês ao nascer (3469 ± 668 vs. 3848 ± 434 g), menores taxas de hipoglicemia (3% vs. 21%), menor ocorrência de crianças GIG (12% vs. 42%) e menores taxas de cesarianas (12% vs. 36%).24
Nota importante 4: Acesso a saúde pública no Brasil.
- Em 2019 foi publicado documento técnico sobre tratamento do DMG no Brasil desenvolvido por equipe de especialistas da Organização Pan-Americana de Saúde/Organização Mundial da Saúde (OPAS/OMS), do Ministério da Saúde, da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO) e da Sociedade Brasileira de Diabetes (SBD). No documento foram consideradas as diferenças de acesso aos serviços de saúde no Brasil com o objetivo de garantir a assistência à mulher com DMG, mesmo em locais com capacidade técnica e financeira parcial. As duas recomendações a seguir contemplam indicações mínimas de monitoramento da glicemia capilar para gestantes com DMG.25
Tabela 1. Frequência do monitoramento da glicose em gestantes com DMG considerando o acesso aos diferentes serviços de saúde no Brasil.26
| Pacientes tratadas com medidas não-farmacológicas | |
|
VIABILIDADE FINANCEIRA E DISPONIBILIDADE TÉCNICA TOTAIS |
VIABILIDADE FINANCEIRA E TÉCNICA PARCIAIS |
|
Perfil diário de 4 pontos: jejum, pós-café, pós-almoço e pós-jantar |
Perfil de 4 pontos 3x por semana: jejum, pós-café, pós-almoço e pós-jantar |
| Pacientes tratadas com medidas farmacológicas | |
|
Perfil diário de 6 pontos: jejum, pós-café, antes do almoço, pós-almoço, antes do jantar e pós-jantar |
Perfil diário de 4 pontos 3x por semana: jejum, pós-café, pós-almoço e pós-jantar |
R7. É RECOMENDADA a automonitorização da glicemia capilar antes e uma hora após as três principais refeições, ao deitar-se e, esporadicamente, entre 2h e 4h da manhã em mulheres com DM pré-gestacional.
| Classe I | Nível C |
- A monitorização de glicemias pós-prandiais está associada ao melhor controle glicêmico na gestação e menor risco de pré-eclâmpsia. Um estudo que incluiu 61 pacientes na 16ª semana de gestação encontrou que a avaliação da glicemia pós-prandial, comparada com a pré-prandial, mostrou maior redução na incidência de pré-eclâmpsia (3% vs. 21%) e maiores taxas de glicemia na meta (55% vs. 30%) e na prole menor espessura da prega subcutânea tricipital (4,5 ± 0,9 vs. 5.1 ± 113).26
- Uma revisão sistemática que incluiu 944 gestantes com DM pré-gestacional concluiu que não há ensaios clínicos randomizados com poder de comparar diferentes frequências de automonitorização da glicemia capilar e desfechos gestacionais.27 Não foram identificados estudos sobre a eficácia clínica ou sobre o custo do aumento da frequência de testes de glicemia capilar em gestantes com DM.28 Entretanto, considera-se que a realização frequente da automonitorização da glicemia capilar seja essencial para alcance de melhor controle glicêmico com menor risco de hipoglicemia.22
Nota importante 5: Glicemia pós-prandial
- Embora a medida da glicemia uma hora pós-alimentar detecte mais adequadamente o horário do pico pós-prandial, a medida da glicemia duas horas após a alimentação é uma alternativa útil à medida de uma hora, principalmente no monitoramento de gestantes em uso de insulina humana regular.
R8. É RECOMENDADO que gestantes com DM ou DMG tenham como meta, valores de glicemia pré-prandiais entre 65-95 mg/dL, 1h pós-prandial < 140 mg/dL e 2h pós-prandial < 120 mg/dL. Em mulheres com risco aumentado de hipoglicemia, estes alvos devem ser aumentados para glicemias de jejum de 70-99 mg/dL e glicemias ao deitar, e entre 2-4h da madrugada, entre 80-120 mg/dL. (Quadro 3)
| Classe I | Nível C |
- Não há ensaios clínicos randomizados com poder para comparar diferentes alvos de glicemias capilares de jejum ou pós-prandiais.
- Uma metanálise que incluiu 9.433 gestantes com diabetes sugere que um alvo de glicemia de jejum de até 90 mg/dL no terceiro trimestre seria relacionado com menor chance de bebês com macrossomia em mulheres com DMG [OR: 0,53 (IC 95% 0,31 a 0,90) p = 0,02]. Entretanto, medidas pós-alimentares não mostraram associação. Os autores relatam que os dados avaliados foram muito heterogêneos, sugerindo baixa confiabilidade.29
Tabela 2. Alvos de glicemia capilar durante a gestação de mulheres com DM
| Tempo do teste | Nível glicêmico |
| Jejum | >65 e <95mg/dL |
| 1h depois das refeições | <140mg/dL |
| 2h depois das refeições | <120mg/dL |
Monitorização contínua da glicose (CGM) na gestação
O monitoramento contínuo de glicose (CGM) em tempo real fornece dados das variações da glicose que ocorrem ao longo das 24h do dia, permitindo a identificação não apenas de níveis momentâneos de glicose, mas também sua resposta a diversas situações da rotina da gestante, como alimentação, exercício, estresse, sono e uso da insulina. Além de permitir que sejam visualizadas as frequentes flutuações da glicose, o CGM fornece dados que podem orientar decisões terapêuticas.30
Os sensores do CGM medem a glicose no tecido intersticial subcutâneo e permitem que seja feita a visualização da medida em tempo real com o uso de leitores próprios, programas específicos de computadores e aplicativos para smartphone. A leitura da glicose pode ocorrer de forma contínua (Real time continuous glucose monitoring – rt-CGM) ou intermitente (Intermittently scanned continuous glucose monitoring – is-CGM). O rt-CGM é calibrado pela glicemia obtida de sangue capilar e pode fornecer diretamente os resultados da glicose para o sistema de infusão contínua de insulina (SICI). O is-CGM vem com calibração de fábrica e é aprovado no Brasil para uso na gestação.31
Tem sido observado número crescente de mulheres com DM1 que usam dispositivos de monitoramento contínuo da glicose (CGM) em tempo real antes e durante a gestação.32 Portanto, há necessidade de conhecimento do método e educação da equipe de saúde, da paciente e familiares para o uso adequado dessa ferramenta na gravidez.
Em janeiro de 2021 foi publicado posicionamento oficial da Sociedade Brasileira de Diabetes (SBD) sobre uso do CGM na gestação com o objetivo de trazer informações para uso adequado dessa ferramenta na gestante com DM.
R9. É RECOMENDADO a indicação de rt-CGM ou is-CGM em gestantes com DM1, com ou sem SICI, com o objetivo de evitar hipoglicemia materna e neonatal, bebês GIG, internações em UTI neonatal e tempo prolongado de hospitalização após parto.
| Classe I | Nível B |
- O estudo CONCEPTT (Continuous Glucose Monitoring in Pregnant Women with Type 1 Diabetes Trial) avaliou o uso do rt-CGM (iPro2 Professional CGM/Medtronic) em 325 mulheres com DM1 (215 grávidas e 110 planejando gestação). Observou-se pequena redução na HbA1c das gestantes em uso de rt-CGM em relação às gestantes com monitoramento convencional da glicose capilar [diferença média: −0,19% (IC 95% -0,34 a -0,03 p = 0,020)]. As gestantes em uso de rt-CGM passaram maior tempo dentro do alvo da glicose (68 vs. 61%, p = 0,0034) e tiveram menos episódios de hipoglicemia (27 vs. 32%, p = 0,0279). Observou-se ainda melhora significativa dos desfechos fetais, como redução de bebês GIG [OR: 0,51 (IC 95% 0,28 a 0,90) p = 0,0210)]; de internações em UTI neonatal [OR: 0,48 (IC 95% 0,26 a 0,86 p = 0,0157)]; de hipoglicemia neonatal [OR: 0,45 (IC 95% 0,22 a 0,89 p = 0·,250)]; e menor tempo de hospitalização após o parto (p = 0,0091). No estudo, foram incluídas proporções semelhantes de mulheres em uso de SICI ou tratamento com múltiplas injeções diárias. Os benefícios foram semelhantes nos dois grupos.33
- Uma metanálise que incluiu o estudo mencionado na alínea anterior e comparou diversos métodos de avaliação de controle glicêmico e seus impactos materno-fetais em gestantes com DM preexistente encontrou que o monitoramento contínuo vs. glicemia capilar sete vezes ao dia reduziu a incidência de hipertensão durante a gravidez [RR: 0,58 (IC 95% 0,39 a 0.85)] em dois estudos com 384 mulheres. Entretanto, em razão de evidências de baixa qualidade, os autores concluíram que ainda não se pode afirmar que uma técnica de monitoramento de glicose seja superior a qualquer outra em mulheres grávidas com DM preexistente em relação aos desfechos fetais.27
R10. DEVE SER CONSIDERADA a indicação de CGM para gestantes em uso de insulina que apresentem grande variabilidade glicêmica ou risco de hipoglicemia sem aviso.
| Classe IIa | Nível C |
- O uso de CGM está associado à redução do risco de hipoglicemia e da variabilidade glicêmica em pessoas com DM1 fora da gestação.34 Embora não existam dados robustos sobre o efeito do CGM sobre essas variáveis durante a gestação, considera-se que o uso de CGM para gestantes em uso de insulina com dificuldade de controle glicêmico pode auxiliar na adequação do tratamento e reduzir o risco de hipoglicemia grave.
- A experiência clínica mostra que gestantes com orientação do médico especialista podem se beneficiar do uso deste recurso. A educação é parte fundamental do tratamento do DM, e o CGM tem potencial de auxiliar no processo educativo, pela visualização das variações do perfil diário da glicose segundo a influência de seus múltiplos determinantes, de detectar anormalidades não aparentes na monitorização capilar e de subsidiar a realização dos ajustes terapêuticos.
R11. É RECOMENDADO que a gestante com DM1, fazendo uso de CGM, além do alcance de valores da glicemia capilar pré e pós-prandiais já estabelecidos, tenha como meta manter-se 70% do tempo avaliado (7 a 14 dias) dentro do alvo (TIR) de 63 a 140 mg/dL, 25% acima do alvo e < 4% abaixo de 63 mg/dL, sendo < 1% abaixo de 54 mg/dL (Figura 1).
| Classe I | Nível B |
- Consenso internacional sobre uso das métricas fornecidas pelo CGM definiu os limites de glicose durante a gestação. O painel de especialistas recomendou que, no período gestacional, o CGM deva ser necessariamente associado ao monitoramento da glicemia capilar, tanto pré quanto pós-prandial.35
- O estudo randomizado e controlado CONCEPTT em mulheres com DM1 em uso de rt-CGM, mostrou que gestantes em uso de rt-CGM por 14 dias, mantiveram-se 68% de seu tempo dentro da faixa de 63-140 mg/dl, em comparação ao grupo controle, que atingiu 61%, um adicional de 1,7 h/dia na meta. O percentual de tempo acima da meta (140 mg/dL) foi menor nas gestantes em uso de rt-CGM (27% versus 32%), equivalente a aproximadamente uma hora a menos por dia com hiperglicemia. Não houve diferença entre os grupos em valores de glicose abaixo de 63 mg/dl ou episódios de hipoglicemia. Um maior percentual de medidas entre 63-140 mg/dL associou-se a menor risco de bebês GIG [OR: 0,51 (IC 95% 0,28 a 0, 90 p = 0,0210)], menos admissões em UTI neonatal [OR: 0,48 (IC 95% 0,26 a 0,86 p = 0,0157)] e menor incidência de hipoglicemia neonatal [OR: 0,45 (IC 95% 0,22 a 0,89 p = 0,0250)].33
- Um estudo observacional avaliou 186 gestações em mulheres com DM1 com dois tipos de dispositivos de CGM em tempo real (rtCGM Dexcom G4) e o sistema intermitente Free Style Libre-Abbott. Níveis médios elevados de glicose no segundo e no terceiro trimestres foram significativamente associados com bebês GIG [OR: 1,53 (IC 95% 1,12 a 2,08)] e [OR: 1,57 (IC 95% 1,12 a 2,19)], respectivamente. A maior porcentagem de tempo dentro da meta no segundo e no terceiro trimestres foi associada ao menor risco de GIG [OR: 0,96 (IC 95% 0,94 a 0,99)] e [OR: 0,97 (IC 95% 0,95 a 1,00)], respectivamente. As mesmas associações foram encontradas para o tempo na meta e o risco de internação em UTI neonatal em todos os trimestres. Os padrões de glicose não diferiram entre as usuárias de rt-CGM e is-CGM, exceto que gestantes com rt-CGM passaram menos tempo abaixo da meta. Os autores concluíram que ambos os métodos de CGM melhoraram o tempo nas metas de controle entre 63-140 mg/dl, com menores desfechos adversos para o concepto.36
Figura 1. Metas de tempo no alvo (TIR) em gestantes com DM1.35
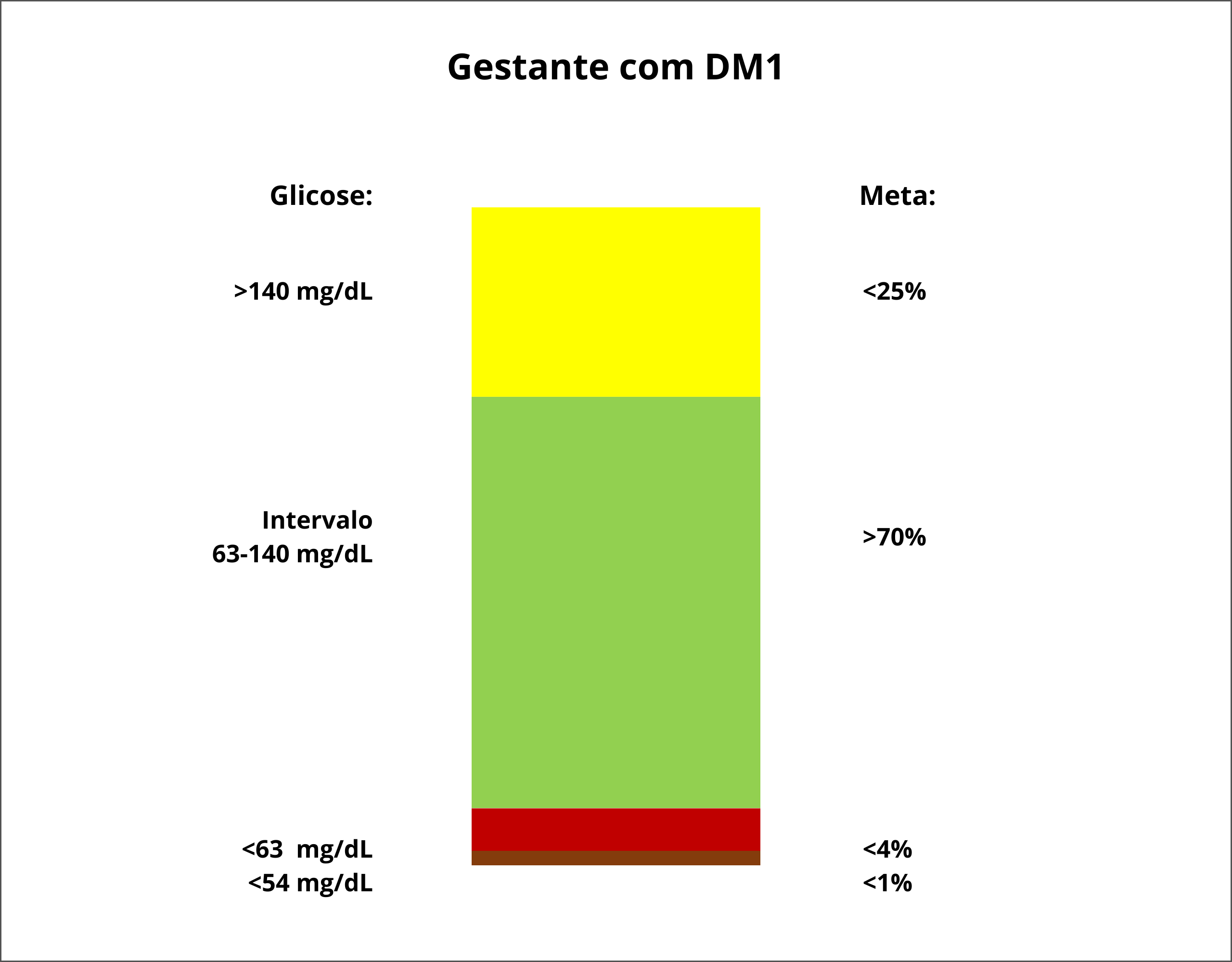
R12. DEVE SER CONSIDERADO que as métricas obtidas pelo CGM durante a gestação complementam mas não substituem o monitoramento da glicemia capilar.
| Classe IIa | Nível C |
- O método mais usado para avaliar a acurácia dos CGM é o cálculo da diferença relativa absoluta da média ou MARD (Mean Absolute Relative Difference). O MARD quantifica o percentual de concordância entre as leituras do CGM e os resultados da medição da glicemia capilar. O Sistema Flash de monitorização contínua, diferentemente do rt-CGM, já é disponibilizado com calibração da fábrica.
- Com o objetivo de avaliar a acurácia do sistema Flash durante a gestação, foi realizado um estudo com 74 participantes, sendo 24 com DM1, 11 com DM2 e 39 com DMG; delas, 66,2% usaram insulina para controlar o diabetes. Os sensores foram usados por até 14 dias e os valores de glicose do sensor (mascarados) foram comparados com os valores de glicemias capilares (feitos pelo menos quatro vezes ao dia, sendo três vezes pré-prandiais). O MARD encontrado foi de 11,8% e a precisão do sensor não foi afetada pelo tipo de diabetes, pela fase da gestação, pelo uso de insulina, pela idade ou pelo IMC maternos. Não foram informados resultados de desfechos gestacionais. Os autores concluíram que há boa concordância entre o Sistema Free Style Libre e as glicemias capilares.37
- Comparados com a glicemia capilar, os resultados obtidos com as leituras feitas através do is-CGM (Free Style Libre-Abbott) em 33 gestantes com DM revelaram MARD de 19%, com 99% dos pares de valores de glicose dentro das zonas A e B clinicamente aceitáveis da grade de erro de Parkes. Apesar da acurácia, a taxa de concordância para a tomada de decisão terapêutica foi de 80% a 85%. Em diferentes momentos do dia, 83% a 92% dos resultados discordantes foram devidos aos valores is-CGM menores do que da glicemia capilar. Os resultados foram mais baixos e divergentes em cerca de 25% a 35% das vezes.38
- A diferença no intervalo de tempo entre a glicose no sangue e a glicose intersticial pode resultar em atraso no aumento da glicose do interstício em relação à glicose sanguínea. Assim, o uso apenas das leituras de glicose intersticial para decisões terapêuticas, pode resultar em risco adicional de hipoglicemia.39
Nota importante 6: Calibração do rt-CGM
- Para melhorar a acurácia desta métrica, a calibração do rt-CGM não deve ser realizada em momentos de maior variação glicêmica.40
R13. É RECOMENDADO orientar as gestantes em uso de is-CGM que, na presença de valores menores, de 70 mg/dL, a glicemia deve ser confirmada em sangue capilar.
| Classe I | Nível B |
- O is-CGM pode medir valores de glicose mais baixos, principalmente durante a noite. Estudo prospectivo que comparou rt-CGM (Envision Pro/ Medtronic) com is-CGM (Freestyle Libre-Abbott) usados simultaneamente na mesma gestante com DM1 no primeiro trimestre de gestação encontrou diferença significativa nas medidas abaixo da meta de 63 mg/dL obtidas pelo is-CGM durante o período noturno. Com o uso do is-CGM, o tempo abaixo de 63 mg/dL foi de 6,5% (0,4 – 16,7) vs. 0% (0,0 – 0,8) com rt-CGM, p = 0,003; e o tempo dentro da meta (63 mg/dL a 140 mg/dL) foi de 55,4% (41,1 – 81,0) vs. 68,8% (52,4 – 80,3), p = 0,005. Além disso, 75% vs. 40% das mulheres tinham pelo menos uma leitura de glicose < 63 mg/dL. Os autores concluíram que os ajustes terapêuticos, como redução da dose de insulina e/ou aumento da ingestão de carboidratos em razão da hipoglicemia medida no is-CGM somente devem ser feitos após confirmação desses episódios por meio da medição da glicemia capilar.41
R14. É RECOMENDADO orientar as gestantes com DM1 que estão em uso de CGM, com ou sem SICI acoplada, para a necessidade de fazer medições frequentes e uso contínuo da ferramenta para alcançar melhores desfechos perinatais.
| Classe I | Nível C |
- Um estudo randomizado controlado que incluiu 123 gestantes com DM1 e 31 gestantes com DM2 comparou o uso de rt-CGM (Guardian Real-time e Soft-Sensor Medtronic Minimed) por seis dias na 8a, 12a, 21a, 27a e 33a semanas de idade gestacional com o monitoramento da glicemia capilar diariamente sete vezes ao dia sem CGM. Não houve diferença entre os grupos na 33a semana na medida da HbA1c [6,1 (5,1 – 7,8) vs. 6,1% (4,8 – 8,2)]; p = 0,39), na incidência de hipoglicemia materna grave (16 vs. 16%; p = 0,91), na prevalência de bebês GIG (45% vs. 34%; p = 0,19) e nos diversos outros resultados perinatais avaliados. Os autores concluíram que o uso intermitente de rt-CGM na gravidez, além da automonitorização da glicose capilar sete vezes ao dia, não foi superior ao monitoramento apenas da glicose capilar no controle glicêmico e nos desfechos perinatais.42
Nota importante 7: Uso do CGM na gestante com DMG
- O CGM tem sido estudado no DMG, porém até o momento não existe evidência do seu benefício para evitar as complicações decorrentes da hiperglicemia na gestação. Uma revisão sistemática de 29 artigos prospectivos observacionais (3 RCT, 1 crossover e 25 coortes, sendo 20 com uso do Minimed 72h e um com Freestyle Flash-Abbott), concluiu que o uso de CGM foi melhor aceito que a automonitorização com glicemia capilar, mais efetivo em detectar hipoglicemia, hiperglicemia e variabilidade glicêmica aumentada em gestantes com diabetes prévio ou DMG. Em relação ao efeito do tratamento na mulher com DMG, o CGM levou ao uso mais frequente de insulina, melhor controle glicêmico e menor ganho de peso. Porém a maioria dos estudos mostraram resultados inconclusivos em relação ao uso do CGM para melhorar os desfechos maternos e fetais.43
Nota importante 8: CGM na gestante com DM2.
- Existem poucos dados do uso de CGM em gestantes com DM2. Um estudo demonstrou que gestantes com DM2 ficam um terço do tempo com menos hiperglicemia do que as que têm DM1 e atingem 90% do tempo no alvo glicêmico.44 Pela falta de estudos nas pacientes gestantes com DM2, não se incluiu sugestão de tempo no alvo no consenso internacional para este grupo de pacientes.35
Nota importante 9: Custo efetividade do CGM na gestação
- Não existe estudo nacional de custo-efetividade com o uso de CGM por gestante com DM. Entretanto, em análise post hoc de dados do estudo CONCEPTT, em três províncias canadenses, a diferença entre os grupos no custo médio total de cuidados da mãe e da prole, desde a randomização até a alta hospitalar, foi menor no grupo que usou e pagou pelo rt-CGM, em comparação com o grupo que realizou apenas a monitorização da glicemia capilar. Esta redução ocorreu principalmente em razão do menor uso da unidade de terapia intensiva neonatal no grupo CGM. Quando os governos pagam pelo CGM, não há diferença de custo geral entre CGM e automonitoramento da glicemia capilar. Portanto, além de reduzir os danos individuais associados à internação em UTI neonatal, para o sistema de saúde canadense, o uso de rt-CGM pela gestante com DM1 foi custo-efetivo.45
Tabela de Recomendações
| RECOMENDAÇÃO | CLASSE | NÍVEL |
| R1 - É RECOMENDADO aconselhar mulheres com DM para que planejem a gestação e orientá-las sobre a importância dos cuidados pré-concepcionais, com o objetivo de alcançar melhores desfechos perinatais. | I | A |
| R2 - DEVE SER CONSIDERADO o nível ideal de HbA1c de 6,0% para engravidar, se utilizado o método de cromatografia líquida de alta eficiência (high performance liquid chromatography – HPLC). Em casos de inviabilidade do método HPLC, o nível de HbA1c deve estar o mais próximo possível de valores normais, sem a ocorrência de hipoglicemias. | IIa | B |
| R3 - É RECOMENDADO aconselhar mulheres com HbA1c acima de 9% para evitarem a gravidez até que alcancem melhor controle glicêmico. | I | B |
| R4 - É RECOMENDADO para a mulher com DM pré-gestacional que a HbA1c seja medida na primeira consulta pré-natal. | I | B |
| R5 - Com o objetivo de avaliar o risco de complicações e adesão ao monitoramento, PODE SER CONSIDERADO que a HbA1c seja medida mensalmente na mulher com DM pré-gestacional, até que valores < 6% sejam atingidos, quando então poderá ser avaliada a cada dois ou três meses. | IIb | B |
| R6 - É RECOMENDADO o automonitoramento da glicemia capilar diariamente, iniciando logo após o diagnóstico do DMG, devendo ser mantido até o parto. Gestantes em tratamento não farmacológico devem realizar perfil de quatro pontos (em jejum, uma hora após café, uma hora após almoço e uma hora após jantar). Gestantes em tratamento farmacológico devem realizar perfil de seis pontos (em jejum, uma hora após café, antes do almoço, uma hora após almoço, antes do jantar e uma hora após jantar). | I | B |
| R7 - É RECOMENDADA a automonitorização da glicemia capilar antes e uma hora após as três principais refeições, ao deitar-se e, esporadicamente, entre 2h e 4h da manhã em mulheres com DM pré-gestacional. | I | C |
| R8 - É RECOMENDADO que gestantes com DM ou DMG tenham como meta, valores de glicemia pré-prandiais entre 65-95 mg/dL, 1h pós-prandial < 140 mg/dL e 2h pós-prandial < 120 mg/dL. Em mulheres com risco aumentado de hipoglicemia, estes alvos devem ser aumentados para glicemias de jejum de 70-99 mg/dL e glicemias ao deitar, e entre 2-4h da madrugada, entre 80-120 mg/dL. | I | C |
| R9 - É RECOMENDADA a indicação de rt-CGM ou is-CGM em gestantes com DM1, com ou sem SICI, com o objetivo de evitar hipoglicemia materna e neonatal, bebês GIG, internações em UTI neonatal e tempo prolongado de hospitalização após parto. | I | B |
| R10 - DEVE SER CONSIDERADA a indicação de CGM para gestantes em uso de insulina que apresentem grande variabilidade glicêmica ou risco de hipoglicemia sem aviso. | IIa | C |
| R11 - É RECOMENDADO que a gestante com DM1, fazendo uso de CGM, além do alcance de valores da glicemia capilar pré e pós-prandiais já estabelecidos, tenha como meta manter-se 70% do tempo avaliado (7 a 14 dias) dentro do alvo (TIR) de 63 a 140 mg/dL, 25% acima do alvo e < 4% abaixo de 63 mg/dL, sendo < 1% abaixo de 54 mg/dL | I | B |
| R12 - DEVE SER CONSIDERADO que as métricas obtidas pelo CGM durante a gestação complementam mas não substituem o monitoramento da glicemia capilar. | IIa | C |
| R13 - É RECOMENDADO orientar as gestantes em uso de is-CGM que valores menores de 70 mg/dL sejam confirmados pelo monitoramento da glicemia obtida em sangue capilar | I | B |
| R14 - É RECOMENDADO orientar as gestantes com DM1 que estão em uso de CGM, com ou sem SICI acoplada, para a necessidade de fazer medições frequentes e uso contínuo da ferramenta para alcançar melhores desfechos perinatais. | I | C |
Referências
- Wahabi HA, Fayed A, Esmaeil S, et al. Systematic review and meta-analysis of the effectiveness of pre-pregnancy care for women with diabetes for improving maternal and perinatal outcomes. Vol. 15.; 2020. doi: 10.1371/journal.pone.0237571.
- Wahabi HA, Alzeidan RA, Esmaeil SA. Pre-pregnancy care for women with pre-gestational diabetes mellitus: a systematic review and meta-analysis. BMC Public Health. 2012;12(1):792. doi: 10.1186/1471-2458-12-792.
- Żurawska-Kliś M, Kosiński M, Kuchnicka A, Rurka M, Hałucha J, Wójcik M CK. Continuous subcutaneous insulin infusion does not correspond with pregnancy outcomes despite better glycemic control as compared to multiple daily injections in type 1 diabetes – significance of pregnancy planning and pre pregnancy HbA1c. Diabetes Res Clin Pr. 2021;172:108628.
- American Diabetes Association. Management of diabetes in pregnancy: standards of medical care in diabetes—2021. Diabetes Care. 2021;44(suppl 1):S200-S210.
- Chen L, Yang T, Chen L, et al. Risk of congenital heart defects in offspring exposed to maternal diabetes mellitus: an updated systematic review and meta-analysis. Arch Gynecol Obstet. 2019;300(6):1491-1506. doi: 10.1007/s00404-019-05376-6.
- Jensen DM, Korsholm L, Ovesen P, et al. Peri-conceptional A1C and risk of serious adverse pregnancy outcome in 933 women with type 1 diabetes. Diabetes Care. 2009;32(6):1046-48. doi: 10.2337/dc08-2061.
- Mills JL, Baker L GA. Malformations in infants of diabetic mothers occur before the seventh gestational week. Implications for treatment. Diabetes. 1979;28(4):292-3.
- Ludvigsson JF, Neovius M, Söderling J, Gudbjörnsdottir S, Svensson AM FS et al. Periconception glycaemic control in women with type 1 diabetes and risk of major birth defects: population based cohort study in Sweden. BMJ. 2018;362:k2638.
- Ludvigsson JF, Neovius M, Soderling J, Gudbjornsdottit S, Svensson AM, Franzen S, et al. Maternal glycemic control in type 1 diabetes and the risk for preterm birth: a population-based cohort study. Ann Intern Med. 2019;170(10):691-701.
- Temple R, Aldridge V, Greenwood R, Heyburn P, Sampson M, Stanley K. Association between outcome of pregnancy and glycaemic control in early pregnancy in type 1 diabetes: Population based study. Br Med J. 2002;325(7375):1275-6. doi: 10.1136/bmj.325.7375.1275.
- Nielsen GL, Møller M, Sørensen HT. HbA1c in early diabetic pregnancy and pregnancy outcomes: a danish population-based cohort study of 573 pregnancies in women with type 1 diabetes. Diabetes Care. 2006;29(12):2612-6. doi: 10.2337/dc06-0914.
- Law GR, Gilthorpe MS, Secher AL, et al. Translating HbA1c measurements into estimated average glucose values in pregnant women with diabetes. Diabetologia. 2017;60(4):618-24. doi: 10.1007/s00125-017-4205-7.
- Rafat D, Rabbani TK, Ahmad J, Ansari MA. Influence of iron metabolism indices on HbA1c in non-diabetic pregnant women with and without iron-deficiency anemia: effect of iron supplementation. Diabetes Metab Syndr. 2012;6(2):102-5. doi: 10.1016/j.dsx.2012.05.011.
- Hughes RC, Rowan J, Florkowski CM. Is there a role for HbA1c in pregnancy? Curr Diab Rep. 2016 Jan;16(1):5. doi: 10.1007/s11892-015-0698-y. PMID: 26739347.
- Damm P, Mersebach H, Råstam J, et al. Poor pregnancy outcome in women with type 1 diabetes is predicted by elevated HbA1c and spikes of high glucose values in the third trimester. J Matern Neonatal Med. 2014;27(2):149-54. doi: 10.3109/14767058.2013.806896.
- Davidson AJF, Park AL, Berger H, Aoyama K, Harel Z, Cohen E, et al. Association of improved periconception hemoglobin A1c with pregnancy outcomes in women with diabetes. JAMA Netw Open. 2020 Dec 1;3(12):e2030207. doi: 10.1001/jamanetworkopen.2020.30207. PMID: 33355674; PMCID: PMC7758806.
- Cavero-Redondo I, Martínez-Vizcaíno V, Soriano-Cano A, Martínez-Hortelano JA, Sanabria-Martínez G, Álvarez-Bueno C. Glycated haemoglobin A1c as a predictor of preeclampsia in type 1 diabetic pregnant women: a systematic review and meta-analysis. Pregnancy Hypertens. 2018 Oct;14:49-54. doi: 10.1016/j.preghy.2018.04.004. Epub 2018 Apr 7. PMID: 30527118.
- Maresh AMJA, Holmes VA, Patterson CC, et al. Glycemic targets in the second and third trimester of pregnancy for women with type 1 diabetes. Diabetes Care. 2015;38(1):34-42.
- Lowe LP, Metzger BE, Dyer AR, Lowe J, McCance DR, Lappin TR, et al. HAPO Study Cooperative Research Group. Hyperglycemia and adverse pregnancy outcome (HAPO) study: associations of maternal A1C and glucose with pregnancy outcomes. Diabetes Care. 2012 Mar;35(3):574-80. doi: 10.2337/dc11-1687. Epub 2012 Feb 1. PMID: 22301123; PMCID: PMC3322718.
- Capula C, Mazza T, Vero R, Costante G. HbA1c levels in patients with gestational diabetes mellitus: relationship with pre-pregnancy BMI and pregnancy outcome. J Endocrinol Invest. 2013;36(11):1038-45. doi: 10.3275/9037.
- Cosson E, Baz B, Gary F, Pharisien I, Nguyen MT, Sandre-Banon D, et al. Poor reliability and poor adherence to self-monitoring of blood glucose are common in women with gestational diabetes mellitus and may be associated with poor pregnancy outcomes. Diabetes Care. 2017 Sep;40(9):1181-6. doi: 10.2337/dc17-0369. Epub 2017 Jul 19. PMID: 28724718.
- Negrato CA, Zajdenverg L. Self-monitoring of blood glucose during pregnancy: Indications and limitations. Diabetol Metab Syndr. 2012;4(1):54. doi: 10.1186/1758-5996-4-54.
- Langer O, Rodriguez DA, Xenakis EM, McFarland MB, Berkus MD, Arrendondo F. Intensified versus conventional management of gestational diabetes. Am J Obstet Gynecol. 1994 Apr;170(4):1036-46; discussion 1046-7. doi: 10.1016/s0002-9378(94)70097-4. PMID: 8166187.]
- de Veciana M, Major CA, Morgan MA, Asrat T, Toohey JS, Lien JM, Evans AT. Postprandial versus preprandial blood glucose monitoring in women with gestational diabetes mellitus requiring insulin therapy. N Engl J Med. 1995 Nov 9;333(19):1237-41. doi: 10.1056/NEJM199511093331901. PMID: 7565999.
- Organização Pan-Americana da Saúde. Ministério da Saúde. Federação Brasileira das Associações de Ginecologia e Obstetrícia. Sociedade Brasileira de Diabetes. Rastreamento e diagnóstico de diabetes mellitus gestacional no Brasil [Internet]. Vol. 1. Sociedade Brasileira de Diabetes. Brasília: 2017. 1–36. Disponível em: https://www.diabetes.org.br/profissionais/images/pdf/diabetes-gestacional-relatorio.pdf%0Ahttps://www.diabetes.org.br/profissionais/images/pdf/diabetes-gestacional-relatorio.pdf
- Manderson JG, Patterson CC, Hadden DR, Traub AI, Ennis C MD. Preprandial versus postprandial blood glucose monitoring in type 1 diabetic pregnancy: a randomized controlled clinical trial. Am J Obs Gynecol. 2003;189(2):1237-41.
- Jones LV, Ray A, Moy FM, Buckley BS. Techniques of monitoring blood glucose during pregnancy for women with pre-existing diabetes. Cochrane Database Syst Rev. 2019;2019(5). doi: 10.1002/14651858.CD009613.pub4.
- Tran KPL. Increasing frequency of self-monitoring blood glucose test strips during pregnancy: a review of the clinical and cost-effectiveness and guidelines. Can Agency Drugs Technol Heal. 2017;Apr 4.
- Prutsky GJ, Domecq JP, Wang Z, et al. Glucose targets in pregnant women with diabetes: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2013;98(11):4319-24. doi: 10.1210/jc.2013-2461.
- Rodbard D. Continuous glucose monitoring: a review of recent studies demonstrating improved glycemic outcomes. Diabetes Technol Ther. 2017;19:S25-S37. doi: 10.1089/dia.2017.0035.
- Brasil. Ministério da Saúde; Anvisa/Resolução 3.170, de20 de agosto de 2020. Freestyle libre sist. flash de monitor. de glicose. Diário Oficial da União: seção 1 Brasília, 2007;162(1):112.
- Polsky S, Wu M, Bode BW, et al. Diabetes Technology use among pregnant and nonpregnant women with T1D in the T1D exchange. Diabetes Technol Ther. 2018;20(8):517-23. doi: 10.1089/dia.2018.0033.
- Feig DS, Donovan LE, Corcoy R, Murphy KE, Amiel SA, Hunt KF, et al.; CONCEPTT Collaborative Group. Continuous glucose monitoring in pregnant women with type 1 diabetes (CONCEPTT): a multicentre international randomised controlled trial. Lancet. 2017 Nov 25;390(10110):2347-59. doi: 10.1016/S0140-6736(17)32400-5. Epub 2017 Sep 15.
- Maiorino MI, Signoriello S, Maio A, et al. Effects of continuous glucose monitoring metrics glycemic control in diabetes: a systematic review with meta-analysis of randomized controlled trials. Diabetes Care. 2020;43(5):1146-56. doi: 10.2337/dc19-1459.
- Battelino T, Danne T, Bergenstal RM, et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care. 2019;42(8):1593-603. doi: 10.2337/dci19-0028.
- Kristensen K, Ögge LE, Sengpiel V, et al. Continuous glucose monitoring in pregnant women with type 1 diabetes: an observational cohort study of 186 pregnancies. Diabetologia. 2019;62(7):1143-53. doi: 10.1007/s00125-019-4850-0.
- Scott EM, Bs BM, Bilous FRW, Kautzky-willer A. Accuracy, user acceptability, and safety evaluation for the FreeStyle Libre Flash Glucose Monitoring System when used by pregnant women with diabetes. Diabetes Res Clin Pract. 2018;20(3):180-8. doi: 10.1089/dia.2017.0386.
- Sola-Gazagnes A, Faucher P, Jacqueminet S, Ciangura C, Dubois-Laforgue D, Mosnier-Pudar H, et al. Disagreement between capillary blood glucose and flash glucose monitoring sensor can lead to inadequate treatment adjustments during pregnancy. Diabetes Metab. 2020;46(2):158-63.
- Ajjan RA, Cummings MH, Jennings P, Leelarathna L, Rayman G, Wilmot EG. Accuracy of flash glucose monitoring and continuous glucose monitoring technologies: Implications for clinical practice. Diabetes Vasc Dis Res. 2018;15(3):175-84. doi: 10.1177/1479164118756240.
- Mamkin I, Ten S, Bhandari S, Ramchandani N. Real-time continuous glucose monitoring in the clinical setting: the good, the bad, and the practical. J Diabetes Sci Technol. 2008;2(5):882-9. doi: 10.1177/193229680800200520.
- Norgaard SK, Mathiesen ER, Nørgaard K RL. Comparison of glycemic metrics measured simultaneously by intermittently scanned continuous glucose monitoring and real-time continuous glucose monitoring in pregnant women with type 1 diabetes. Diabetes Technol Ther. 2021 Jun 25. doi: 10.1089/dia.2021.0109.
- Secher AL, Ringholm L, Andersen HU, Damm P, Mathiesen ER. The effect of real-time continuous glucose monitoring in pregnant women with diabetes; a randomized controlled trial. Diabetes Care. 2013;36(7):1877-83. doi: 10.2337/dc12-2360.
- Yu Q, Aris IM, Tan KH, Li LJ. Application and utility of continuous glucose monitoring in pregnancy: a systematic review. Front Endocrinol (Lausanne). 2019 Oct. doi: 10.3389/fendo.2019.00697.
- Murphy HR, Rayman G, Duffield K, Lewis KS, Kelly S, Johal B, et al.. Changes in the glycemic profiles of women with type 1 and type 2 diabetes during pregnancy. Diabetes Care. 2007 Nov;30(11):2785-91. doi: 10.2337/dc07-0500. Epub 2007 Jul 31. PMID: 17666464.45.
- Ahmed RJ, Gafni A, Hutton EK, et al. The cost implications of continuous glucose monitoring in pregnant women with type 1 diabetes in 3 Canadian provinces: a posthoc cost analysis of the CONCEPTT trial. C Open. 2021;9(2):E627-E634. doi: 10.9778/cmajo.20200128.
Cite este artigo
Zajdenverg L, Façanha C, Dualib P, Goldbert A, Negrato C, Bertoluci M. Planejamento, metas e monitorização do diabetes durante a gestação. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/557753.2022-12, ISBN: 978-85-5722-906-8.

