Autores: Karla F S de Melo, Bianca de Almeida-Pititto e Hermelinda Cordeiro Pedrosa.
Editor Chefe: Marcello Bertoluci
Última revisão em: 12/04/2023
DOI: 10.29327/5238993.2023-12 | Cite este Artigo
Introdução
No dia 12 de novembro de 2019 foi publicada a Portaria Conjunta SAES/SCTIE nº 17, o Protocolo Clínico e Diretrizes Terapêuticas do Diabetes Mellitus Tipo 1 (PCDT DM1) para o seguimento e tratamento de pessoas com diabetes tipo 1 (DM1) no SUS, após a inclusão dos análogos de insulina de ação prolongada (1). O PCDT DM1 foi publicado recentemente, em sua forma completa e resumida.1,2 A Sociedade Brasileira de Diabetes atuou como colaboradora externa e trabalhou em conjunto com o grupo elaborador do PCDT DM1 do DGITS/MS.
O DM1 caracteriza-se pela destruição das células β do pâncreas, determinando deficiência na secreção de insulina, o que torna essencial o uso desse hormônio como tratamento e para prevenir eventos micro e macrovasculares, cetoacidose, coma e morte. Estima-se que no Brasil há aproximadamente 564.249 pessoas com DM1, sendo 109.827 com idades inferiores a 20 anos e 454.070 com mais de 20 anos de idade, deixando o Brasil em terceira colocação entre os países com mais pessoas com diagnóstico de DM13. Dados publicados pelo Grupo Brasileiro de Estudos sobre DM1 mostraram controle glicêmico adequado, baseado na meta de HbA1c, em menos de 13% das pessoas com DM1, atendidas em serviços de atendimento secundário ou terciário.4
O diagnóstico em seu estágio inicial e o encaminhamento ágil e adequado para o atendimento especializado dão à atenção primária um caráter essencial para um melhor resultado terapêutico e prognóstico. Além disso, a Atenção Primária de Saúde (APS) deve integrar a Rede de Atenção à Saúde, como a unidade ordenadora do seguimento dos pacientes, independente da complexidade do seu tratamento e necessidade de especialistas. Portanto, o PCDT DM1 visa orientar profissionais da atenção primária à saúde, médicos especialistas, pacientes, cuidadores e familiares quanto ao diagnóstico, tratamento e monitoramento do DM1 no Sistema Único de Saúde (SUS).1
Pacientes com DM1 devem ser atendidos e educados preferencialmente em centros de referência por médicos especialistas (endocrinologistas) e equipe de saúde multiprofissional. Esses pacientes devem ser avaliados periodicamente, em conjunto com a equipe da atenção primária, quanto à adesão ao tratamento, ao conhecimento sobre a doença e ao tratamento, à eficácia do tratamento e à necessidade de ajuste de doses das insulinas.1 A telemedicina pode ser um recurso utilizado para minimizar a dificuldade de acesso aos especialistas e capacitar os profissionais da APS.
Devem ser observados os critérios de inclusão, manutenção e exclusão estabelecidos no PCDT DM1, a duração e a monitorização do tratamento, bem como a verificação periódica das doses prescritas, dispensadas e a adequação de uso dos medicamentos.
Os códigos relacionados ao diagnóstico de DM1, na Classificação Internacional de Doenças e Problemas Relacionados à Saúde (CID-10), podem ser vistos no quadro 1.
| Quadro 1. CID-10 relacionados ao DM1 |
|
E10.0 Diabete melito insulino-dependente – com coma E10.1 Diabete melito insulino-dependente – com cetoacidose E10.2 Diabete melito insulino-dependente – com complicações renais E10.3 Diabete melito insulino-dependente – com complicações oftálmicas E10.4 Diabete melito insulino-dependente – com complicações neurológicas E10.5 Diabete melito insulino-dependente – com complicações circulatórias periféricas E10.6 Diabete melito insulino-dependente – com outras complicações especificadas E10.7 Diabete melito insulino-dependente – com complicações múltiplas E10.8 Diabete melito insulino-dependente – com complicações não especificadas E10.9 Diabete melito insulino-dependente – sem complicações |
Fonte: Adaptado de PCDT DM1, 20191.
Diagnóstico de DM1
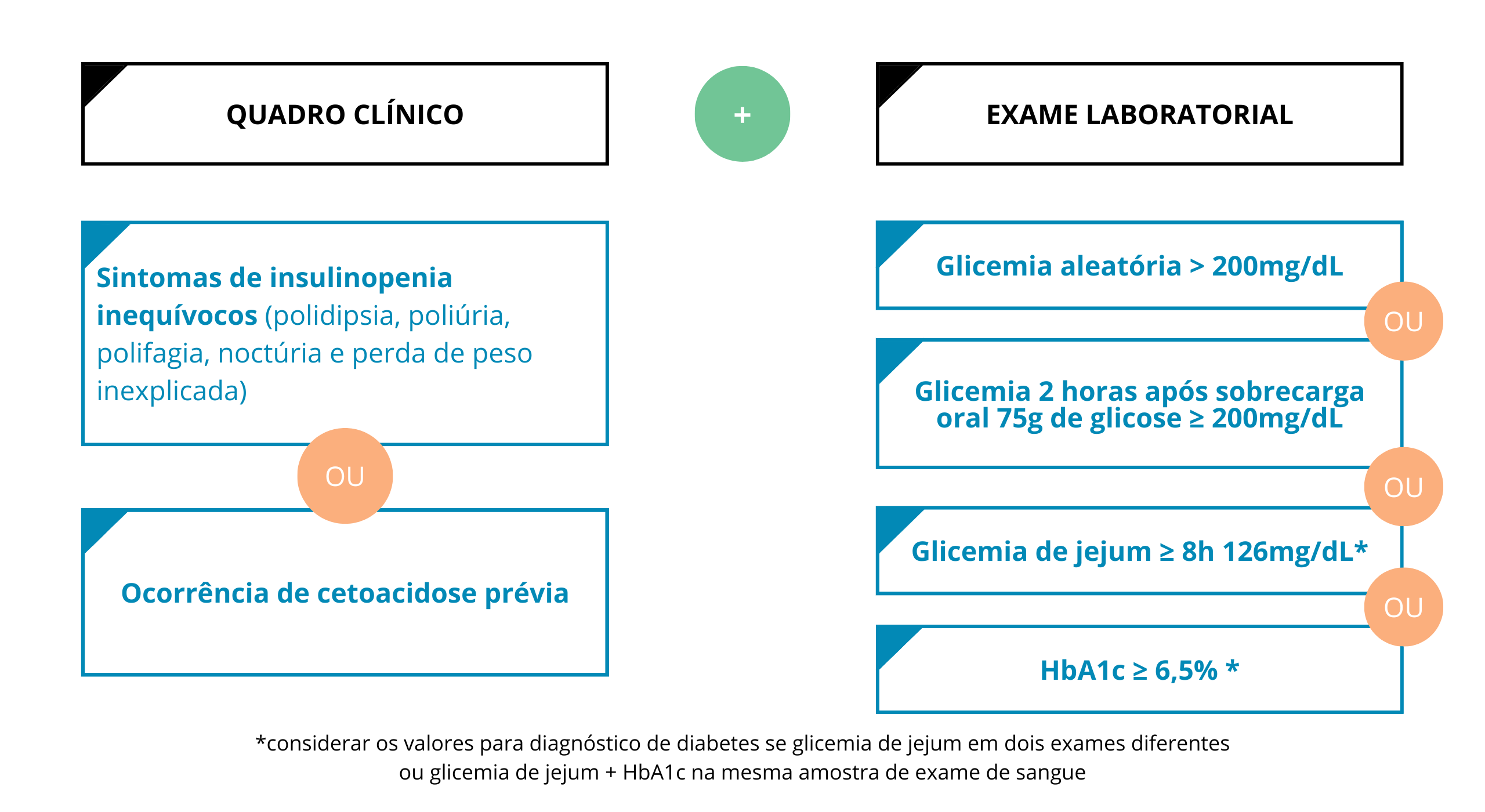
O diagnóstico de DM1 é feito pela presença de sinais e sintomas inequívocos de insulinopenia, como polidipsia, poliúria, polidipsia, perda de peso inexplicada e noctúria. O diagnóstico de DM1, pode ser realizado na presença de cetoacidose diabética, que pode cursar com náuseas, vômitos, sonolência, torpor e coma podendo levar ao óbito. Os exames laboratoriais para confirmação do diagnóstico de DM1 incluem: glicemia aleatória >200 mg/dL, glicemia de jejum >126 mg/dL, hemoglobina glicada >6,5% e glicemia 2 horas após ingestão oral de 75 g de glicose >200 mg/dL (Figura 1).
O pico de incidência do DM1 ocorre na infância e adolescência, entre 10 e 14 anos de idade e, menos comumente, em adultos e idosos. Adultos que apresentam destruição das células β pancreáticas devido ao processo autoimune, têm o diagnóstico de diabete mellitus autoimune do adulto (Latent Autoimmune Diabetes in Adults – LADA).1
O LADA pode ter desenvolvimento lento e progressivo, de acordo com a deficiência de insulina, causando dificuldades para o diagnóstico e tratamento. Nestes casos, é necessário a solicitação do peptídeo C e, pelo menos, um dos marcadores de autoimunidade relacionados ao DM1 (Anti-ICA ou Anticorpo Anti-ilhota de Langerhans, Anti-IAA ou Anticorpo Anti-Insulina ou outros disponíveis).1 O tratamento desses pacientes frequentemente é realizado com antidiabéticos orais até que seja constatada a deficiência de secreção de insulina e a sua progressão, impondo a necessidade de insulinoterapia. Portanto, a SBD recomenda que sejam disponibilizados os exames laboratoriais de peptídeo C, os auto-anticorpos citados acima para os recém diagnosticados, incluindo o Anti-GAD (antidescarboxilase do ácido glutâmico) para aqueles com diagnósticos há mais tempo, sob demanda, no intuito de se instituir diagnóstico e tratamento adequados às pessoas com LADA.
Algumas doenças autoimunes são mais frequentemente encontradas em pacientes com DM1. As principais são o hipotireoidismo e a doença celíaca, com prevalência de 17% a 30% e de 1,6% a 16,4%, respectivamente. Outras condições autoimunes, como insuficiência adrenal primária, hepatite autoimune, gastrite autoimune, dermatomiosite e miastenia grave, embora menos frequentes, também têm uma ocorrência maior em pacientes com DM1, comparados à população geral.1
Figura 1. Critérios diagnósticos de DM1
Fonte: Adaptado de PCDT DM1, 2019.1
HbA1c: hemoglobina glicada, preferencialmente por método certificado pelo National Glycohemoglobin Standardization Program. *paciente com sintomas clássicos de insulinopenia não precisa repetir; **raramente utilizado; ***em duas ocasiões. Quadro de hiperglicemia associado ao estresse agudo infeccioso, traumático ou circulatório não deve ser considerado diagnóstico de DM, pois muitas vezes é transitória. Portanto, o paciente deve ser reavaliado fora deste contexto agudo para observar se a hiperglicemia persiste.
Critérios de inclusão e exclusão do PCDT – DM1
Foram incluídos no PCDT DM1 os pacientes com diagnóstico de DM1 conforme definido no item diagnóstico (Figura 1). Para isso, o paciente deverá apresentar sinais inequívocos de insulinopenia somados à demonstração de hiperglicemia laboratorial.1
Foram excluídos deste Protocolo os pacientes que apresentarem pelo menos um dos critérios apresentados abaixo no Quadro 2:
| Quadro 2. Critérios de exclusão |
|
Critérios de inclusão para o tratamento com análogos de insulina de ação rápida e de ação prolongada
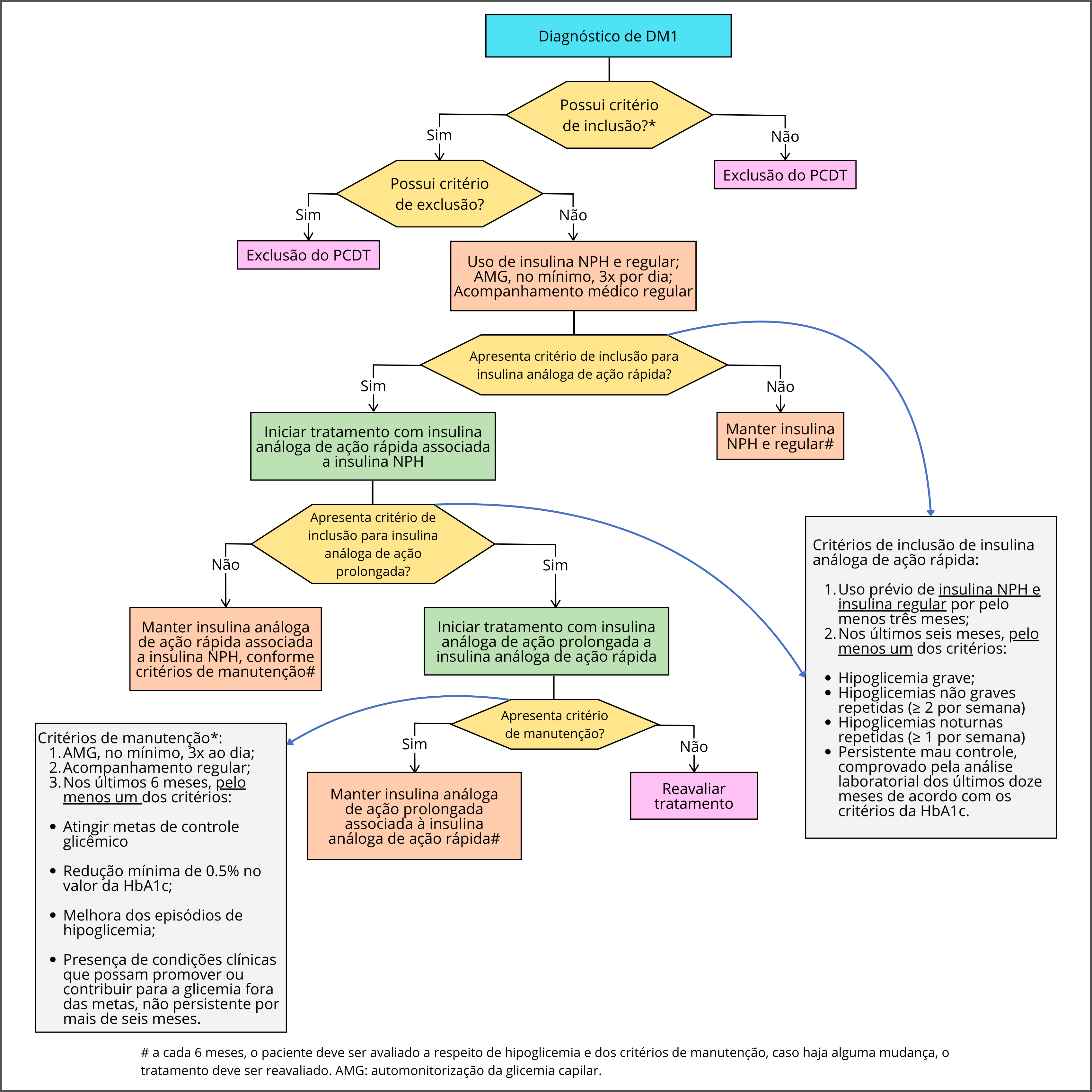
Para o uso de análogos de insulina de ação rápida e de ação prolongada, os pacientes deverão apresentar, além dos critérios de inclusão de DM1, todas as condições apresentadas no no fluxograma da Figura 2. 1
A presença de hipoglicemias graves documentadas, não-graves repetidas (>2/semana), e noturnas (>1/semana) com frequências elevadas é critério de indicação para evolução terapêutica de pessoas com DM1, bem como o controle glicêmico inadequado persistente (01 ano), apesar da realização de automonitorização glicêmica (AMG) e acompanhamento regular com profissionais de saúde.
Sugestão da SBD quanto à evolução terapêutica do DM1, na presença de hipoglicemias frequentes, hipoglicemia grave e hipoglicemias noturnas em frequências elevadas:
- Insulina humana NPH + análogo de insulina de ação rápida
- Análogos de insulina de ação prolongada + de ação rápida
- Análogos de insulina de ação ultraprolongada5 + de ação rápida
- Outras tecnologias: monitorização contínua da glicose, aplicativos, SICI, SICI closed-loop híbrido.6
Critérios de manutenção do tratamento com análogos de insulina de ação rápida e prolongada
Para a manutenção do tratamento, o paciente deverá comprovar a adesão à AMG e acompanhamento regular, além de apresentar, nos últimos seis meses, pelo menos um dos critérios apresentados no fluxograma da Figura 2.
As metas de hemoglobina glicada (HbA1c) sugeridas para pessoas com DM1, descritas nos critérios de inclusão e manutenção do tratamento com análogos de insulina de ação rápida e prolongada estão descritas na tabela 1.
Tabela 1. Metas de hemoglobina glicada para pessoas com DM1
| HbA1c % | Crianças e adolescentes | Adulto | Idoso |
| < 7,5 | < 7,0 | entre 7,5 e 8,5 |
Fonte: Adaptado de PCDT DM1, 20191.
Casos especiais1
Pacientes com DM1 já em uso de análogo de insulina
Para serem incluídos neste Protocolo, os pacientes com diagnóstico de DM1 que já fazem uso de insulina análoga deverão cumprir os critérios de manutenção de tratamento.1
Adultos com o diagnóstico de diabetes latente autoimune (LADA)
Na suspeita clínica de diabetes latente autoimune do adulto, para o tratamento com insulina análoga de ação rápida ou prolongada, os pacientes deverão apresentar, além dos critérios de inclusão deste Protocolo, os seguintes exames: dosagem de peptídeo C, acrescida dos resultados da pesquisa e titulação de pelo menos um dos marcadores de autoimunidade (ICA, IAA ou Anti-GAD).
Os seguintes exames constam no Sistema de Gerenciamento da Tabela de Procedimentos, Medicamentos e OPM do SUS (SIGTAP) 1:
• 02.02.06.028-4 – Dosagem de peptideo C;
• 02.02.03.051-2 – Pesquisa de anticorpos anti-ilhota de Langerhans (ICA);
• 02.02.03.052-0 – Pesquisa de anticorpos anti-insulina (IAA).
Gestantes
Em geral, deve-se proceder ao controle intensificado da glicemia e monitoramento rigoroso em mulheres grávidas com diabetes e naquelas com intenção de engravidar.1 O tratamento indicado é a manutenção do esquema basal-bolus com múltiplas doses de insulina, visando-se obter o melhor controle metabólico possível antes da concepção (HbA1c < 6,0%) e mantendo-o durante toda a gestação. Gestantes com DM1 prévio devem realizar glicemias pré-prandiais e pós-prandiais para obterem controle glicêmico adequado. As glicemias pré-prandiais são recomendadas para ajuste na dose de insulina análoga de ação rápida. A monitorização das glicemias pós-prandiais está associada com controle glicêmico melhor e menor risco de pré-eclâmpsia.1,6,7
O acompanhamento deve ser realizado, preferencialmente, por equipe especializada. Sugere-se a leitura das seções da Diretriz da SBD 2021/2022 descritas abaixo, para aprofundamento de conhecimentos sobre seguimento e tratamento de mulheres com DM1 durante a gestação:
- Metas de tratamento no DMG, DM2 e DM1
- Monitoramento da Glicemia na Gestação
- Tratamento dietético do DM1, DM2, DMG na gestação
- Insulinoterapia na gestação: DM1, DM2 e DMG
- Assistência de enfermagem na gestante com DM
- Manejo no período periparto
Lactantes e Lactentes
O período imediato que segue o parto é tradicionalmente caracterizado pela necessidade menor de insulina em lactantes com DM1. Em geral, nesse período a necessidade de insulina materna se reduzirá em 60% relativamente à dose total diária usada durante a gestação.8
Os recém-nascidos de mães com DM1 (lactentes) têm maior risco de hipoglicemia, distúrbios respiratórios e icterícia no período de pós-parto imediato, especialmente se o controle glicêmico materno não for otimizado. A hipoglicemia neonatal pode ser minimizada por meio de alimentação frequente do lactente (a cada três horas) 8.
O aleitamento materno deve ser encorajado. Nas mulheres que amamentam poderá haver necessidade de redução da dose de insulina em mais de 10%, em relação à dose diária prévia à gestação.8 Uma vez que a glicemia materna pode variar muito neste período, faz-se necessária AMG mais frequente e ajustes de doses de insulina e de alimentação antes e após a amamentação. Sugere-se a leitura da seção 6.9 Cuidados no Pós-Parto da Diretriz da SBD 2021/2022.1
Tratamento do paciente com DM1
O tratamento do paciente com DM1 inclui cinco componentes principais: educação sobre diabetes, insulinoterapia, automonitorização glicêmica, orientação nutricional e prática monitorada de exercício físico. É um tratamento complexo em sua prescrição e execução e exige a participação intensiva do paciente, que precisa ser capacitado para tal. O fluxograma da evolução terapêutica de pessoas com DM1 deverá ocorrer da seguinte forma: Insulina NPH associada à insulina regular; insulina NPH associada à insulina análoga de ação rápida e insulina análoga de ação rápida associada à insulina análoga de ação prolongada (Figura 2).1
A educação dos pacientes e seus familiares para o autocuidado envolve processos de educação sobre alimentação saudável, contagem de carboidratos, prática de exercícios físicos, identificação e tratamento da hipoglicemia, administração de insulina, insulinoterapia intensiva e AMG. Os objetivos de controle glicêmico devem ser determinados individualmente, de acordo com a idade do paciente e a capacidade, do paciente e seus cuidadores, para identificar e tratar hipoglicemias (Tabela 2).1,6
Tabela 2. Objetivos glicêmicos para pessoas com DM1
| Parâmetros | Crianças e adolescentes | Adultos | Gestantes |
| Glicemia pré-prandial (mg/dL) | 70 a 145 | 70 a 130 | < 90 |
| Glicemia pós-prandial (mg/dL) | 90 a 180 | < 180 |
1a hora < 140 2a hora < 120 |
| Glicemia ao deitar (mg/dL) | 120 a 180 | - | - |
| Glicemia na madrugada (mg/dL) | 80 a 162 | - | - |
| HbA1c (%) | < 7,5 | < 7,0 | < 6,0 |
Fonte: PCDT DM1, 20191.
Adesão ao tratamento
A adesão ao tratamento é um fator fundamental para o sucesso do tratamento das pessoas com diabetes. Recomenda-se reforçar esse aspecto, em conjunto com a família e identificar possíveis barreiras que impeçam a adesão.1,5 O controle adequado da doença está relacionado a diversos fatores e inclui o entendimento da família acerca do DM1.1,6
A adolescência é um estágio da vida que requer especial atenção decorrentes das mudanças hormonais, físicas, sociais e psíquicas que podem levar à diminuição da adesão ao tratamento.9 Estudos têm apontado que a adesão à terapia em adolescentes com DM1 é um problema desafiador que requer uma atenção multidisciplinar.10,11
A SBD ressalta a importância dos profissionais de saúde, principalmente o farmacêutico, na avaliação e intervenção sobre a adesão à terapia entre as pessoas com DM1, no Brasil. Estudo multicêntrico, envolvendo aproximadamente 1.700 pacientes com DM1, mostrou que apenas 9,8% dos participantes apresentavam adesão máxima ao tratamento e 48% adesão mínima, com hemoglobina glicada média de 8,6±1,9 e 9,2±2,2%, respectivamente.12
Tratamento não medicamentoso
As intervenções não medicamentosas são indispensáveis para um controle glicêmico adequado e referem-se a educação sobre diabetes e estímulo ao autocuidado, orientação nutricional e cessação do tabagismo. Idealmente, o cuidado não-médico do paciente com DM1 deve ser provido por vários profissionais da área da saúde, incluindo enfermeiro, farmacêutico, nutricionista, psicólogo, cirurgião dentista, assistente social, educador físico e profissionais da área da educação.1,6,7
Os esforços da equipe devem ser focados na perspectiva do paciente, conhecendo a sua rotina e entendendo as suas respostas glicêmicas. Os pacientes devem adquirir conhecimentos e instituir hábitos em relação aos objetivos glicêmicos, automonitorização glicêmica, administração de insulina, identificação e tratamento de hipoglicemias, ajuste de doses de insulinas de acordo com o nível glicêmico e a quantidade de carboidratos da refeição. O programa educacional precisa ser compatível com o nível de desenvolvimento cognitivo e adaptado à capacidade intelectual da criança, adolescente e dos familiares. Recomenda-se que os pais estejam completamente envolvidos no processo de educação e autogerenciamento do DM e que a transição da responsabilidade sobre os cuidados com a doença seja realizada de maneira gradual e flexível, no momento apropriado e sob a supervisão de profissionais com experiência em educação em DM.1,6,7
Recomenda-se a leitura das seções Aspectos Psico-Sociais do Diabetes 1 e 2 e Técnicas para Educação em Diabetes, da Diretriz da SBD 2021/2022
As recomendações nutricionais para uma alimentação saudável para a população geral são aplicáveis aos pacientes com DM1. A diferença consiste no fato de que as refeições devem estar relacionadas com a insulinoterapia e a prática de exercícios físicos, com o objetivo de atingir os alvos glicêmicos pré-determinados.1,6
A atividade física regular está relacionada com a melhora no condicionamento físico, na força muscular e na sensibilidade à insulina de pessoas com DM1. As crianças com DM1, da mesma forma que crianças sem diabetes, devem ser encorajadas a realizar, pelo menos, 60 minutos de atividade física todos os dias. Os adultos com diagnóstico de diabetes devem ser aconselhados a realizar, pelo menos, 150 minutos semanais de atividade física aeróbica no mínimo três vezes por semana, orientado por profissional capacitado1,6.
Recomenda-se a leitura do Exercício e DM1, da Diretriz da SBD 2021/2022, para aprofundamento sobre o tema.
Tratamento medicamentoso
O esquema de insulinoterapia, para pessoas com DM1, deve incluir uma insulina basal de ação intermediária ou prolongada (insulina NPH humana ou análoga de ação prolongada), associada à insulina bolus ou de ação rápida (humana regular ou análoga de ação rápida), com múltiplas doses diárias que devem respeitar a faixa etária, o peso do paciente, o gasto energético diário incluindo atividade física e a dieta e levando-se em consideração possível resistência à ação da insulina e a farmacocinética desses medicamentos.1
| Quadro 3. Fármacos disponíveis |
|
* Fármacos disponibilizados em protocolos de SES e SMS.
Figura 2. Fluxograma de tratamento do DM1, com as indicações para início das insulinas análogas e sua manutenção
Fonte: PCDT DM1, 20191.
Esquemas de administração das insulinas
As insulinas disponibilizadas pelo MS podem ser classificadas como insulina basal (NPH e análogo de ação prolongada) e insulina bolus (regular e análogo de ação rápida). Também podem ser classificadas de acordo com a sua estrutura proteica em insulinas humanas (NPH e regular) e análogos de insulina de ação rápida (asparte, glulisina e lispro), de ação prolongada (detemir e glargina U100) e de ação ultraprolongada (degludeca e glargina U300).
Em geral, a dose total diária inicial de insulina para pessoas com DM1 e diagnóstico recente, ou logo após episódio de cetoacidose diabética, varia de 0,5 a 1 unidade por quilograma por dia (UI/kg/dia).1,6,7,13 Esta dose depende da idade, peso corporal, estadiamento puberal, tempo de duração da doença, estado do local de aplicação de insulina, do número e da regularidade das refeições, do automonitoramento, da HbA1c pretendida, do tipo, frequência e intensidade das atividades físicas e das intercorrências (infecções e dias de doença).14
Na tabela 3 podem ser vistas as sugestões de dose total diária de insulina (insulina basal + insulina bolus) e a dose total diária de insulina basal que deverá corresponder a menos de 50% da dose total diária de insulina. Idealmente a dose de insulina bolus deverá corresponder a mais de 50% da dose total diária de insulina. As doses descritas na tabela 3 podem ser as doses iniciais que devem ser ajustadas de acordo com as necessidades demonstradas pela AMG.1,15
Tabela 3. Dose total diária de insulina e de insulina basal recomendada para pessoas com DM1
| Pacientes com DM1 |
Dose total diária de insulina |
Dose total diária de insulina basal (UI/Kg/dia) |
|
Diagnóstico recente (lua de mel) |
< 0,5 | < 0,25 |
|
Após a remissão parcial/adultos |
0,7 a 1,0 | 0,3 a 0,5 |
| Lactentes | 0,2 a 0,4 | 0,1 a 0,2 |
| Pré-púberes | 0,5 a 0,8 | 0,2 a 0,4 |
| Púberes | 0,8 a 2,0 | 0,4 a 1,0 |
Fonte: Adaptado de Tamborlane WV et al, 2012.15
Insulinas basais
Insulina humana NPH
A dose total diária da insulina basal NPH, pode ser calculada conforme está descrito na tabela 3. Ela deverá ser administrada duas a três vezes ao dia e eventualmente, quatro vezes ao dia. A maior parte dos pacientes necessita de três administrações diárias: antes do desjejum, antes do almoço e antes de dormir ou 22h. A última dose de NPH do dia deve ser administrada antes de dormir, aproximadamente às 22 horas ou 8 horas antes do despertar do paciente. A utilização de doses de NPH antes do jantar pode resultar em pico de ação durante a madrugada, causando hipoglicemias noturnas e concentrações reduzidas de insulina no período do amanhecer quando, geralmente, há piora na ação da insulina.5,16 Os pacientes que usam uma ou duas doses elevadas de insulina NPH podem apresentar hipoglicemia, se atrasarem ou omitirem refeições, devido ao pico pronunciado destas doses elevadas de NPH.
Análogo de insulina de ação prolongada
Há duas insulinas de ação prolongada (glargina U100 e detemir) e 2 de ação ultraprolongada (degludeca e glargina U300) no mercado brasileiro. Todas são descritas abaixo, pois não sabemos qual delas será adquirida pelo Ministério da Saúde, no sistema de pregão eletrônico por classe terapêutica. Todos os análogos de insulina basal podem ter as suas doses iniciais calculadas de acordo com a tabela 3, devendo corresponder a menos de 50% da dose total diária de insulina.
Insulina Detemir
Detemir 100 UI/mL pode ser administrada uma (com a refeição da noite ou antes de dormir) ou duas vezes ao dia com intervalo de 12 horas. Para pacientes que estão substituindo a insulina NPH pela insulina detemir, administrada duas vezes ao dia, realizar a troca numa base de unidade para unidade e individualizar a dose com base na resposta clínica1.
Insulina Glargina
Glargina 100 UI/mL administrada uma ou duas vezes ao dia preferencialmente, no mesmo horário todos os dias. As doses e os intervalos das doses devem ser ajustados individualmente. Para pacientes que estão substituindo a insulina NPH e detemir por dose única diária de glargina, sugere-se a redução da dose em 20% e ajuste da dose com base na resposta clínica1.
Insulina Degludeca
Degludeca 100 UI/mL: é administrada uma vez ao dia, em qualquer hora do dia, preferencialmente no mesmo horário todos os dias. A dose deve ser ajustada de acordo com a resposta individual1.
Insulina Glargina U300
Glargina 300 UI/mL: é administrada uma vez ao dia, em qualquer hora do dia, preferencialmente no mesmo horário todos os dias. A dose deve ser ajustada de acordo com a resposta individual1.
O ajuste das doses das insulinas basais deve ser de acordo com as glicemias em jejum e pré-prandiais, glicemias no período do sono e a presença de hipoglicemias entre as refeições e no período de sono. Caso ocorra queda da glicemia maior do que 30 mg/dL, no período de sono, recomenda-se a redução da última dose de insulina basal em 10% a 20%. Esta excursão glicêmica deve ser observada sem que haja lanches, correção de hiperglicemia pós-prandial e doses de bolus (prandial e de correção). Caso ocorra hipoglicemia, pela omissão dos lanches entre as refeições principais ou por atraso de uma das refeições ou no período noturno, sugere-se redução da última dose de insulina basal administrada antes da hipoglicemia, de 10% a 20%16.
Insulinas tipo bolus
Estabelecer os objetivos glicêmicos (Tabela 2), é o primeiro passo para iniciar a insulinoterapia intensiva6,7. É importante que o paciente calcule a sua dose de bolus de correção, de acordo com os objetivos glicêmicos e as glicemias pré-prandiais, e assim seja envolvido no gerenciamento do diabetes.
A dose de insulina bolus corresponde à insulina de ação rápida administrada previamente às refeições, para metabolização dos carboidratos ingeridos (bolus prandial ou da alimentação) e para correção de hiperglicemias (bolus de correção). O ideal é que corresponda a 50% ou mais da dose total diária de insulina e que seja administrada antes das refeições principais, de acordo com a ingestão de carboidratos e níveis glicêmicos. Desta forma, a dose de insulina de ação rápida (bolus) administrada antes das refeições é composta de duas doses: o bolus prandial e o bolus de correção, calculados separadamente, somados e administrados juntos6,16,17.
Insulina humana regular:
Administra-se a insulina regular 30 minutos antes das refeições principais, em três aplicações diárias. A insulina regular possui limitações quanto ao seu uso, como insulina bolus, porque deve ser administrada, no mínimo, 30 minutos antes das refeições, dificultando o ajuste de dose de acordo com a ingestão de carboidratos da refeição. Por este motivo, calcula-se uma dose fixa a ser administrada antes das refeições principais e sugere-se a manutenção de quantidades constantes de carboidratos nas refeições. Uma forma de calcular as doses da insulina regular é utilizar metade da dose total diária de insulina (UI/Kg/dia), dividida nas três refeições principais, de acordo com a ingestão de alimentos1,18.
A SBD sugere que o usuário de insulina humana regular avalie a glicemia 30 minutos antes das refeições e aumente ou reduza a dose fixa de cada refeição de acordo com esta glicemia. Há necessidade de estabelecer o fator de correção (FC) que corresponde à redução da glicemia, aproximada, após a administração de 1U de insulina bolus (Tabela 4). Esquemas práticos para inserir o bolus de correção são descritos abaixo:
Para pacientes com dificuldades para realização de cálculos, recomendamos a seguinte forma de prescrição:
Corrigindo a glicemia utilizando escala:
1. Estabelecer o FC (Tabela 4)
Exemplo: FC = 50 (adulto com DM1)
2. Determinar o objetivo glicêmico (OG)
Pode ser utilizado 100 mg/dL para adultos e 150 mg/dL para crianças ou indivíduos com hipoglicemias sem sintomas
3. Determinar o limite superior da glicemia (LSG) que corresponde à glicemia acima da qual deve-se utilizar bolus de correção.
LSG = FC + OG
Veja na tabela abaixo, o exemplo de algoritmo para correção de hiperglicemia para paciente com FC=50, OG=100 e LSG=150 que utiliza doses fixas de 5 U de insulina de ação rápida antes das três refeições principais. Entre parênteses está a dose total de insulina regular a ser administrada.
Tabela 4. Exemplo de algoritmo para correção de hiperglicemia
| Glicemia (mg/dL) |
Ajuste na dose de insulina bolus (UI) |
Dose de insulina bolus prandial + correção (UI) |
| < 50 | - 2 | 3 |
| 51 a 70 | - 1 | 4 |
| 71 a 150 | 0 | 5 |
| 151 a 200 | + 1 | 6 |
| 201 a 250 | + 2 | 7 |
| 251 a 300 | + 3 | 8 |
| 301 a 350 | + 4 | 9 |
| 351 a 400 | + 5 | 10 |
| > 400 | + 6 | 11 |
Fonte: Adaptado de PCDT DM1, 2019.1
Abaixo está descrita a fórmula utilizada para cálculo de bolus de correção e o exemplo de cálculo de bolus de correção para pacientes habilitados para realizarem contas matemáticas.
Bolus de Correção = Glicemia Atual – Objetivo Glicêmico (OG)
Fator de correção (FC)
Exemplo de cálculo de BC:
(glicemia atual = 281 mg/dL, OG = 100 mg/dL e FC = 40)
Bolus de correção = 281 – 100/40 = 4,5 U (somar à dose de bolus prandial).
Tabela 5. Fator de Correção (FC) e Relação Carboidrato/Insulina (C/I), de acordo com a idade
| Idade (anos) | Fator de Correção (FC) | Relação Carboidrato/Insulina |
| Até 2 anos | 300 - 350 | 45 - 50 |
| 3 a 5 | 200 - 250 | 40 |
| 6 a 8 | 180 | 30 |
| 9 a 11 | 100 - 150 | 20 |
| 12 a 13 | 75 - 100 | 12 - 15 |
| Igual ou acima de 14 | 25 - 75 | 10 |
| Adultos | 40 - 60 | 10 - 20 |
Fonte: Adaptado de PCDT DM1, 20191.
Análogo de insulina de ação rápida:
Os análogos de insulina de ação rápida foram incluídos no PCDT de DM1 porque reduz em 45% o risco de hipoglicemias noturnas e em 32% o risco de hipoglicemias graves, em pessoas com DM1, quando comparados à insulina humana regular19
Há três insulinas análogas de ação rápida (lispro, asparte e glulisina) disponíveis no mercado brasileiro. Qualquer uma delas pode ser adquirida pelo Ministério da Saúde, no sistema de pregão eletrônico por classe terapêutica.
A insulina análoga de ação rápida pode ser administrada imediatamente antes ou, em situações de exceção, imediatamente após as refeições. Esta insulina permite que os pacientes ajustem as suas doses de insulina bolus de acordo com a glicemia (bolus de correção) e a quantidade de carboidratos das refeições (bolus prandial) 1,15.
O bolus de correção pode ser calculado utilizando os parâmetros descritos para a insulina regular. A dose do bolus prandial, idealmente, deve ser ajustada para a quantidade de carboidratos a serem ingeridos na refeição, utilizando a relação carboidrato/insulina (R C/I) que indica quantos gramas de carboidratos deverão ser cobertos por 1U de insulina de ação rápida1,15.
Relação Carboidrato/Insulina
A relação carboidrato/insulina (R C/I) pode ser estabelecida de acordo com a faixa etária do paciente, conforme está descrito na tabela 4. A contagem de carboidratos consiste em uma estratégia nutricional na qual o paciente conta a quantidade de carboidratos da refeição, em gramas, e ajusta a dose de insulina de acordo com esta estimativa, permitindo maior flexibilidade nas escolhas dos alimentos. Após contar os carboidratos da refeição, com o auxílio de aplicativos e tabelas com a quantidade de carboidratos por medidas caseiras dos alimentos, utiliza-se a R C/I para estabelecer a dose de insulina de ação rápida para cobrir a refeição (Tabela 5).
Tabela 6. Exemplo de cálculo de bolus prandial para um adulto que utiliza a R C/I de 15g/1U de insulina
| Alimento | Quantidade | Carboidratos (g) |
| Arroz branco | 3 colheres (sopa) | 15 |
| Lentilha | 5 colheres (sopa) | 20 |
| Verduras e legumes | 1 pires | 0 |
| Bife pequeno | 1 unidade | 0 |
| Tangerina | 1 unidade média | 15 |
| Total | 50 | |
Fonte: Adaptado de PCDT DM1, 2019 (Apêndice C).
Bolus Prandial = Quantidade de carboidratos da refeição
R C/I
Exemplo:
Bolus Prandial = 50/15 = 3,3 U = 3,0 ou 3,5 U (esta dose deverá ser somada à dose do bolus de correção).
Geralmente, há necessidade de uma dose maior de insulina para a mesma quantidade de carboidratos no desjejum quando comparado ao almoço e jantar. Nesta refeição, mais comumente, os adultos com DM1 utilizam 1U de insulina para cada 5 a 10 g de carboidratos. É importante ressaltar que o bolus prandial a ser administrado antes de dormir, deverá utilizar relações carboidrato/insulina maiores, para evitar hipoglicemias durante o sono. Por exemplo, pode-se prescrever inicialmente, para adultos, uma relação carboidrato/insulina de 20 a 25 g/1 U de insulina para este horário. Caso o lanche entre as refeições principais contenha mais do que 15 a 20 g de carboidratos haverá necessidade de aplicação de insulina de ação rápida.17
O ajuste da relação carboidrato/insulina ou da dose fixa de bolus prandial deverá ser realizado de acordo com a avaliação das glicemias antes e duas horas após as refeições, de preferência em refeições nas quais as glicemias pré-prandiais estejam dentro do alvo glicêmico. Caso a glicemia pós-prandial de uma das refeições esteja consistentemente abaixo ou acima do alvo glicêmico (por exemplo, para adultos geralmente utilizamos como objetivo pós-prandial glicemias entre 90 e 140 mg/dL), deve-se aumentar ou reduzir a relação carboidrato/insulina em 1 a 2 g/1U, respectivamente20. Atualmente, encontra-se disponível para suporte aos pacientes, aplicativos gratuitos para a contagem de carboidratos21 e realização dos cálculos das doses de insulina bolus de correção e prandial.
O ajuste do FC deverá ser realizado de acordo com a avaliação da glicemia de duas a três horas após a administração de bolus de correção, de preferência sem a ingestão de alimentos. Caso a glicemia, após a dose de bolus de correção, atinja valores abaixo ou acima dos objetivos glicêmicos, deve-se aumentar ou diminuir o FC em 10%, respectivamente.
Administração de insulina
A administração de insulina, para usuários do SUS, pode ser feita com seringas e, mais recentemente, com canetas. A equipe de saúde responsável pelo cuidado do paciente com DM1 deve fornecer informações quanto ao armazenamento, transporte e preparo da insulina e, também, deve conhecer as técnicas de aplicação de insulina para orientação aos pacientes e cuidadores, fazendo revisão, periodicamente para garantir uma boa técnica na administração e a efetividade do tratamento. Sugere-se a leitura dos seguintes capítulos da Diretriz de Diabetes da SBD (2021/2022): capítulo 18.4 Procedimentos de Dispensação de Medicamentos e Insumos para o entendimento dos procedimentos administrativos; e capítulo 4.6 Técnicas de aplicação de insulina para o aprofundamento sobre o tema.
A SBD considera aceitável, de acordo com o Relatório da CONITEC apresentado em consulta pública relacionada à incorporação dos análogos de insulina de ação rápida, a disponibilização de uma agulha (4 mm) por dia para aplicação das doses desta insulina e, pelo menos, mais uma agulha por dia para a administração da insulina basal. Desta forma, todas as pessoas com DM1 em uso de insulinoterapia basal-bolus deveriam receber, ao menos, 2 agulhas por dia.
Tempo de tratamento e critérios de interrupção
O tratamento medicamentoso com insulina não pode ser interrompido para os pacientes com DM1, visto que pode desencadear um quadro de cetoacidose diabética, coma e morte. Entretanto, o tratamento deve ser revisto e ajustado de acordo com a indicação médica seguindo as orientações deste PCDT. Pacientes em uso de insulina análoga de ação rápida ou prolongada, quando não comprovarem a manutenção do bom controle, avaliados por meio dos critérios de manutenção de tratamento deste PCDT, devem ter o tratamento interrompido e retornar ao uso das insulinas humanas regular e NPH. Recomenda-se que estes pacientes tenham a adesão à terapia avaliada e realizadas as intervenções educativas com foco na adesão à terapia. Ressalte-se aqui que, antes da interrupção do tratamento com insulina análoga as medidas para melhorar a adesão devem ser reforçadas e registradas em prontuário do paciente1.
Os benefícios esperados com a evolução terapêutica das pessoas com DM1 incluem:
– Melhor controle glicêmico possível
– Melhora dos sintomas relacionados à hiperglicemia
– Diminuição das complicações agudas e crônicas em pessoas com DM1
– Diminuição da incidência de episódios de hipoglicemia grave e noturna
Monitorização e acompanhamento
O controle glicêmico pode ser avaliado por glicemias capilares de jejum e pós-prandiais e pela HbA1c. As glicemias capilares são utilizadas para orientar o ajuste das doses de insulina, uma vez que apontam os momentos no decorrer do dia em que ocorre falta ou excesso de sua ação.
A HbA1c é utilizada para avaliar o controle glicêmico em médio e longo prazo, refletindo os últimos três meses de controle glicêmico. Deve-se fazer a medida da HbA1c no início do tratamento e a cada três meses, podendo ser realizada apenas semestralmente para aqueles pacientes com controle adequado1.
A AMG é indicada para todos os pacientes com DM16,7. Os dados e a frequência da AMG podem ser obtidos por sistemas que realizam o download e a análise das glicemias armazenadas na memória do glicosímetro. Em unidades de saúde nas quais não é possível realizar o download dos dados dos glicosímetros, pode ser solicitado aos pacientes o registro das suas glicemias em tabelas e por um período de no mínimo 15 a 30 dias, com a análise dos resultados durante a consulta com profissionais da saúde. Os pacientes com DM1 devem realizar a AMG domiciliar para educação em diabetes, ajustes das doses de insulina e para a avaliação do tratamento. A AMG fornece aos pacientes informações imediatas sobre o controle glicêmico, permitindo a identificação precisa de hipoglicemias e hiperglicemias, aumentando a segurança dos pacientes e prescritores e motivando os pacientes a realizarem as mudanças necessárias na alimentação, atividade física e doses de insulina. O uso da AMG deve ser racional, e a distribuição das tiras reagentes segue as normas de cada local, recomendando-se pelo menos três a quatro testes por dia e aumentando o fornecimento segundo as necessidades do paciente. Por exemplo, quando há necessidade de avaliação e ajustes nos parâmetros utilizados para o cálculo da insulina bolus (FC e R C/I).
Para os pacientes com DM1, é necessário o acompanhamento médico regular (mínimo duas vezes ao ano), com endocrinologista; na indisponibilidade deste, com um médico clínico com experiência no tratamento de DM1 e insulinoterapia. As pessoas com DM1 precisam de educação em diabetes, com foco no autocuidado, fornecido por equipe multiprofissional.
Cabe destacar que a avaliação do controle glicêmico não deve se restringir à HbA1c, pois outros critérios importantes são: a frequência de hipoglicemias, principalmente as noturnas e graves, e a variabilidade glicêmica (VG). A VG é um dos parâmetros do controle glicêmico que vem ganhando importância e foi demonstrada associação entre a variabilidade da glicemia de jejum e hipoglicemias noturnas e graves. A adesão à terapia e a melhora do controle glicêmico dependem da utilização de um esquema de insulinoterapia individualizado e que atenda a todos esses parâmetros de controle glicêmico, sem comprometimento da qualidade de vida do paciente.1,22
O acompanhamento de pessoas com DM1 deve ser feito com avaliação clínica e laboratorial, pelo menos duas vezes ao ano, sempre que possível com médico especialista (endocrinologista), e as complicações crônicas devem ser rastreadas anualmente, a partir do 5º ano de duração da doença, ou na puberdade, ou diante de outra situação a critério clínico. Abaixo estão descritos os esquemas para avaliação laboratorial e rastreamento de complicações em pessoas com DM11.
- Glicemia em jejum e HbA1c, pelo menos, 2 vezes ao ano
- Colesterol total, triglicerídeos, HDL colesterol, LDL colesterol, creatinina sérica, anual ou, a critério clínico
- Albuminúria anual, após 5 anos de diagnóstico ou, na puberdade ou, a critério clínico
- Fundoscopia anual, após 5 anos de diagnóstico ou, na puberdade ou, a critério clínico
- Avaliação dos pés anual, após 5 anos de diagnóstico ou, na puberdade ou, a critério clínico
Referências
- Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. Departamento de Gestão e Incorporação de Tecnologias e Inovação em Saúde. Protocolo Clínico e Diretrizes Terapêuticas do Diabete melito tipo 1. Disponível em https://www.gov.br/saude/pt-br/assuntos/protocolos-clinicos-e-diretrizes-terapeuticas-pcdt/arquivos/2021/portaria-conjunta-7_2019_pcdt_diabete-melito-1.pdf.
- PCDT Resumido – Protocolo Clínico e Diretrizes Terapêuticas Diabete Melito Tipo 1, portaria conjunta SCTIE/SAES/MS nº 17 de 12 de novembro de 2019. Disponível em http://conitec.gov.br/images/Protocolos/Resumidos/PCDT_Resumido_DiabetesMellitus_Tipo1.pdf
- Gregory GA et al. Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study. Lancet Diabetes Endocrinol. 2022 Oct;10(10):741-760.
- Gomes, MB et al. Prevalence of adults with type 1 diabetes who meet the goals of care in daily clinical practice: a nationwide multicenter study in Brazil. Diabetes Research and Clinical Practice, [s. l.], v. 97, n. 1, p. 63-70, 2012.
- Liu W, Yang X, Huang J. Efficacy and Safety of Insulin Degludec versus Insulin Glargine: A Systematic Review and Meta-Analysis of Fifteen Clinical Trials. International Journal of Endocrinology [Internet]. 2018;2018:1–10.
- Sociedade Brasileira de Diabetes. Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. Organização José Egídio Paulo de Oliveira, Renan Magalhães Montenegro Junior, Sérgio Vencio. São Paulo: Ed. Clannad, 2017.
- American Diabetes Association. Standard of Medical Care in Diabetes 2019. Diabetes Care, [s. l.], v. 42, Jan. 2019. Suppl 1. Disponível em: https://care.diabetesjournals.org/content/42/Supplement_1.
- Ringholm, L. et al. Managing type 1 diabetes mellitus in pregnancy from planning to breastfeeding. Nature Reviews Endocrinology, [s. l.], v. 8, p. 659-667, 2012.
- Greco-Soares, JP, Dell’Alio, DD. Adesão ao tratamento em adolescentes com diabete melito tipo 1. Psicologia, Saúde & Doenças, Lisboa, v. 18, n. 2, p. 322-334, 2017. Disponível em: http://www.scielo.mec.pt/scielo.php?script=sci_arttext&pid=S1645-00862017000200004&lng=pt. http://dx.doi.org/10.15309/17psd180204. Acesso em: 10 jul. 2020.
- Datye, KA et al. A review of adolescent adherence in type 1 diabetes and the untapped potential of diabetes providers to improve outcomes. Current Diabetes Reports, [s. l.], v. 15, n. 8, p. 51, 2015. doi:10.1007/s11892-015-0621-6 21.
- Whittemore, R. et al. Correlates of depressive symptoms in adolescents with type 1 diabetes. Pediatric Diabetes, [s. l.], v. 3, n. 3, p. 135-143. 2002.
- Gomes, MB; et al. Adherence to insulin therapeutic regimens in patients with type 1 diabetes. A nationwide survey in Brazil. Diabetes Research and Clinical Practice, [s. l.], v. 120, p. 47-55, 2016.
- Bolli, GB. Insulin treatment in type 1 diabetes. Endocrine Practice, [s. l.], v. 12, n. 1, p. 105-109, 2006.
- Bangstad, HJ. et al. Insulin treatment in children and adolescents with diabetes. Pediatric Diabetes, [s. l.], v. 12, p. 82-99, 2009. Suppl 10.
- Tamborlane, WV, Sikes, KA. Insulin therapy in children and adolescents. Endocrinology and Metabolism Clinics of North America, [s. l.], v. 41, n. 1, p. 145-160, Mar. 2012.
- Subramanian S et al. The Management of Type 1 Diabetes. In: Feingold, KR et al. (eds.). Endotext. South Dartmouth: MDText.com Inc., 2016. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK279114/.
- Dewitt, DE & HIRSCH, I. B. Outpatient insulin therapy in type 1 and type 2 diabetes. JAMA, [s. l.], v. 289, p. 2254-2264, 2003.
- Malerbi, D et al. Brazilian Diabetes Society consensus statement-intensive insulin therapy and insulin pump therapy. Arquivos Brasileiros de Endocrinologia & Metabologia, São Paulo, v. 50, n. 1, p. 125-135, 2006.
- Melo, KFS et al. Short-acting insulin analogues versus regular human insulin on postprandial glucose and hypoglycemia in type 1 diabete melito: a systematic review and meta-analysis. Diabetology & Metabolic Syndrome, [s. l.], v. 11, p. 2, Jan. 2019.
- Sociedade Brasileira de Diabetes. Manual de contagem de carboidratos para pessoas com diabetes. São Paulo: SBD, 2016. Disponível em: http://www.diabetes.org.br/publico/images/manual-de-contagem-de-carboidrato2016.pdf.
- Sociedade Brasileira de Diabetes. APP oficial e atualizado de Contagem de Carboidrato da SBD. 2019. Disponível em: https://www.diabetes.org.br/profissionais/app-oficial-e-atualizado-de-contagem-de-carboidrato-da-sbd.
- Devries, JH et al. Day-to-day fasting selfmonitored blood glucose variability is associated with risk of hypoglycaemia in insulin-treated patients with type 1 and type 2 diabetes: A posthoc analysis of the SWITCH Trials. Diabetes, Obesity and Metabolism, [s. l.], v. 21, n. 3, p.622-630, Mar. 2019.
Cite este artigo
Karla F S de Melo, Bianca de Almeida-Pittito e Hermelinda Cordeiro Pedrosa. Tratamento do Diabetes Mellitus Tipo 1 no SUS. Diretriz Oficial da Sociedade Brasileira de Diabetes (2023). DOI: 10.29327/5238993.2023-12, ISBN: 978-85-5722-906-8.