Autores: Wellington S. Silva Júnior, Cynthia Melissa Valério, João Marcello de Araujo-Neto, Amélio F. Godoy-Matos
Editor-Chefe: Marcello Bertoluci
Última revisão em: 16/01/2024
DOI: 10.29327/5412848.2024-8 | Cite este Artigo
Introdução
A doença hepática esteatótica metabólica (DHEM) é a doença mais comum do fígado, afetando 30% da população mundial.1 Compreende um espectro de manifestações hepáticas associadas a distúrbios metabólicos e cardiovasculares, como obesidade e/ou distribuição desfavorável de gordura, resistência à insulina, hipertensão arterial, dislipidemia e diabetes tipo 2 (DM2). A DHEM é reconhecida como a manifestação hepática da síndrome metabólica2 e a sua fisiopatologia atual está representada na Figura 1.
Figura 1. Fisiopatologia da doença hepática esteatótica metabólica (DHEM).
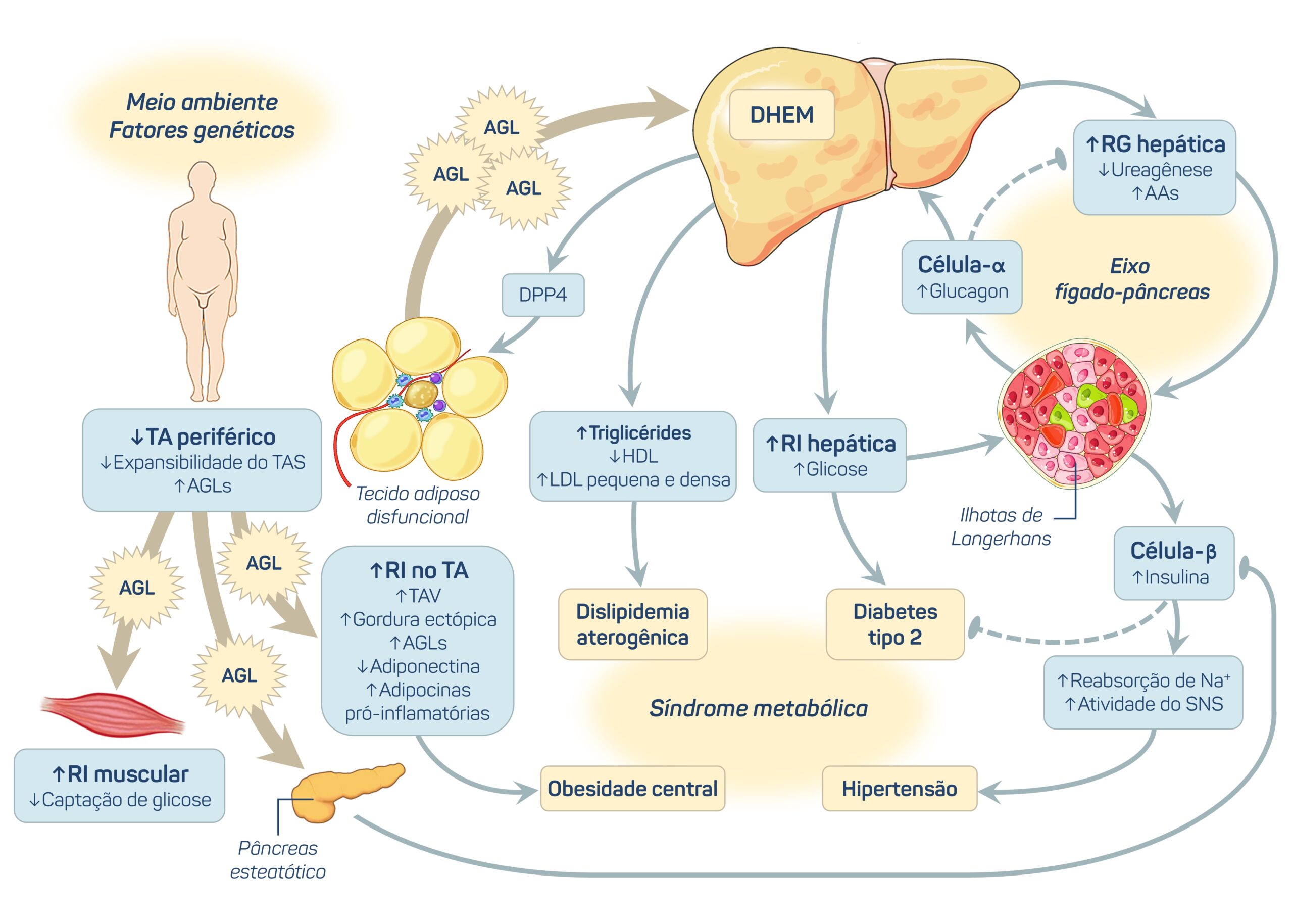
Diabetes é um fator de risco importante para a DHEM.3 A prevalência global da DHEM em pessoas com diabetes tipo 2 aumentou em 23,2%, atingindo 68,81% de 2016-2021.4 Além disso, o DM2 parece acelerar a progressão da doença hepática.3
Curiosamente, um estudo prospectivo em adultos com diabetes tipo 1 (DM1) e DM2 submetidos à biópsia hepática demonstrou que as pessoas com DM1 apresentaram risco de desenvolver cirrose e hipertensão portal semelhante ao observado nos indivíduos com DM2 após ajuste para potenciais variáveis de confusão.5 A DHEM afeta cerca de ∼30–40% dos adultos com DM1,6 e está associada a um aumento de risco de doença renal crônica e retinopatia nessa população.7
Definições
A DHEM é caracterizada pelo aumento do conteúdo de gordura no fígado (ultrapassando 5% do parênquima hepático)2,8 e pode ser classificada como esteatose (quando há apenas excesso de gordura no fígado, com mínima inflamação) ou esteato-hepatite (quando há inflamação lobular e balonização de hepatócitos, com ou sem fibrose).9
Pessoas com esteato-hepatite podem evoluir com diferentes graus de fibrose, progredir para cirrose (5%) e apresentar complicações como hipertensão portal ou carcinoma hepatocelular. Entre os que desenvolvem cirrose, o risco de hepatocarcinoma é estimado entre 5% e 30%, a depender de fatores demográficos e clínicos, como etiologia e estágio da doença hepática.10
Médicos que tratam de pessoas com DHEM devem estar atentos à forte associação dessa condição com as doenças cardiometabólicas, incluindo a doença cardiovascular aterosclerótica.11 A associação entre DHEM e doença cardiovascular está bem estabelecida, constituindo a principal causa de morbimortalidade na população com DHEM. Em uma metanálise de 16 estudos observacionais12, com 34.043 indivíduos nos quais a DHEM foi diagnosticada por biópsia hepática e métodos de imagem, demonstrou-se a associação da DHEM com aumento de risco de 36% para eventos cardiovasculares fatais e não fatais (razão de chances ou odds ratio [OR] 1,64; intervalo de confiança [IC] 95% 1,26-2,13). O maior risco de eventos cardiovasculares foi diretamente associado à gravidade da DHEM (OR 2,58; IC 95% 1,78-3,75) e permaneceu significativo após ajustes para outros fatores de risco. Considerando a fisiopatologia comum, os potenciais fatores etiológicos e alta taxa de eventos cardiovasculares nas pessoas com DHEM, um manejo abrangente do risco cardiometabólico se faz necessário nessa população, preferencialmente sob uma abordagem multidisciplinar.11
Nova nomenclatura e classificação
Os termos “doença gordurosa não alcoólica do fígado” (non-alcoholic fatty liver disease [NAFLD]) e “esteato-hepatite não alcoólica” (non-alcoholic steatohepatitis [NASH]) surgiram na década de 80, com a finalidade de descrever a histologia hepática de uma série de pacientes com esteato-hepatite avançada não associada ao consumo de álcool. A partir de então, esses acrônimos foram extrapolados para descrever o espectro da própria doença, o que acabou despertando algumas críticas.13 Primeiro, porque informavam mais sobre o que essa condição clínica não era (alcoólica) do que sobre a sua verdadeira natureza (metabólica). Segundo, porque muitos pacientes com esteatose predominantemente metabólica também ingeriam álcool, muitas vezes de forma errática.
Em um avanço no sentido de reconhecer a verdadeira etiopatogenia da esteatose hepática, um consenso internacional de experts8 propôs um novo sistema de classificação para essa doença. Além disso, o consenso sugeriu que o termo NAFLD fosse substituído por “doença gordurosa do fígado associada à disfunção metabólica” (metabolic [dysfunction]-associated fatty liver disease [MAFLD]). Seguindo esta linha, em 2021, a Sociedade Brasileira de Diabetes pioneiramente utilizou o termo “doença hepática gordurosa metabólica” (DHGM) para descrever essa entidade em sua diretriz14, reconhecendo que, mais do que “associada a disfunções metabólicas”, a doença esteatótica do fígado é per se metabólica. Para isso, adotou os mesmos critérios previamente definidos para a MAFLD.
Embora essa mudança na nomenclatura tenha sido bem aceita pela comunidade médica no Brasil, o termo “gorduroso” ainda era percebido de forma pejorativa internacionalmente, em decorrência de possíveis implicações estigmatizantes na percepção dos pacientes e da sociedade em geral sobre essa condição. Além disso, esta mudança ainda não possibilitava uma classificação adequada dos pacientes, comprometendo o caminho para uma medicina personalizada e para melhores ensaios clínicos. Assim, em 2023, um novo consenso proposto por diversas sociedades internacionais foi publicado15, estabelecendo uma nova classificação e nomenclatura para a doença hepática esteatótica, conforme o esquema apresentado nas Figuras 2 e 3.
Figura 2. Subclassificação da doença hepática esteatótica (DHE).
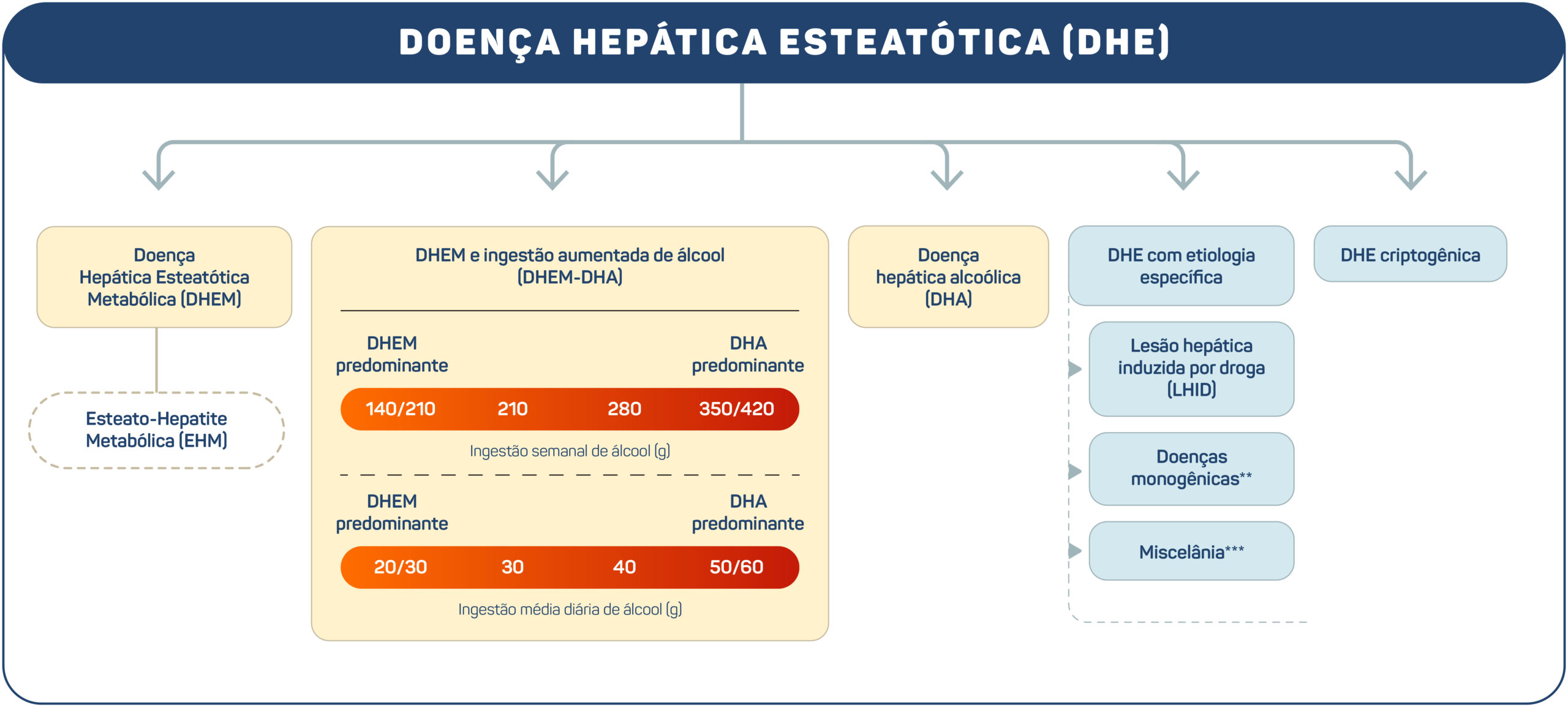
Figura 3. Critérios diagnósticos da DHEM.
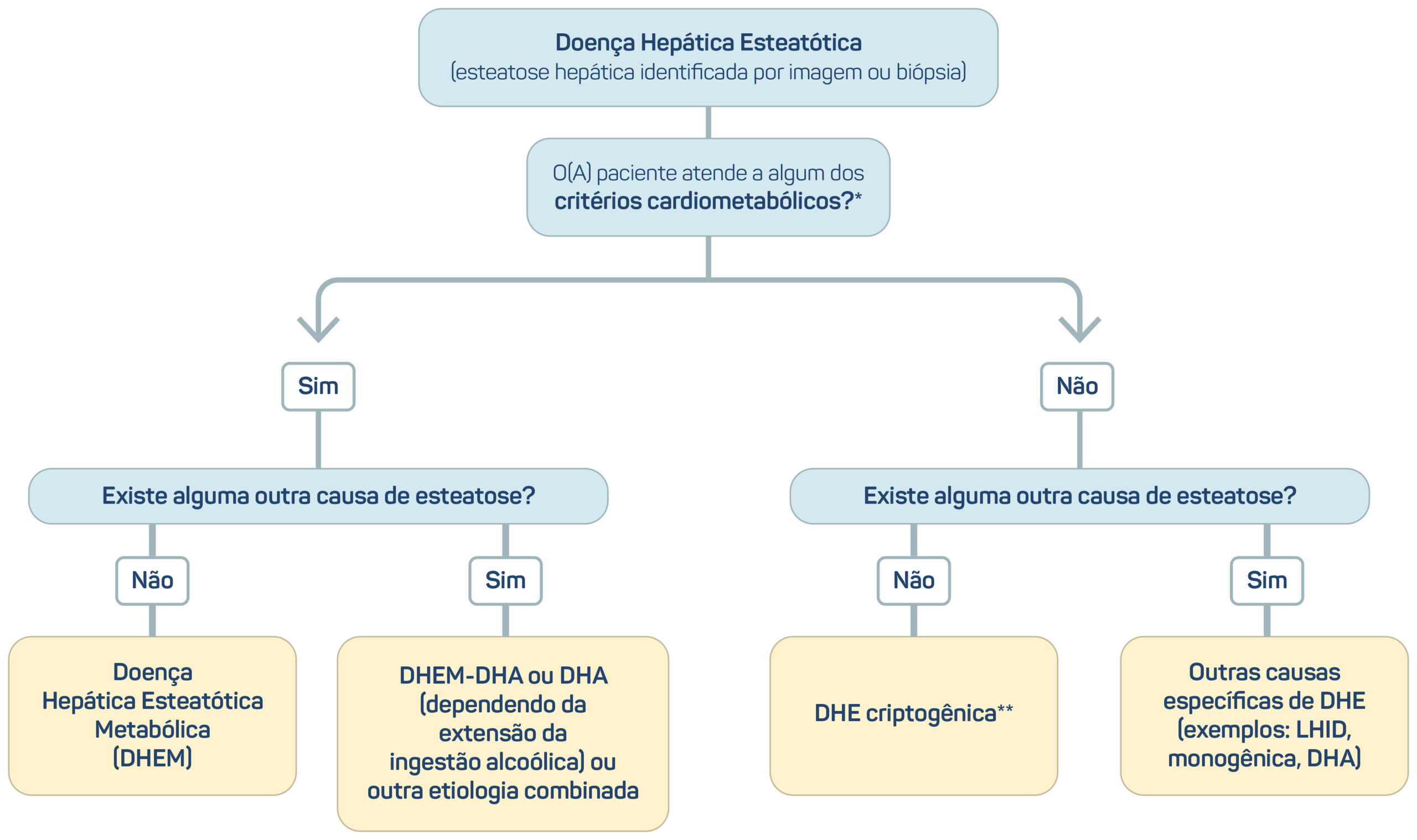
Em resumo, o termo “doença hepática esteatótica” (DHE) passou a caracterizar as mais variadas etiologias da gordura no fígado, e o termo “esteato-hepatite” foi mantido. A presença da DHE associada a pelo menos um de cinco fatores de risco cardiometabólicos passou a ser denominada “doença hepática esteatótica metabólica” (DHEM, uma versão simplificada em português para “metabolic dysfunction-associated steatotic liver disease” [MASLD]), e o subgrupo desses pacientes que consomem quantidades significativas de álcool foi denominado “DHEM-DHA”. Essa subcategoria permite estabelecer uma distinção entre os indivíduos com a DHEM pura e a “DHA” (doença hepática alcoólica) pura. O acrônimo “EHM” caracteriza a DHEM acompanhada de esteato-hepatite, e a “DHE criptogênica” define a DHE em pessoas sem fatores de risco cardiometabólicos e sem uma etiologia conhecida para a doença hepática.15
A nova nomenclatura oferece uma oportunidade para reunir os especialistas e a comunidade científica, desencadeando novas pesquisas para compreender melhor a epidemiologia, a história natural, o diagnóstico, os biomarcadores e as estratégias de manejo em todo o espectro da DHE.16 Destaca-se que a mudança de NAFLD ou MAFLD para DHEM leva a taxas de incidência da respectiva doença hepática esteatótica bastante semelhantes. No amplo estudo epidemiológico ELSA-Brasil, que incluiu dados de 10.651 indivíduos, a prevalência geral de NAFLD, MAFLD e DHEM foi de 34,7% (IC 95% 33,8-35,6; n = 3.697), 34,9% (IC 95% 34,0-35,8; n = 3.718) e 33,4% (IC 95% 32,6-34,4; n = 3.569), respectivamente.17
Unindo-se à comunidade internacional nos esforços de estabelecer critérios diagnósticos e nomenclatura cientificamente mais adequados e menos estigmatizantes, e difundi-los globalmente, a SBD também passa a adotar as novas denominações para o espectro da doença esteatótica do fígado nesta diretriz em português e na sua versão em inglês18. Doravante, as novas designações serão utilizadas para se referir a todos os estudos, inclusive aqueles que utilizavam as classificações e nomenclaturas anteriores.
Rastreio e manejo
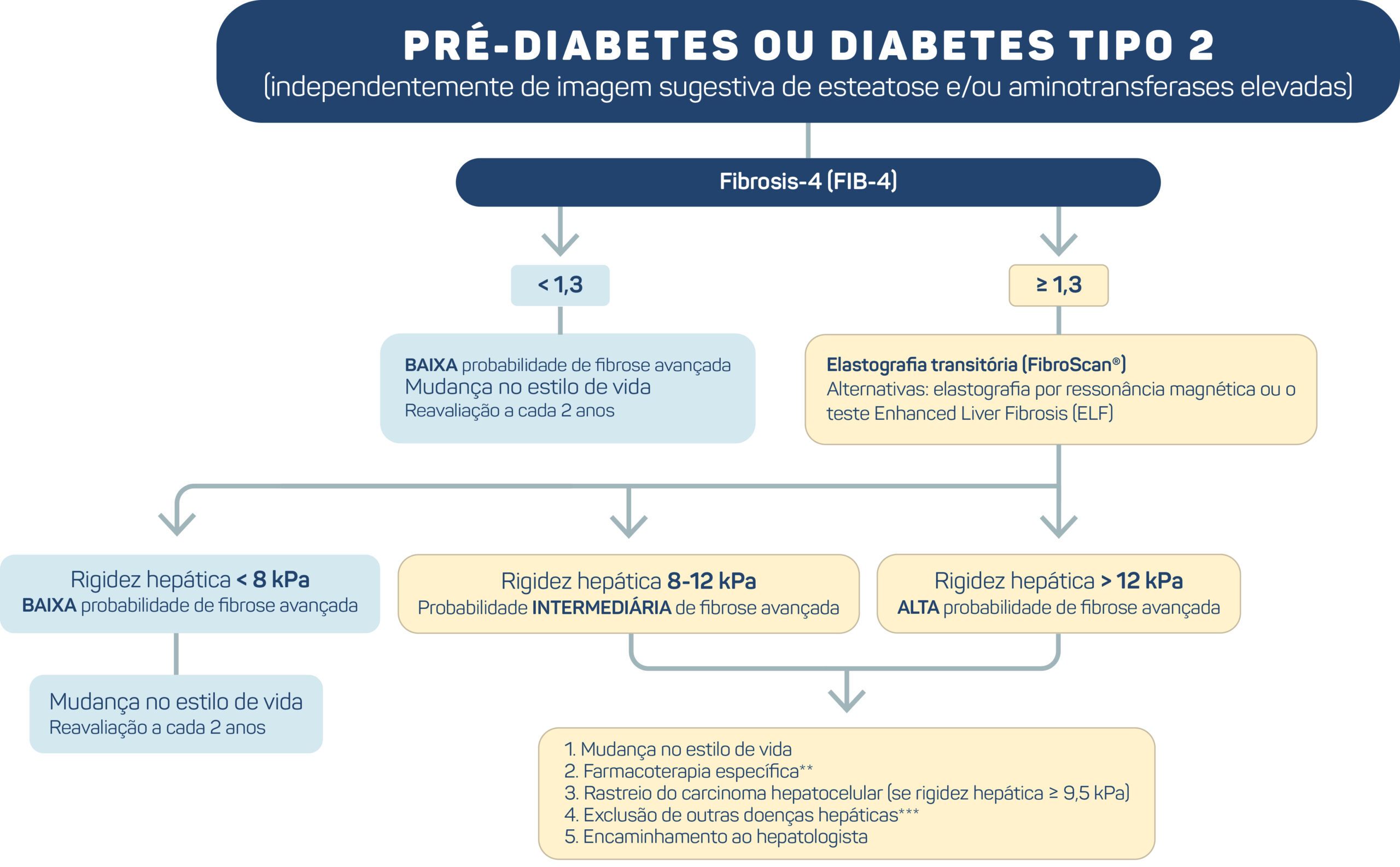
A estratégia para rastreio e manejo da DHEM em pessoas com pré-diabetes ou DM2 está detalhada na Figura 4 e no Quadro 1, e é abordada nas recomendações a seguir. Há ampla heterogeneidade nos desfechos hepáticos e em suas formas de aferição entre os estudos que avaliam intervenções para melhorar a DHEM, incluindo parâmetros histológicos (esteatose, esteato-hepatite e fibrose), exames de imagem/não invasivos, testes bioquímicos e variáveis clínicas. Ao discutir as evidências que apoiam cada uma das recomendações seguintes, o painel buscou priorizar estudos com desfechos baseados na histologia hepática, sempre que disponíveis, tais como resolução da esteato-hepatite sem piora da fibrose, melhora de pelo menos um estágio da fibrose e resolução da esteato-hepatite com melhora de fibrose.
Figura 4. Rastreio e manejo da DHEM em pessoas com pré-diabetes ou diabetes tipo 2.
Quadro 1. Testes laboratoriais para o diagnóstico diferencial da DHEM.
| Testes laboratoriais para o diagnóstico diferencial da DHEM. |
|
Anti-HBc IgG Anti-HBs HBsAg Anti-HCV Ceruloplasmina FAN Ferritina Saturação de transferrina Anticorpo Anti-mitocôndria Anticorpo Anti-músculo liso Anti-LKM1 Alfa1 Anti-tripsina Anticorpo Anti-transglutaminase tecidual IgA IgA e IgG séricas |
Abreviações: Anti-HBc: anticorpo contra o “core” (núcleo) do vírus da hepatite B; Anti-HBs: anticorpo contra o antígeno de superfície da hepatite B; Anti-HCV: anticorpo anti-hepatite C; Anti-LKM1: anticorpo contra a fração microssomal-1 do fígado e rim; FAN: fator antinuclear; HBsAg: antígeno de superfície da hepatite B; IgA: imunoglobulina A; IgG: imunoglobulina G.
Recomendações
R1. O rastreio para avaliação do risco de fibrose avançada associada à DHEM, inicialmente com escores laboratoriais clínicos como o Fibrosis-4 (FIB-4), É RECOMENDADO em todos os adultos com pré-diabetes ou diabetes tipo 2.
| Classe I | Nível B |
- O rastreio para avaliação do risco de fibrose avançada é recomendado em todos os adultos com pré-diabetes ou DM2, uma vez que a DHEM é altamente prevalente nessa população. Uma metanálise envolvendo 80 estudos, com dados de 49.419 indivíduos, evidenciou uma taxa de incidência de DHEM de 55,5% nas pessoas com DM2.3 De acordo com uma atualização recente desses dados, a incidência global da DHEM em pessoas com DM2 aumentou em 23,2% (p = 0,08), alcançando 68,81% de 2016-2021.4 As incidências combinadas de EHM e fibrose avançada (F3/F4) foram 66,44% e 15,49%, respectivamente.4
- Outra diretriz também recomenda o rastreio de fibrose avançada em populações de alto risco, que incluem pessoas com pré-diabetes ou DM2, uma vez que ambas as condições são fatores de risco importantes para mau prognóstico em pacientes com DHEM.19
- Escores clínico-laboratoriais, que incluem o FIB-4, o escore body mass index, aspartate aminotransferase/alanine aminotransferase ratio, diabetes (BARD), o aspartate aminotransferase-to-platelet ratio index (APRI) e o NAFLD fibrosis score (NFS) são úteis para a estratificação de risco de fibrose avançada (F3/F4).20,21 Dentre esses, o escore FIB-4 apresenta a melhor acurácia.21 Ele encontra-se disponível através do link: <https://www.hepatitisc.uw.edu/page/clinical-calculators/fib-4>.
- O FIB-4 é calculado a partir de dados clínicos e laboratoriais, que incluem idade, níveis de alanina aminotransferase (ALT), aspartato aminotrasferase (AST) e contagem de plaquetas.20 Com o ponto de corte de 1,3, o escore FIB-4 apresentou sensibilidade de 84,4% e especificidade de 68,5% para detecção de fibrose avançada.21 Porém, se o FIB-4 for < 1,3, descarta-se o risco de fibrose avançada, com um valor preditivo negativo (a probabilidade de que uma pessoa com um resultado de teste negativo esteja realmente livre de doença) de aproximadamente 91%.21 Pacientes classificados como de risco indeterminado ou alto de fibrose avançada devem ser acompanhados com outros métodos, conforme discutido a seguir.
R2. Em pessoas com pré-diabetes ou diabetes tipo 2 e FIB-4 ≥ 1,3 (sugerindo risco indeterminado ou alto de fibrose avançada), É RECOMENDADO a investigação adicional com elastografia transitória.
| Classe I | Nível B |
- A quantificação de fibrose e de esteatose pode ser realizada por elastografia hepática.22 A elastografia pode discriminar os seguintes estágios de fibrose: ausente ou leve (F0/F1), moderada (F2), avançada (F3) e cirrose (F4). Dentre as elastografias ultrassônicas, a elastografia hepática transitória (FibroScan®) constitui a tecnologia não invasiva mais validada atualmente.22
- Combinações sequenciais de marcadores com um ponto de corte mais baixo para descartar fibrose avançada e um ponto de corte mais alto para descartar cirrose podem reduzir a taxa de falsos negativos para fibrose avançada. De acordo com uma metanálise de dados individuais de pacientes de 37 estudos (n = 5.735; 33% com DM2), a combinação sequencial de FIB-4 (pontos de corte: < 1,3 e ≥ 2,67) e da aferição da rigidez hepática por elastografia transitória (pontos de corte: < 8,0 kPa e ≥ 10,0 kPa) tiveram sensibilidade e especificidade de 66% e 86%, respectivamente. Esta estratégia resultou numa taxa de falsos negativos de 9% para fibrose avançada.23 Pontos de corte superiores para determinar cirrose (por exemplo, 12,0 kPa) poderiam levar a uma diminuição adicional na necessidade de biópsias hepáticas.
- A elastoressonância magnética apresenta boa acurácia para quantificar gordura hepática e avaliar fibrose. No entanto, o alto custo e a baixa disponibilidade são limitações deste método.24
- Na escolha da modalidade de avaliação diagnóstica, deve-se considerar a disponibilidade local de cada método. Métodos não invasivos para pesquisa de EHM ainda não estão disponíveis.
Nota importante 1: Biópsia hepática
- A biópsia hepática é o método padrão-ouro para avaliação da esteatose, identificação de EHM e quantificação de fibrose. Por ser um método invasivo, com limitações relacionadas ao custo, reprodutibilidade e risco de complicações, deve ser considerada somente em pacientes cuja avaliação por métodos não invasivos foi duvidosa, especialmente quando houver dúvidas sobre a etiologia da doença hepática.25
R3. Modificação do estilo de vida com foco na redução do peso corporal ≥ 5% É RECOMENDADA como primeira escolha para o tratamento da DHEM em pessoas com pré-diabetes ou diabetes tipo 2.
| Classe I | Nível B |
- A perda de peso é a medida mais eficaz na melhora histológica da DHEM. Embora reduções em torno de 3% do peso corporal já resultem em melhora da DHEM, perdas a partir de 5% são necessárias para reduzir a inflamação e estabilizar a fibrose.26,27
- Há uma relação de dose-resposta entre e a perda de peso e a magnitude da melhora histológica. Reduções de peso ≥ 7%, quando sustentadas, podem resolver a DHEM em até 65% a 90% dos pacientes.20
- Vilar-Gomez et al28 avaliaram a histologia hepática de 293 indivíduos com DHEM tratada com modificação do estilo de vida (MEV). Perdas de mais de 10% do peso corporal promoveram redução do nonalcoholic fatty liver disease activity score (NAS) de 100%, resolução da DHEM de 90% e regressão de fibrose de 45%. Vale destacar que 66% desses indivíduos apresentavam alteração no metabolismo da glicose e que 33% tinham o diagnóstico de DM2.28
- No estudo Look AHEAD, incluindo pessoas com DM2, a redução média de 8% do peso com MEV diminuiu significativamente o conteúdo de gordura hepática, avaliada por ressonância magnética (RM), em comparação com o grupo controle.29
Nota importante 2: Atividade física
- O aumento da atividade física foi associado com redução de mortalidade por todas as causas e de mortalidade cardiovascular em indivíduos com DHEM.32
R4. Quando a modificação do estilo de vida for insuficiente para atingir a meta de perda de peso, o uso de medicamentos antiobesidade É RECOMENDADO em pessoas com diabetes tipo 2, DHEM e índice de massa corporal ≥ 27 kg/m².
| Classe I | Nível B |
- Nos indivíduos com DM2, DHEM e IMC ≥ 27 kg/m², quando as MEV não forem suficientes para promover a redução ponderal desejada, a adição de farmacoterapia para obesidade está recomendada.33
- Alguns dos medicamentos aprovados para tratamento da obesidade, isto é, orlistate34, liraglutida 3,0 mg/dia35 e semaglutida 2,4 mg/semana36,37, foram investigados em pessoas com DHEM e DM2.
- Em um ECR de 36 semanas, adultos com IMC ≥ 27 kg/m² e EHM comprovada por biópsia (n = 55; 7,2% com DM2) foram randomizados para receber dieta de 1.400 kcal/dia mais vitamina E (800 UI/dia) com ou sem orlistate (120 mg três vezes ao dia).34 No geral, o orlistate não aumentou a perda de peso nem melhorou as enzimas hepáticas, a resistência à insulina ou a histopatologia hepática. Além disso, os indivíduos que perderam ≥ 5% do peso corporal apresentaram melhora na resistência à insulina e na esteatose, e aqueles que perderam ≥ 9% também obtiveram melhora na esteatose (p < 0,01), balonização (p < 0,05), inflamação (p < 0,05) e no NAS (p < 0,01).34
- A liraglutida 3,0 mg/dia promoveu redução de peso de 8,0% ± 6,7%, com 63% dos pacientes atingindo pelo menos 5% de perda ponderal.35,38 Liraglutida também reduziu a disfunção metabólica, a resistência à insulina e a lipotoxicidade, sugerindo que alguns dos efeitos na DHEM possam ocorrer independentemente da perda de peso.39
- Uma revisão sistemática e metanálise foram realizadas para avaliar a eficácia e segurança da semaglutida em pacientes com DHEM; oito estudos (dados de 2.413 participantes) foram incluídos. A semaglutida em diferentes doses (até 2,4 mg uma vez por semana, a dose aprovada para o tratamento da obesidade) melhorou a ALT (desfecho primário) e reduziu o conteúdo de gordura hepática (diferença média 4,97%; p < 0,001) e rigidez hepática (diferença média 0,96 kPa; p = 0,04).36 A heterogeneidade foi moderada a alta em todas as comparações, e os sintomas gastrointestinais e doenças relacionadas à vesícula biliar foram maiores durante o tratamento com semaglutida em comparação ao placebo (RR 1,54; IC 95% 1,02-2,34; p = 0,04).36 É importante ressaltar que esta metanálise incluiu o primeiro ECR avaliando o efeito da semaglutida 2,4 mg/semana vs. placebo na cirrose desencadeada por EHM.37 Neste estudo, o desfecho primário de melhora na fibrose sem piora da EHM não foi alcançado, apesar da melhora significativa na esteatose (medida por RM), aminotransferases, peso e hemoglobina A1c com semaglutida vs. placebo. Nenhuma nova preocupação relativa à segurança foi levantada.37
Nota importante 3: Antidiabéticos
- Em pessoas com DM2 e DHEM que apresentam evidência de EHM e/ou fibrose, o uso de farmacoterapia específica para o DM2 com ação na DHEM deve ser considerado em combinação com a MEV para a melhora de desfechos hepáticos. A pioglitazona e os agonistas do receptor do peptídeo-1 semelhante ao glucagon com benefícios comprovados na DHEM são as terapias de 1ª linha, de acordo com as evidências descritas abaixo e listadas no Quadro 2.É importante destacar que a metformina não está associada a benefícios específicos relacionados à DHEM. Em dez estudos randomizados envolvendo a metformina, apenas dois pequenos estudos incluíram avaliação antes e depois do tratamento. Nesses dois estudos, apesar da melhora do controle glicêmico, houve redução apenas modesta de enzimas hepáticas e da balonização em relação ao placebo, e não houve benefícios sobre a rigidez hepática, um marcador de fibrose.40 Além disso, em uma metanálise de cinco estudos envolvendo pessoas com DM2 e DHEM,41 a metformina não levou à melhora nos parâmetros inflamatórios, radiológicos e histológicos relacionados à DHEM, apesar de promover redução de peso e da hemoglobina A1c.
Quadro 2. Principais estudos avaliando farmacoterapia específica para o DM2 com benefícios na DHEM.
|
Intervenção (dose diária) |
Efeito | Tempo | Ref |
| PIOGLITAZONA | |||
| 45 mg |
Redução da GH (58% vs. 17% no grupo PLB); Resolução da EHM em 51%; Melhora do escore de fibrose observado na BxHep |
36 m | 44 |
| 30 a 45 mg |
Melhora de fibrose (F3-F4 para F0-F2); Resolução de EHM na BxHep |
6-24 m | 45 |
| 30 a 45 mg | Redução do escore de atividade da doença (NAS) na avaliação por BxHep |
A cada 6 m |
46 |
| AGONISTAS DE RECEPTOR DE GLP-1 (AR GLP-1) | |||
| Liraglutida 1,8 mg | Resolução da EHM sem piora da fibrose na BxHep | 48 sem | 48 |
| Semaglutida 0,4 mg | Resolução da EHM sem piora da fibrose na BxHep | 72 sem | 51 |
| INIBIDORES DE SGLT2 * | |||
| Empagliflozina 10 mg |
Redução de GH avaliada por RM (-4,0% vs PLB); Melhora da ALT |
20 sem | 56 |
|
Dapagliflozina 10 mg + ômega 3 |
Redução de GH avaliada por RM (-21% vs PLB); Melhora de biomarcadores e enzimas hepáticas (grupo dapagliflozina em monoterapia) |
12 sem | 59 |
|
Canagliflozina 100/300 mg |
Melhora de EHM vs PLB ou comparador ativo (metanálise com n = 6745); Estudo menor com melhora de inflamação lobular, balonização e fibrose (n = 9) |
26 a 52 sem |
60, 61 |
*Até o momento, não existem estudos avaliando desfechos histológicos hepáticos com o uso de inibidores de SGLT2.Abreviações: ALT: alanina aminotransferase; BxHep: biópsia hepática; EH: enzimas hepáticas; EHM: esteato-hepatite metabólica; GH: gordura hepática; GLP-1: peptídeo-1 semelhante ao glucagon; NAS: nonalcoholic fatty liver disease activity score; PLB: placebo; RM: ressonância magnética; SGLT2: cotransportador-2 de sódio-glicose.
R5. A pioglitazona É RECOMENDADA como tratamento de primeira linha para esteato-hepatite e/ou fibrose em pessoas com diabetes tipo 2.
| Classe I | Nível A |
- Embora não existam estudos de comparação direta do efeito de medicamentos antidiabéticos sobre desfechos relacionados à DHEM, como cirrose e mortalidade, a maioria dos estudos que comparam a pioglitazona com o placebo demonstram benefícios na inflamação e nas alterações histológicas.42
- Em uma revisão sistemática e metanálise de seis ensaios clínicos randomizados (ECRs) envolvendo pessoas com DM2 (n = 332), avaliou-se o efeito da pioglitazina e outras tiazolidinedionas (TZDs) vs. placebo ou sulfonilureias em pacientes com DHEM. Comparadas ao placebo, as TZDs reduziram a gordura hepática em 6,6% (12,56%-0,96%; p = 0,022, I² = 0%).43
- Através de um ECR envolvendo 101 pessoas com DM2 ou pré-diabetes e com DHEM comprovada por biópsia, demonstrou-se redução de 58% na gordura hepática (p < 0,001), além de melhora da balonização, da inflamação e do escore de fibrose (diferença de tratamento: -0,5; 0,9-0,0; p = 0,039) com o uso de pioglitazona 45 mg, em comparação com placebo.44 O estudo, inicialmente desenhado para 18 meses de seguimento, demonstrou que a melhora histológica e metabólica persistiu após 36 meses de tratamento. Os eventos adversos não foram diferentes entre os grupos, à exceção do ganho de peso (+2,5 kg) no grupo que usou a pioglitazona.
- O resultado de uma metanálise de oito estudos com TZDs, envolvendo indivíduos com e sem DM2, sugere que esses agentes possam reduzir a fibrose avançada (OR 3,15; IC 95% 1,25-7,93; p = 0,01; I² = 0%) e resolver a DHEM (OR 3,22; IC 95% 2,17-4,79; p < 0,001; I² = 0%). A significância deste efeito foi restrita à pioglitazona, e os resultados mantiveram-se similares mesmo após a exclusão dos ECRs em pessoas com DM2.45
- Uma metanálise em rede comparou o efeito de diferentes tratamentos para EHM, incluindo 48 ECRs e estudos prospectivos. O desfecho primário foi a redução do escore NAS de atividade de doença com o uso de várias drogas com potencial efeito na DHEM. O tratamento mais efetivo, em termos de redução do escore NAS por semestre, foi a pioglitazona (-1,50; IC 95% -2,08 a -1,00). A pioglitazona foi o melhor tratamento para esteatose e para a redução da inflamação lobular.46
- Cabe ressaltar que outros fatores devem ser considerados antes de se optar pelo uso da pioglitazona para o tratamento de pessoas com EHM com ou sem fibrose, tais como o potencial ganho de peso, o risco de fraturas ósseas e a presença de insuficiência cardíaca.
R6. Os agonistas do receptor do peptídeo-1 semelhante ao glucagon (AR GLP-1) com benefício comprovado na DHEM SÃO RECOMENDADOS como tratamento de primeira linha para esteato-hepatite em pessoas com diabetes tipo 2.
| Classe I | Nível A |
- Até o momento, não existem evidências de que os AR GLP-1 melhorem a fibrose hepática. Entretanto, esses agentes promovem benefícios histológicos na DHEM, incluindo redução da inflamação sem piora da fibrose.48,49,51,52 Além disso, o papel do AR GLP-1 no tratamento da DHEM não é totalmente compreendido. Alguns estudos evideniaram melhorias em marcadores inflamatórios hepáticos e alterações histológicas associadas à inflamação, mas não é possível determinar se estes efeitos são independentes ou secundários à perda de peso.
- Em uma metanálise de estudos de 26 semanas, com dados de mais de 4.000 pessoas com DM2, comparou-se a liraglutida na dose de 1,8 mg/dia com placebo. A liraglutida reduziu as enzimas hepáticas significativamente, de maneira dose-dependente.47
- O estudo LEAN foi um ECR de 48 semanas, multicêntrico, duplo-cego, controlado por placebo, em pessoas com DM2 e DHEM diagnosticada através de biópsia hepática. O desfecho primário foi a resolução da DHEM sem piora da fibrose. Nove (39%) de 23 pessoas com liraglutida e duas (9%) de 22 pessoas com placebo atingiram o desfecho primário (razão de risco [RR] 4,3; IC 95% 1,0-17,7; p = 0,019). Dois participantes (9%) do grupo liraglutida vs. oito participantes (36%) do grupo placebo tiveram progressão da fibrose (RR 0,2; IC 95% 0,1-1,0; p = 0,04).48
- Em uma revisão sistemática de ECRs, evidenciou-se que os agonistas do receptor de GLP-1 de curta ação reduzem as enzimas hepáticas e melhoram a imagem e/ou histologia da DHEM.49
- Um estudo de desfechos cardiovasculares de 104 semanas em pessoas com DM2 encontrou reduções significativas na ALT e na proteína C reativa ultrassensível com semaglutida injetável em comparação com placebo.50
- Um ECR de fase 2 com a semaglutida vs. placebo, com duração de 72 semanas, incluiu 320 pessoas com DHEM e fibrose (F1 a F3) comprovadas por biópsia hepática. O desfecho primário foi a resolução da EHM, sem piora da fibrose. A análise dos indivíduos com fibrose F2/F3 demonstrou que a semaglutida subcutânea foi significativamente superior e resolveu a EHM em 40%, 36% e 59% dos indivíduos, nas doses diárias de 0,1 mg, 0,2 mg e 0,4 mg, respectivamente, em comparação com 17% no grupo placebo (OR 6,87; IC 95% 2,60-17,63; p < 0,001 para a dose de 0,4 vs. placebo). Nesse estudo, 222 dos participantes (69%) apresentavam DM2, e os resultados nesse subgrupo foram similares aos do subgrupo de participantes sem DM.51
- Uma revisão sistemática identificou 11 ECRs que examinaram o uso do AR GLP-1 em pacientes com DHEM, totalizando 936 indivíduos (70% com DM2). Após 26 semanas de tratamento, os AR GLP-1 promoveram melhora nas enzimas hepáticas (especialmente ALT), redução na gordura hepática estimada por RM (-3,92%; IC 95% -6,27 a -1,56) e melhora na inflamação sem piora da fibrose (OR 4,06; IC 95% 2,52–6,55; I² = 0%, apenas para semaglutida e liraglutida).52
- Uma metanálise em rede examinou a eficácia a longo prazo de formulações diárias e semanais de AR GLP-1 em pessoas com DHEM e DM2.53 Quatorze ECRs foram analisados, incluindo dados de 1.666 participantes. Os desfechos primários foram conteúdo de gordura hepática e níveis de AST e ALT; os desfechos secundários incluíram perda de peso e níveis de gama glutamiltransferase (GGT). A superfície sob a curva de classificação cumulativa (SUCRA) foi utilizada para classificar as intervenções. A exenatida duas vezes ao dia ficou em primeiro lugar (SUCRA 68%) para melhora da esteatose hepática e a semaglutida semanal ficou em segundo lugar (SUCRA 60%). Para melhora nos níveis de AST e de ALT, a semaglutida uma vez ao dia foi a mais eficaz (SUCRA 100% e 96,5%, respectivamente); para perda de peso, a semaglutida semanal foi a mais eficaz (SUCRA 99,8%). Em geral, as preparações diárias pareceram melhores para a DHEM, e a semaglutida diária pode ser o tratamento mais eficaz para a DHEM e o DM2 em comparação com liraglutida, dulaglutida, exenatida ou placebo. Foram incluídos poucos estudos avaliando preparações semanais, o que pode ter limitado os resultados.53
R7. Os inibidores do cotransportador-2 de sódio-glicose (SGLT2) PODEM SER CONSIDERADOS para o tratamento da DHEM em pessoas com diabetes tipo 2 que apresentam esteato-hepatite e/ou fibrose.
| Classe IIb | Nível B |
- Estudos de desfechos relacionados à DHEM com inibidores de SGLT2 são escassos. Houve redução de enzimas hepáticas e redução da rigidez hepática por elastografia em estudos pequenos.54
- Uma revisão sistemática incluindo dados de quatro ECRs e quatro estudos observacionais com duração de pelo menos 12 semanas avaliou o efeito dos inibidores de SGLT2 sobre as enzimas hepáticas de pessoas com DM2 e DHEM.55 Houve diminuição significativa da ALT em sete estudos, e a maioria deles evidenciou reduções nos níveis de AST e GGT. Os inibidores de SGLT2 foram associados à redução significativa no conteúdo de gordura hepática e, entre os três estudos que avaliaram os índices de fibrose hepática, melhora significativa foi evidenciada em dois deles.55
- No estudo E-LIFT, cinquenta pessoas com DHEM e DM2 foram aleatoriamente designadas para receber a empagliflozina (10 mg/dia) ou manter o tratamento padrão por 20 semanas. A empagliflozina reduziu o conteúdo de gordura do fígado, avaliado por RM, e melhorou os níveis de ALT, mas não os níveis de GGT e AST.56
- Os resultados de ECRs em indivíduos com DM2 mostraram redução consistente nas aminotransferases com a empagliflozina, em um padrão (reduções na ALT > AST) consistente com a redução no conteúdo de gordura hepática, independentemente de mudanças no peso ou na hemoglobina A1c.57
- Um ECR aberto avaliou o uso de dapagliflozina vs. tratamento padrão por 24 semanas em pessoas com DM2 e DHEM. Houve melhora significativa na ALT, GGT e rigidez hepática avaliada por elastografia no grupo dapagliflozina. A dapagliflozina também reduziu a AST e atenuou a fibrose em um subgrupo de pessoas com fibrose hepática significativa (medida de rigidez hepática ≥ 8,0 kPa).58
- O estudo EFFECT-II investigou os efeitos da dapagliflozina (10 mg/dia), do ômega-3 e da combinação de ambos, em comparação com placebo, sobre o conteúdo de gordura hepática avaliado por RM em indivíduos com DM2 e DHEM ao longo de 12 semanas. Todos os tratamentos ativos reduziram significativamente o conteúdo de gordura hepática em comparação com o basal, mas apenas a combinação reduziu o conteúdo de gordura hepática (p = 0,046) e o volume total de gordura hepática (p = 0,037) em comparação com placebo. A monoterapia com dapagliflozina, mas não a combinação, reduziu os níveis de alguns biomarcadores de lesão hepatocitária, incluindo ALT, AST e GGT.59
- Uma revisão sistemática e metanálise de ECRs avaliou os efeitos da canagliflozina (100 mg/dia ou 300 mg/dia) sobre as enzimas hepáticas em pessoas com DM2. Onze estudos controlados com placebo ou com controlador ativo foram selecionados (n = 6.745). A canagliflozina diminuiu significativamente as concentrações séricas de ALT, AST e GGT após 26 semanas e 52 semanas, sugerindo um efeito benéfico no fígado.60 Além disso, em um pequeno estudo prospectivo não controlado, nove pessoas com DHEM e DM2 foram submetidas a biópsias hepáticas no início e após 24 semanas de tratamento com canagliflozina (100 mg/dia). Houve melhora histológica em todos os indivíduos. As pontuações de esteatose, inflamação lobular, balonização e estágio de fibrose diminuíram, respectivamente, em 78%, 33%, 22% e 33% na 24ª semana, em comparação com o período basal.61
R8. A combinação de agentes antidiabéticos com benefícios comprovados na DHEM PODE SER CONSIDERADA no tratamento de esteato-hepatite e/ou fibrose em pessoas com diabetes tipo 2.
| Classe I | Nível C |
- Esta recomendação é baseada na opinião de especialistas. A combinação terapêutica no DM2 é recomendada para se alcançar um controle glicêmico satisfatório. Seguindo esta linha, parece razoável combinar medicamentos que possam contribuir de forma aditiva ou sinérgica para a resolução da doença hepática em pessoas com DM2 que apresentam EHM e/ou fibrose. Portanto, o painel sugere que a combinação de pioglitazona com AR GLP-1 (de preferência) ou de um ou ambos com inibidores de SGLT2 pode ser considerada para pessoas com DM2 e DHEM que apresentam evidência de EHM e/ou fibrose, com base nos potenciais benefícios e na ausência de danos observados com a terapia combinada usada para controle glicêmico e para melhoria de desfechos hepáticos clínicos e laboratoriais62. A escolha da combinação de medicamentos deve considerar os benefícios no controle do diabetes, no controle do peso e nos desfechos cardiovasculares. Ensaios clínicos comparando a terapia combinada com os agentes usados em monoterapia para os desfechos histológicos do fígado estão em andamento.62
Nota importante 4: Vitamina E, pentoxifilina e silimarina
- Não há evidências suficientes para se recomendar o uso de vitamina E, pentoxifilina e silimarina para o tratamento da DHEM em pessoas com DM2.
No estudo PIVENS,63 realizado em pessoas com DHEM e sem DM2, o uso da vitamina E (800 UI/dia) por dois anos promoveu melhora do índice NAS em dois ou mais pontos, sem aumento na fibrose vs. placebo (43% vs. 19%, p < 0,001). Embora a suplementação da vitamina E seja considerada para DHEM em pessoas sem DM2, ensaios específicos em pessoas com DM2 ainda são necessários. Uma questão de segurança da vitamina E é que ela parece aumentar o risco de câncer de próstata em homens idosos.64
Em um pequeno ECR aberto, de centro único, incluindo 35 pacientes com EHM comprovada por biópsia (28% com DM2), pentoxifilina 400 mg três vezes ao dia durante 1 ano melhorou o escore NAS em comparação ao placebo (2,10 ± 1,07 vs. 0,90 ± 0,99; p < 0,001).65 A fibrose, entretanto, não melhorou, e mais dados obtidos de grandes séries de pacientes são necessários para avaliar a eficácia da pentoxifilina.Em um ECR duplo-cego, controlado por placebo, em pacientes com EHM comprovada por biópsia (n = 99; 53,5% com DM2), silimarina 700 mg três vezes ao dia durante 48 semanas não reduziu o desfecho primário de eficácia, ou seja, uma diminuição de 30% ou mais no NAS comparado ao placebo (32,7% vs 26,0%; p = 0,467).66
R9. Em pessoas com diabetes tipo 2, DHEM e índice de massa corporal ≥ 35 kg/m², a cirurgia bariátrica DEVE SER CONSIDERADA se a combinação de modificação do estilo de vida e farmacoterapia não tiver se mostrado eficaz para melhorar a DHEM.
| Classe IIa | Nível B |
- Em pessoas com obesidade classe III, DM2 mal controlado e resposta insatisfatória à MEV e ao tratamento medicamentoso, a cirurgia bariátrica é uma opção a ser considerada para reduzir o peso e as complicações metabólicas no longo prazo.67,68 Os benefícios da cirurgia bariátrica para a DHEM são consistentes em diversos estudos avaliando técnicas operatórias distintas, incluindo a gastrectomia vertical, a derivação gástrica em Y-de-Roux (DGYR) e a banda gástrica ajustável.69–71
- Em um estudo com 1.236 indivíduos com obesidade classe III, dentre os quais 32,6% apresentavam DM2, a DHEM melhorou tanto com a DGYR quanto com a banda gástrica ajustável. No entanto, a DGYR induziu maior perda de peso (26% vs. 21%) e trouxe mais benefícios sobre a DHEM, parâmetros glicêmicos e metabolismo lipídico, ainda que esse grupo DGYR tenha apresentado maior IMC e DHEM mais grave no período basal.69
- Uma coorte retrospectiva72 incluindo 252 pacientes com obesidade classe I e pelo menos uma comorbidade associada, como DHEM (n = 69) e/ou DM2 (n = 10). Ao longo de três anos de acompanhamento pós-operatório, houve remissão da DHEM em 84,6% dos pacientes. Houve ainda remissão do DM2 em 60% dos indivíduos e melhora do controle em 40% deles.
- Os procedimentos bariátricos proporcionam resolução a longo prazo da EHM e regressão da fibrose, conforme demonstrado em um estudo prospectivo de 5 anos incluindo 180 pacientes com obesidade grave e EHM comprovada por biópsia (71% com DM2).73 As biópsias hepáticas foram planejadas aproximadamente 1 ano e 5 anos após a cirurgia bariátrica. Ao final de 5 anos, a EHM foi resolvida sem agravamento da fibrose em 84% dos pacientes. Em comparação com o período basal, 70,2% dos pacientes apresentavam fibrose, que desapareceu em 56% dos pacientes. A resolução da EHM foi observada 1 ano após a cirurgia bariátrica em biópsias de 84% dos pacientes, sem ocorrência de recorrência significativa entre 1 e 5 anos (p = 0,17). A fibrose começou a diminuir 1 ano após a cirurgia e continuou diminuindo até 5 anos (p < 0,001). Deve-se destacar que, neste estudo, muito poucos pacientes apresentavam cirrose.73
- Em um estudo prospectivo, 66 pacientes com EHM acentuada (36 com fibrose avançada e 30 com alto grau de atividade sem fibrose avançada) foram submetidos à cirurgia bariátrica e concordaram com uma biópsia hepática de acompanhamento aos 6 ± 3 anos. A cirurgia bariátrica induziu grande melhora histológica: 29% dos pacientes apresentaram histologia normal na biópsia de acompanhamento, 74% tiveram resolução da EHM sem progressão da fibrose e 70% tiveram ≥ 1 estágio de regressão da fibrose. Apesar da resolução relacionada com EHM, a fibrose avançada persistiu em 47% dos pacientes. Esses pacientes tiveram menor perda de peso e menores taxas de remissão de hipertensão ou DM2.74
- O estudo BRAVES foi um ECR multicêntrico e aberto projetado para comparar cirurgia bariátrica ou metabólica (DGYR e gastroplastia vertical em manga [GV]) vs. intervenção no estilo de vida associada ao “melhor” tratamento clínico em pacientes com IMC de 30-55 kg/m² e EHM comprovada por biópsia (31,9% com DM2).75 De acordo com a análise por intenção de tratar, a resolução da EHM sem piora da fibrose (desfecho primário) foi significativamente maior nos grupos DGYR e GV (56% e 57%, respectivamente) do que no grupo MEV (16%; p < 0,0001). Em comparação ao grupo MEV, a probabilidade de resolução do EHM foi 3,60 vezes maior no grupo DGYR e 3,67 vezes maior no grupo GV. Vale ressaltar que, no grupo MEV (n = 96), havia apenas 34 pacientes em uso de pioglitazona e 34 pacientes em uso de liraglutida no início do estudo, e esses números permaneceram praticamente estáveis durante todo o período de seguimento.75
Nota importante 5: Cirurgia bariátrica e cirrose
- Pessoas com DM2, DHEM e cirrose devem ser avaliadas com cautela na indicação de cirurgia bariátrica, em função de relatos de casos de descompensação da insuficiência hepática. Uma avaliação cuidadosa da presença hipertensão portal é indicada em pacientes com cirrose antes da cirurgia bariátrica.76 A evidência de esplenomegalia associada à trombocitopenia e a presença de varizes gastroesofágicas na endoscopia são sinais substitutos de hipertensão portal clinicamente significativa e podem ser consideradas contraindicações relativas à cirurgia.
Quadro 3. Resumo das recomendações.
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1. O rastreio para avaliação do risco de fibrose avançada associada à DHEM, inicialmente com escores laboratoriais clínicos como o Fibrosis-4 (FIB-4), É RECOMENDADO em todos os adultos com pré-diabetes ou diabetes tipo 2. | I | B |
| R2. Em pessoas com pré-diabetes ou diabetes tipo 2 e FIB-4 ≥ 1,3 (sugerindo risco indeterminado ou alto de fibrose avançada), É RECOMENDADO a investigação adicional com elastografia transitória. | I | B |
| R3. Modificação do estilo de vida com foco na redução do peso corporal ≥ 5% É RECOMENDADA como primeira escolha para o tratamento da DHEM em pessoas com pré-diabetes ou diabetes tipo 2. | I | B |
| R4. Quando a modificação do estilo de vida for insuficiente para atingir a meta de perda de peso, o uso de medicamentos antiobesidade É RECOMENDADO em pessoas com diabetes tipo 2, DHEM e índice de massa corporal ≥ 27 kg/m². | I | B |
| R5. A pioglitazona É RECOMENDADA como tratamento de primeira linha para esteato-hepatite e/ou fibrose em pessoas com diabetes tipo 2. | I | A |
| R6. Os agonistas do receptor do peptídeo-1 semelhante ao glucagon (AR GLP-1) com benefício comprovado na DHEM SÃO RECOMENDADOS como tratamento de primeira linha para esteato-hepatite em pessoas com diabetes tipo 2. | I | A |
| R7. Os inibidores do cotransportador-2 de sódio-glicose (SGLT2) PODEM SER CONSIDERADOS para o tratamento da DHEM em pessoas com diabetes tipo 2 que apresentam esteato-hepatite e/ou fibrose. | IIb | B |
| R8. A combinação de agentes antidiabéticos com benefícios comprovados na DHEM PODE SER CONSIDERADA no tratamento de esteato-hepatite e/ou fibrose em pessoas com diabetes tipo 2. | I | C |
| R9. Em pessoas com diabetes tipo 2, DHEM e índice de massa corporal ≥ 35 kg/m², a cirurgia bariátrica DEVE SER CONSIDERADA se a combinação de modificação do estilo de vida e farmacoterapia não tiver se mostrado eficaz para melhorar a DHEM. | IIa | B |
Referências
- Younossi ZM, Golabi P, Paik JM, et al. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology. 2023 Apr 1;77(4):1335-1347. doi: 10.1097/HEP.0000000000000004.
- Godoy-Matos AF, Silva Júnior WS, Valerio CM. NAFLD as a continuum: from obesity to metabolic syndrome and diabetes. Diabetol Metab Syndr. 2020;12:60.
- Younossi ZM, Golabi P, Avila L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: a systematic review and meta-analysis. J Hepatol. 2019;71:793-801.
- Younossi ZM, et al. 2133-A: A rapid rise in the global prevalence of MASLD and MASH among patients with type 2 diabetes (T2D): a systematic review and meta-analysis. Poster session presented at: The Liver Meeting of the American Association for the Study of Liver Diseases; Conference date range 2023 Nov 10-14; Boston, Massachusetts, United States.
- Younossi ZM, et al. 2133-A: A rapid rise in the global prevalence of MASLD and MASH among patients with type 2 diabetes (T2D): a systematic review and meta-analysis. Poster session presented at: The Liver Meeting of the American Association for the Study of Liver Diseases; Conference date range 2023 Nov 10-14; Boston, Massachusetts, United States.
- Targher G, Lonardo A, Byrne CD. Nonalcoholic fatty liver disease and chronic vascular complications of diabetes mellitus. Nat Rev Endocrinol. 2018 Feb;14(2):99-114. doi: 10.1038/nrendo.2017.173.
- Mantovani A, Morieri ML, Aldigeri R, et al. MASLD, hepatic steatosis and fibrosis are associated with the prevalence of chronic kidney disease and retinopathy in adults with type 1 diabetes mellitus. Diabetes Metab. 2023 Nov 20;50(1):101497. doi: 10.1016/j.diabet.2023.101497.
- Eslam M, Newsome PN, Sarin SK, et al. A new definition for metabolic dysfunction-associated fatty liver disease: an international expert consensus statement. J Hepatol. 2020;73(1):202-9.
- Leoni S, Tivoli F, Napoli L, et al. Current guidelines for the management of non-alcoholic fatty liver disease: a systematic review with comparative analysis. World J Gastroenterol. 2018;24:3361-73.
- Singal AG, El-Serag HB. Hepatocellular carcinoma from epidemiology to prevention: translating knowledge into practice. Clin Gastroenterol Hepatol. 2015 Nov;13(12):2140-51. doi: 10.1016/j.cgh.2015.08.014.
- Driessen S, Francque SM, Anker SD, et al. Metabolic dysfunction associated steatotic liver disease and the heart. Hepatology. 2023 Dec 25. doi: 10.1097/HEP.0000000000000735.
- Targher G, Byrne CD, Lonardo A, et al. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: a meta-analysis. J Hepatol. 2016;65:589-600.
- Fouad Y, Waked I, Bollipo S, et al. What’s in a name? Renaming ‘NAFLD’ to ‘MAFLD’. Liver Int. 2020 Jun;40(6):1254-1261. doi: 10.1111/liv.14478.
- Godoy-Matos A, Valério CM, Silva Júnior WS, et al. [Doença hepática gordurosa metabólica (DHGM)]. Diretriz Oficial da Sociedade Brasileira de Diabetes. 2023. doi: 10.29327/557753.2022-21.
- Rinella ME, Lazarus JV, Ratziu V, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023 Jun 24. doi: 10.1097/HEP.0000000000000520.
- Loomba R, Wong VW. Implications of the new nomenclature of steatotic liver disease and definition of metabolic dysfunction-associated steatotic liver disease. Aliment Pharmacol Ther. 2024 Jan;59(2):150-156. doi: 10.1111/apt.17846.
- Perazzo H, Pacheco AG, Griep RH, et al. Changing from NAFLD through MAFLD to MASLD: Similar prevalence and risk factors in a large Brazilian cohort. J Hepatol. 2023 Sep 9:S0168-8278(23)05079-1. doi: 10.1016/j.jhep.2023.08.025.
- Godoy-Matos AF, Valério CM, Silva Júnior WS, Araujo-Neto JM, Bertoluci MC. 2024 UPDATE: The Brazilian Diabetes Society position on the management of metabolic dysfunction-associated steatotic liver disease (MASLD) in people with prediabetes or type 2 diabetes. Diabetol Metab Syndr. 2024. Ahead of print.
- Cusi K, Isaacs S, Barb D, et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocr Pract. 2022 May;28(5):528-562. doi: 10.1016/j.eprac.2022.03.010.
- Koutoukidis DA, Koshiaris C, Henry JA, et al. The effect of the magnitude of weight loss on non-alcoholic fatty liver disease: A systematic review and meta-analysis. Metabolism. 2021 Feb;115:154455. doi: 10.1016/j.metabol.2020.154455.
- Sun W, Cui H, Li N, et al. Comparison of FIB-4 index, NAFLD fibrosis score and BARD score for prediction of advanced fibrosis in adult patients with non-alcoholic fatty liver disease: A meta-analysis study. Hepatol Res. 2016 Aug;46(9):862-70. doi: 10.1111/hepr.12647.
- Altamirano J, Qi Q, Choudhry S, et al. Non-invasive diagnosis: non-alcoholic fatty liver disease and alcoholic liver disease. Transl Gastroenterol Hepatol. 2020;5:31.
- Mózes FE, Lee JA, Selvaraj EA, et al. Diagnostic accuracy of non-invasive tests for advanced fibrosis in patients with NAFLD: an individual patient data meta-analysis. Gut. 2022 May;71(5):1006-1019. doi: 10.1136/gutjnl-2021-324243.
- Park CC, Nguyen P, Hernandez C, et al. Magnetic resonance elastography vs transient elastography in detection of fibrosis and noninvasive measurement of steatosis in patients with biopsy-proven nonalcoholic fatty liver disease. Gastroenterology. 2017;152:598-607.
- Bedossa P, Poitou C, Veyrie N, et al. Histopathological algorithm and scoring system for evaluation of liver lesions in morbidly obese patients. Hepatology. 2012;56:1751-59.
- Hannah Jr WN, Harrison SA. Effect of weight loss, diet, exercise, and bariatric surgery on nonalcoholic fatty liver disease. Clin Liver Dis. 2016;20:339-50.
- Patel NS, Doycheva I, Peterson MR, et al. Effect of weight loss on magnetic resonance imaging estimation of liver fat and volume in patients with nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2015;13(3):561-8.e1.
- Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, et al. Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology. 2015;149(2):367-78.e5.
- Lazo M, Solga SF, Horska A, et al. Effect of a 12-month intensive lifestyle intervention on hepatic steatosis in adults with type 2 diabetes. Diabetes Care. 2010;33(10):2156-63.
- Petersen KF, Dufour S, Befroy D, et al. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005;54(3):603-8.
- Tamura Y, Tanaka Y, Sato F, et al. Effects of diet and exercise on muscle and liver intracellular lipid contents and insulin sensitivity in type 2 diabetic patients. J Clin Endocrinol Metab. 2005;90:3191-6.
- Kim D, Murag S, Cholankeril G, et al. Physical activity, measured objectively, is associated with lower mortality in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2021;19(6):1240. Epub 2020 Jul 16.
- Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society. Circulation. 2014;129:S102-38.
- Harrison SA, Fecht W, Brunt EM, et al. Orlistat for overweight subjects with nonalcoholic steatohepatitis: a randomized, prospective trial. Hepatology. 2009;49:80-6.
- Pi-Sunyer X, Astrup A, Fujioka K, et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med. 2015;373(1):11-22.
- Bandyopadhyay S, Das S, Samajdar SS, et al. Role of semaglutide in the treatment of nonalcoholic fatty liver disease or non-alcoholic steatohepatitis: A systematic review and meta-analysis. Diabetes Metab Syndr. 2023 Sep 13;17(10):102849. doi: 10.1016/j.dsx.2023.102849.
- Loomba R, Abdelmalek MF, Armstrong MJ, et al. Semaglutide 2.4 mg once weekly in patients with non-alcoholic steatohepatitis-related cirrhosis: a randomised, placebo-controlled phase 2 trial. Lancet Gastroenterol Hepatol. 2023 Jun;8(6):511-522. doi: 10.1016/S2468-1253(23)00068-7.
- Khera R, Murad MH, Chandar AK, et al. Association of pharmacological treatments for obesity with weight loss and adverse events: a systematic review and meta-analysis. JAMA. 2016;315(22):2424-34.
- Armstrong MJ, Hull D, Guo K, et al. Glucagon-like peptide 1 decreases lipotoxicity in non-alcoholic steatohepatitis. J Hepatol. 2016;64:399-408.
- Blazina I, Selph S. Diabetes drugs for nonalcoholic fatty liver disease: a systematic review. Syst Rev. 2019;8(1):295.
- Musso G, Cassader M, Rosina F, et al. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia. 2012;55(4):885-904.
- Kumar J, Memon RS, Shahid I, et al. Antidiabetic drugs and non-alcoholic fatty liver disease: A systematic review, meta-analysis and evidence map. Dig Liver Dis. 2021 Jan;53(1):44-51. doi: 10.1016/j.dld.2020.08.021. Epub 2020 Sep 8.
- Tang W, Xu Q, Hong T, et al. Comparative efficacy of anti-diabetic agents on nonalcoholic fatty liver disease in patients with type 2 diabetes mellitus: a systematic review and meta-analysis of randomized and non-randomized studies. Diabetes Metab Res Rev. 2016;32(2):200-16.
- Cusi K, Orsak B, Bril F, et al. Long-term pioglitazone treatment for patients with nonalcoholic steatohepatitis and prediabetes or type 2 diabetes mellitus: a randomized trial. Ann Intern Med. 2016;165(5):305-15.
- Musso G, Cassader M, Paschetta E, et al. Thiazolidinediones and advanced liver fibrosis in nonalcoholic steatohepatitis: a meta-analysis. JAMA Intern Med. 2017;177(5):633-40.
- Panunzi S, Maltese S, Verrastro O, Labbate L, De Gaetano A, Pompili M, et al. Pioglitazone and bariatric surgery are the most effective treatments for non-alcoholic steatohepatitis: A hierarchical network meta-analysis. Diabetes Obes Metab. 2021;23:980-90.
- Armstrong MJ, Houlihan DD, Rowe IA, et al. Safety and efficacy of liraglutide in patients with type 2 diabetes and elevated liver enzymes: individual patient data meta-analysis of the LEAD program. Aliment Pharmacol Ther. 2013;37(2):234-42.
- Armstrong MJ, Gaunt P, Aithal GP, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387(10019):679-90.
- Mantovani A, Byrne CD, Scorletti E, et al. Efficacy and safety of antihyperglycemic drugs in patients with non-alcoholic fatty liver disease with or without diabetes: an updated systematic review of randomized controlled trials. Diabetes Metab. 2020;S1262-3636(20)30002-1.
- Newsome P, Francque S, Harrison S, et al. Effect of semaglutide on liver enzymes and markers of inflammation in subjects with type 2 diabetes and/or obesity. Aliment Pharmacol Ther. 2019;50(2):193-203.
- Newsome PN, Buchholtz K, Cusi K, et al. A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med. 2020 Nov 13. doi: 10.1056/NEJMoa2028395.
- Mantovani A, Petracca G, Beatrice G, et al. Glucagon-like peptide-1 receptor agonists for treatment of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: an updated meta-analysis of randomized controlled trials. Metabolites. 2021;11(2):73.
- Yuan X, Gao Z, Yang C, et al. Comparing the effectiveness of long-term use of daily and weekly glucagon-like peptide-1 receptor agonists treatments in patients with nonalcoholic fatty liver disease and type 2 diabetes mellitus: a network meta-analysis. Front Endocrinol. 2023;14:1170881. doi: 10.3389/fendo.2023.117088.
- Dokmak A, Almeqdadi M, Trivedi H, et al. Rise of sodium-glucose cotransporter 2 inhibitors in the management of nonalcoholic fatty liver disease. World J Hepatol. 2019;11(7):562-73.
- Raj H, Durgia H, Palui R, et al. SGLT-2 inhibitors in non-alcoholic fatty liver disease patients with type 2 diabetes mellitus: A systematic review. World J Diabetes. 2019;10(2):114-32.
- Kuchay MS, Krishan S, Mishra SK, et al. Effect of empagliflozin on liver fat in patients with type 2 diabetes and nonalcoholic fatty liver disease: a randomized controlled trial (E-LIFT Trial). Diabetes Care. 2018;41(8):1801-8.
- Sattar N, Fitchett D, Hantel S, et al. Empagliflozin is associated with improvements in liver enzymes potentially consistent with reductions in liver fat: results from randomised trials including the EMPA-REG OUTCOME® trial. Diabetologia. 2018;61(10):2155-63.
- Shimizu M, Suzuki K, Kato K, et al. Evaluation of the effects of dapagliflozin, a sodium-glucose co-transporter-2 inhibitor, on hepatic steatosis and fibrosis using transient elastography in patients with type 2 diabetes and non-alcoholic fatty liver disease. Diabetes Obes Metab. 2019;21(2):285-92.
- Eriksson JW, Lundkvist P, Jansson PA, et al. Effects of dapagliflozin and n-3 carboxylic acids on non-alcoholic fatty liver disease in people with type 2 diabetes: a double-blind randomised placebo-controlled study. Diabetologia. 2018;61(9):1923-34.
- Li B, Wang Y, Ye Z, et al. Effects of canagliflozin on fatty liver indexes in patients with type 2 diabetes: a meta-analysis of randomized controlled trials. J Pharm Pharm Sci. 2018;21(1):222-35.
- Akuta N, Kawamura Y, Watanabe C, et al. Impact of sodium glucose cotransporter 2 inhibitor on histological features and glucose metabolism of non-alcoholic fatty liver disease complicated by diabetes mellitus. Hepatol Res. 2019 May;49(5):531-539. doi: 10.1111/hepr.13304.
- Koureta E, Cholongitas E. Combination therapies in nonalcoholic fatty liver disease using antidiabetic and disease-specific drugs. Ann Gastroenterol. 2023 Jul-Aug;36(4):378-391. doi: 10.20524/aog.2023.0806.
- Sanyal AJ, Chalasani N, Kowdley KV, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010 May 6;362(18):1675-85. doi: 10.1056/NEJMoa0907929.
- Klein EA, Thompson IM Jr, Tangen CM, et al. Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 2011 Oct 12;306(14):1549-56. doi: 10.1001/jama.2011.1437.
- Alam S, Nazmul Hasan S, Mustafa G, et al. Effect of pentoxifylline on histological activity and fibrosis of nonalcoholic steatohepatitis patients: a one year randomized control trial. J Transl Int Med. 2017 Sep 30;5(3):155-163. doi: 10.1515/jtim-2017-0021.
- Wah Kheong C, Nik Mustapha NR, Mahadeva S. A randomized trial of silymarin for the treatment of nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2017 Dec;15(12):1940-1949.e8. doi: 10.1016/j.cgh.2017.04.016.
- Monteiro Júnior FD, Silva Júnior WS, Salgado Filho N, et al. Effects of weight loss induced by bariatric surgery on the prevalence of metabolic syndrome. Arq Bras Cardiol. 2009;92(6):418-56.
- Schauer PR, Bhatt DL, Kirwan JP, et al. Bariatric surgery versus intensive medical therapy for diabetes — 3-year outcomes. N Engl J Med. 2014 May 22;370(21):2002-13. doi: 10.1056/NEJMoa1401329.
- Caiazzo R, Lassailly G, Leteurtre E, et al. Roux-en-Y gastric bypass versus adjustable gastric banding to reduce nonalcoholic fatty liver disease: a 5-year controlled longitudinal study. Ann Surg. 2014;260:893-9.
- Kalinowski P, Paluszkiewicz R, Ziarkiewicz-Wróblewska B, et al. Liver function in patients with nonalcoholic fatty liver disease randomized to Roux-en-Y gastric bypass versus sleeve gastrectomy: a secondary analysis of a randomized clinical trial. Ann Surg. 2017;266:738-45.
- Fakhry TK, Mhaskar R, Schwitalla T, et al. Bariatric surgery improves nonalcoholic fatty liver disease: a contemporary systematic review and meta-analysis. Surg Obes Relat Dis. 2019;15(3):502-11.
- Berry MA, Urrutia L, Lamoza P, et al. Sleeve gastrectomy outcomes in patients with BMI between 30 and 35-3 years of follow-up. Obes Surg. 2018 Mar;28(3):649-55.
- Lassailly G, Caiazzo R, Ntandja-Wandji LC, et al. Bariatric surgery provides long-term resolution of nonalcoholic steatohepatitis and regression of fibrosis. Gastroenterology. 2020 Oct;159(4):1290-1301.e5. doi: 10.1053/j.gastro.2020.06.006.
- Pais R, Aron-Wisnewsky J, Bedossa P, et al. Persistence of severe liver fibrosis despite substantial weight loss with bariatric surgery. Hepatology. 2022 Aug;76(2):456-468. doi: 10.1002/hep.32358.
- Verrastro O, Panunzi S, Castagneto-Gissey L, et al. Bariatric-metabolic surgery versus lifestyle intervention plus best medical care in non-alcoholic steatohepatitis (BRAVES): a multicentre, open-label, randomised trial. Lancet. 2023 May 27;401(10390):1786-1797. doi: 10.1016/S0140-6736(23)00634-7.
- Mendoza YP, Becchetti C, Watt KD, et al. Risks and rewards of bariatric surgery in advanced chronic liver diseases. Semin Liver Dis. 2021 Nov;41(4):448-460. doi: 10.1055/s-0041-1731705.
Cite este artigo

