Autores: João Roberto Sá, Luis Henrique Canani, Érika Bevilaqua Rangel, Andrea Carla Bauer, Gustavo Monteiro Escott, Themis Zelmanovitz, Sandra Pinho Silveiro, Carolina de Castro Rocha Betônico, Márcio Weissheimer Lauria, Rodrigo Nunes Lamounier, Thyago Proença de Moraes
Editor Chefe: Marcello Bertoluci
Última revisão em: 04/07/2024
DOI: 10.29327/5412848.2024-6 | Cite este Artigo
Introdução
Diabetes é a causa mais comum de doença renal crônica (DRC), responsável por aproximadamente 50% dos novos casos de terapia de substituição renal na maioria dos países desenvolvidos.1 Os dados do censo da Sociedade Brasileira de Nefrologia de 2023 indicam que 32% dos casos de DRC em diálise, no Brasil, são pessoas com diabetes.2 A etnia é um fator importante. Asiáticos têm uma alta predisposição para desenvolver Doença Renal do Diabetes (DRD), e afeta 60% dos hipertensos com DM2.3
Em geral, a DRD ocorre em 20-40% dos pacientes com diabetes mellitus (DM).4 A prevalência, no entanto é muito heterogênea, de acordo com as etnias e regiões demográficas, indo de 26% nos EUA5 até 83% na Tanzânia.6 O diabetes dobra o risco de DRC, e a razão de chances [odds ratio (OR)] varia de 1,3 a 4,6 dependendo da região do mundo.7,8
A DRD é um fator de risco independente para doença cardiovascular (DCV). Estudos observacionais demonstraram uma forte associação entre estágios avançados da DRD e DCV. Em uma coorte prospectiva chinesa em indivíduos com DM2, a taxa de novos eventos cardiovasculares [incluindo morte cardiovascular, angina, infarto agudo do miocárdio (IAM), acidente vascular cerebral (AVC), revascularização e internação por insuficiência cardíaca (IC)] aumentou de 2,6% para 25,3% (p <0,001) do estágio 1 (taxa de filtração glomerular estimada (TFGe) >90 mL/min/1,73 m2) para o estágio 4 (TFGe <30 mL/min/1,73 m2. A taxa de mortalidade por todas as causas aumentou de 1,2% para 18,3% (p <0,001). Comparado aqueles com DRC no estágio 1 com albumina urinária normal, os indivíduos com DRC no estágio 4 e albuminúria aumentada tiveram risco 16 x maior de mortalidade cardiovascular e mortalidade por todas as causas.9
A albuminúria é preditora independente para eventos cardiovasculares e para IC no indivíduo com DM e DRC. O Casale Monferrato Study mostrou que no DM1 e no DM2 a albuminúria muito elevada (macroalbuminúria) foi a principal preditora de mortalidade, independente da TFGe e de outros fatores de risco cardiovasculares. O risco relativo [hazard ratio (HR)] para mortalidade cardiovascular em pacientes com razão albumina/creatinina urinária (RAC) de 20–200mg/g e RAC >200 mg/g foi de 1,06 e 2,0, respectivamente (p <0.0001). A HR para mortalidade cardiovascular, comparada à DRC ao longo dos estágios 2-4 foi de 0,65, 0,79, 0,67, e 2,3, respectivamente (p = 0,27). Na análise estratificada por categorias de albuminúria, uma tendência significativa de aumento de risco com a redução da TFGe foi evidente somente em pessoas com albuminúria muito elevada.10
Tradicionalmente, a DRD tem sido diagnosticada com base na persistência da elevação da albuminúria e no subsequente declínio da TFGe, que é amplamente reconhecido como fenótipo clássico.11,12
Em 2007, o Kidney Disease Outcomes Quality Initiative (KDOQI) propôs usar a expressão doença renal do diabetes (DRD) no lugar de nefropatia diabética (ND) para ampliar o espectro das formas de doença renal no DM, acrescentando o fenótipo não-albuminúrico ao clássico albuminúrico.13,14
Diversos estudos têm mostrado que as trajetórias da TFGe e da albuminúria podem diferir do fenótipo clássico. Três novos fenótipos distintos têm sido reportados e são caracterizados por: 1. Regressão da albuminúria; 2. Rápido declínio da TFGe; e 3. DRD sem albuminúria. A regressão da albuminúria provavelmente, mas não sempre, se associa às múltiplas intervenções relacionadas a agentes reno-protetores e a um prognóstico favorável.15–17
Por outro lado, alguns pacientes apresentam um rápido declínio da TFGe (>4 ml/min/1.73 m2/ano) que está associado a um prognóstico ruim, tanto renal como cardiovascular. Há uma provável contribuição da hipertensão neste grupo. O grupo não-albuminúrico se associa a um fenótipo de maior frequência em mulheres, com hipertensão e tabagismo e ausência de retinopatia.15
ESTÁGIOS DA DRD
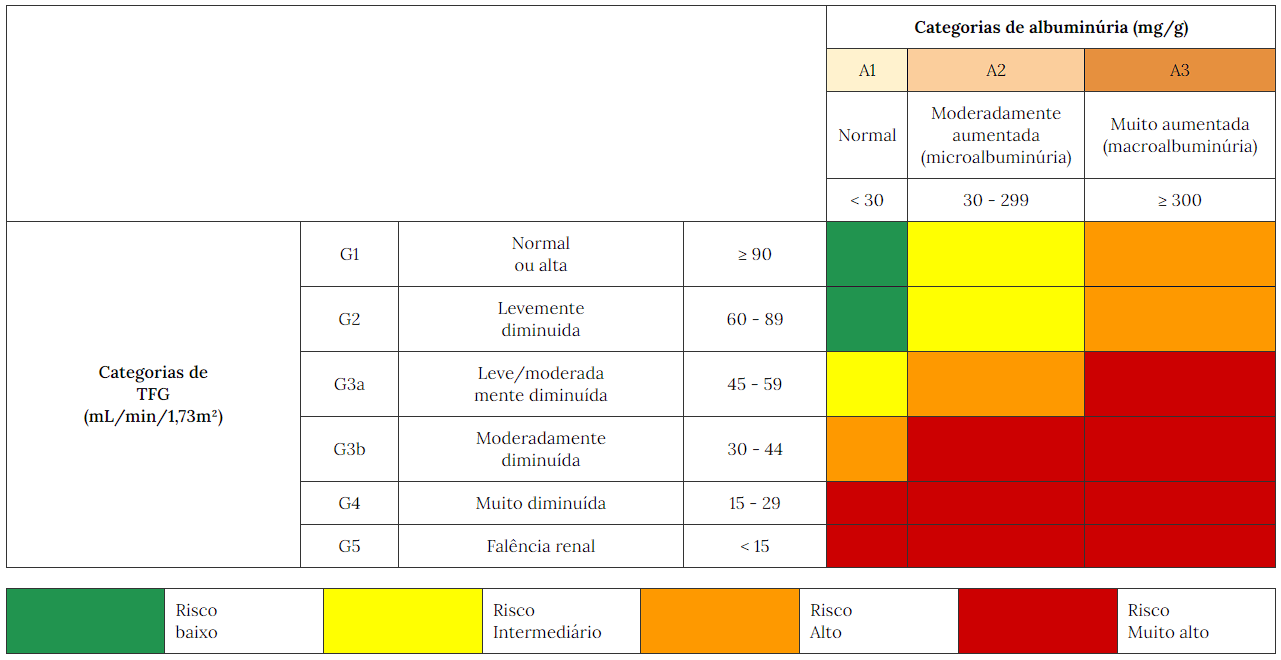
A Sociedade Brasileira de Diabetes (SBD) endossa o estadiamento proposto pela KDIGO, que combina, de forma independente, estágios baseados na TFGe e na RAC utilizando os dois parâmetros de forma complementar (Tabela 1).18
Tabela 1 Estágios da DRD, em relação ao risco de progressão para doença renal terminal
RECOMENDAÇÕES
RASTREAMENTO DA DRD
R1. É RECOMENDADO que o primeiro rastreamento da DRD seja feito com amostra de urina aleatória para determinação da Razão Albumina Creatinina (RAC) e determinação da taxa de filtração glomerular estimada (TFGe) determinada pela creatinina sérica, a partir da equação CKD-EPI. O rastreamento deve ser feito logo ao diagnóstico no DM2, e aos 5 anos do diagnóstico de DM1, e repetido, 1 a 4 vezes ao ano.
| Classe I | Nível B |
Sumário de evidências:
- A TFGe e a RAC são preditores independentes do curso evolutivo da doença renal e do risco de mortalidade. Portanto, ambas devem ser utilizadas simultaneamente no rastreamento da DRD.19
- No DM2, o rastreamento da DRD deve ser realizado no momento do diagnóstico do DM, pois 7% dos pacientes já têm aumento da albuminúria nesse momento.19
- A albuminúria foi avaliada por Parving et al. em 957 pacientes com 5 anos ou mais de DM1, sendo a prevalência de “microalbuminúria” de 22% e de “macroalbuminúria” de 19%. Uma prevalência de 37% de microalbuminúria foi detectada em adolescentes entre 15 e 18 anos de idade e nenhum caso foi detectado em adolescentes com idade menor do que 15 anos. Em 119 indivíduos com 5 a 9 anos de DM1, foi observada prevalência de microalbuminúria em torno de 3%.20
- A estimativa da TFGe, preconizada pela SBD, é a CKD-EPI 2021 (Chronic Kidney Disease Epidemiology Collaboration). O cálculo da TFGe só pode ser feito a partir da creatinina sérica rastreável em relação a padrões de referência internacionais, a partir da metodologia IDMS (Espectrometria de Massa de Diluição Isotópica).21–23 A CKD-EPI apresenta boa acurácia, entretanto, pode subestimar a TFGe em pessoas com baixa massa muscular.20,24 Essas fórmulas são acessíveis em sites como www.sbn.org.br e www.kidney.org ou em aplicativos.
- Tanto a RAC como a concentração de albumina (mg/L) na amostra aleatória de urina apresentam excelente correlação com a medida em urina de 24 horas e podem ambas ser utilizadas.28 A medida de albumina em amostra aleatória de urina tem sido recomendada para o rastreamento da DRD.26
- Uma metanálise que analisou 14 estudos, reportou sensibilidade entre 85% e 87% para a concentração de albumina e RAC (UAlb/creat), respectivamente; e especificidade em torno de 88% para ambas, para detecção da microalbuminúria.29
Nota importante 1: RAC – Razão Albumina/Creatinina urinária
- A razão albumina/creatinina deve ser dosada em amostra aleatória de urina, por facilidade na coleta.25
- Não há necessidade de coletar urina de 24 horas para rastreamento, diagnóstico e seguimento da DRD.21,26
- Todo teste anormal de albuminúria deve ser confirmado em 2 de 3 amostras, coletadas dentro de 6 meses, em razão da grande variabilidade diária.23,25
- Fatores como febre, exercício intenso, insuficiência cardíaca descompensada, hiperglicemia grave, infecção urinária sintomática e hipertensão arterial não controlada podem elevar transitoriamente os valores da RAC.12 A presença de bacteriúria assintomática, por sua vez, não interfere de maneira importante no resultado.27
Nota importante 2: Rastreamento da DRD em crianças e adolescentes
- Em crianças e adolescentes com 2 a 5 anos de duração do DM1 e 11 anos a 17 anos de idade, o rastreamento também deve ser considerado, devido à prevalência observada de 3% em um estudo de coorte.17
- Em situações especiais, como puberdade, diabetes descompensado e gestação, o rastreamento deverá ser realizado em intervalos mais curtos.
R2. É RECOMENDADO que todo teste anormal da RAC seja confirmado em, pelo menos, 2 de 3 amostras repetidas no período de três a seis meses por causa da variabilidade diária.
| Classe I | Nível B |
Sumário de evidências:
- Em função da alta variabilidade das medidas de RAC, que é da ordem de 20%, um resultado de teste alterado de albuminúria deverá ser confirmado em duas de três amostras, coletadas em período de três a seis meses. Se for possível, deve-se realizar a avaliação na ausência de insuficiência cardíaca descompensada, hiperglicemia severa ou hipertensão arterial não-controladas.12,23,25,27
- Os pontos de corte de albumina em amostra de urina (>30 mg/g ou >30 mg/L) são derivados de comparação com amostras de urina de 24 h, demonstrando um adequado desempenho como teste de rastreamento e diagnóstico.28,29,31,32
- Em avaliação prospectiva, o valor de concentração de albumina em amostra de urina ≥14 mg/L aumentou aproximadamente em três vezes o risco de eventos CVs (HR 3,25; IC 95% 1,43 – 7,38; p = 0,005), em quatro vezes o risco de DRD (HR 4,3; IC 95% 2,22 – 8,32; p < 0,001) e em cinco vezes o risco de morte (HR 5,51; IC 95% 1,16 – 26,22; p = 0,032), o que indica que mesmo valores abaixo do ponto de corte citado podem predizer desfechos cardiorrenais.32
QUANDO CONSIDERAR OUTRAS NEFROPATIAS
Algumas condições sugerem a necessidade de investigar a presença de outras nefropatias além da DRD. O quadro 1. descreve os principais sinais de alerta.
Quadro 1. Sinais de alerta para investigar outras nefropatias além da DRD
| Quadro 1. Sinais de alerta |
|
Fonte: Adaptado de Gross et al.22 IECA: Inibidores da enzima conversora da angiotensina, BRA: Bloqueadores do receptor da angiotensina; ISGLT2 (Inibidores do SGLT2).
Tratamento da hiperglicemia na DRD
METAS DE HbA1c
R3. Em indivíduos com DM1 ou DM2, É RECOMENDADO buscar a meta de HbA1c 6,5-7%, quando a TFGe for maior que 60 ml/min/1.73m2 e a RAC maior que 30mg/g, para reduzir a progressão da albuminúria e a progressão da DRD a longo prazo.
| Classe I | Nível A |
R4. É RECOMENDADO atingir e manter a meta de HbA1c entre 7-7,9% em indivíduos com DM1 ou DM2, quando a TFGe for menor que 60 ml/min/1.73m2 ou o paciente estiver em diálise, para evitar excesso de mortalidade.
| Classe I | Nível B |
Sumário de evidências: R3 – R4
DM2
- No UKPDS (United Kingdom Prospective Diabetes Study), o tratamento intensivo da glicemia comparativo ao tratamento padrão da época, em pacientes com DM2 recém diagnosticados, reduziu a HbA1c de 7,9% para 7,0%, com redução de risco de 25% para desfechos microvasculares, incluindo albuminuria.33
- O estudo ADVANCE randomizou 11.140 pacientes com DM2 de alto risco cardiovascular, submetidos a controle glicêmico intensivo com o uso da gliclazida MR, para buscar HbA1c 6,5% ou mais baixa.35 No estudo, 27% dos participantes tinham microalbuminúria, 3,6% tinham macroalbuminúria e a creatinina sérica era inicialmente normal (0,97 mg/dL – 1,05 mg/dL). O desfecho composto primário incluiu desfechos macrovasculares e um desfecho microvascular composto, incluindo surgimento ou piora da nefropatia, duplicação da creatinina, necessidade de terapia substitutiva ou morte por doença renal. Ao final de cinco anos de seguimento, houve apenas tendência de redução na necessidade de terapia substitutiva renal ou de morte por causas renais (HR 0,64 IC95% 0,38 – 1,08). O grupo de tratamento intensivo reduziu a HbA1c média de 7,3% para 6,5% e obteve redução na incidência de novos casos de microalbuminúria (HR 0,91 IC 95% 0,85–0,98; p=0,02) e na progressão para macroalbuminúria de 2,9% vs. 4,1%, relativo ao grupo controle (HR 0,70 IC 95% 0,57 – 0,85; p < 0,001).35
- O estudo ADVANCE ON, por sua vez, foi um prolongamento observacional de 6 anos do estudo ADVANCE,35 após o término da fase de intervenção. Os participantes não mais receberam a intervenção, e as diferenças de HbA1c observadas entre os grupos ao final do estudo original desapareceram. Dos participantes do ADVANCE original, 8.494 (76%) participaram da faseobservacional post trial. Com o tempo acumulado dos dois estudos perfazendo 10 anos a 11 anos, observou-se benefício cumulativo significativo em relação à progressão para doença renal terminal. HR 0,54 (IC 95% 0,34- 0,85, p = 0,007).39
- O estudo ACCORD, foi um ensaio clínico randomizado, multicêntrico, que avaliou 10.251 adultos com DM2 entre 40-79 anos e HbA1c média de 8,3% na entrada, os quais foram randomizados para tratamento intensivo, que buscou atingir a meta de HbA1c <6% e HbA1c 7-7,9% respectivamente. Na subanálise de desfechos microvasculares que incluiu: diálise, transplante renal, creatinina sérica elevada, fotocoagulação, vitrectomia e neuropatia periférica, não houve diferença no efeito do tratamento intensivo da glicemia sobre o desenvolvimento do desfecho primário combinado (HR 1.00, 95% CI 0.88-1.14; p=1.00).34 A incidência de macroalbuminúria, no entanto, foi reduzida em 29% no grupo em tratamento intensivo, em relação ao grupo de tratamento convencional. As médias da HbA1c obtidas ao final do estudo nos dois grupos foram respectivamente 7,2% e 7,6%.34 O tratamento intensivo da glicemia para uma meta de HbA1c <6% (atingindo HbA1c 7,2%) não reduziu o risco de desfechos microvasculares, mas atrasou o inicio da macroalbuminuria. No entanto este benefício ainda precisa ser avaliado em relação ao aumento da mortalidade total e cardiovascular.
- O estudo VADT randomizou 1791 pessoas com DM2 com média de idade de 60,4 anos para tratamento intensivo da glicemia ou tratamento convencional. Os pacientes apresentavam tempo de DM2 médio de 11,5 anos, creatinina média de 1,0±0,2 mg/dl, e o controle do DM estava inicialmente inadequado (HbA1c média: 9,4%). O grupo de tratamento intensivo atingiu a média de HbA1c de 6,9%, enquanto o grupo controle manteve HbA1c em 8,4%. Ao final de 5,6 anos de seguimento, no grupo intensivo, 10% dos pacientes progrediram de normoalbuminúria para micro ou macroalbuminúria, enquanto no grupo controle a taxa de progressão foi de 14% (p = 0,03).36 A redução da HbA1c de 9,4% para 6,9% versus 8,4%) reduziu portanto a progressão de normoalbuminúria para microalbuminúria e para macroalbuminúria. Ao final do estudo, 5,1% progrediram para micro e macroalbuminúria no grupo controle, enquanto apenas 2,9% progrediram no grupo intensivo (p = 0,04).36
- Um estudo observacional que avaliou 23.296 pacientes com DM e TFGe < 60 mL/min/1,73m2, as quais foram classificadas pela sua HbA1c de entrada e acompanhadas por um periodo de 46 meses para 5 desfechos: morte, duplicação da creatinina, nova doença renal terminal, eventos cardiovasculares e hospitalização por todas as causas. Ao todo houve 3665 mortes e 401 desenvolveram doença renal terminal. Independentemente da função renal, HbA1c mais elevadas foram fortemente associadas a um excesso de risco de morte. Contudo, a associação da HbA1c com a mortalidade teve o padrão em U, com excesso de mortalidade tanto com HbA1c < 6,5% como com HbA1c >8%. O risco de progressão para doença renal terminal foi menos impactado pela HbA1c elevada nos pacientes com TFGe mais baixas. Especificamente o excesso de risco de doença renal terminal com HbA1c 7-9% e HbA1c>9% comparado a HbA1c<7% na faixa de TFGe 30-60 foi de 22% e 153%, respectivamente. Ja na faixa de TFGe 15-30, o excesso de risco foi de 3% e 13% respectivamente. Claramente o excesso de risco de progressão para doença renal terminal foi mais acentuado foi na DRD com função renal mais preservada, comparada à DRD mais avançada.44
- Um estudo observacional de coorte prospectiva (DOPPS) Dyalisis Outcomes and Practice Patterns Study procurou estudar a relação entre HbA1c e mortalidade em pacientes dialíticos. Foram incluidos 9.201 pacientes com DM tipos 1 e 2 em hemodiálise, em 12 paises. A curva de mortalidade observada foi em forma de U. Comparadas com HbA1c 7-7,9% as HR para HbA1c <5%; 5-5,9%; 6,0-6,9%; 8-8,9% e >9% foram respectivamente: 1.35; 1.18, 1.21, 1.16 e 1.38, após ajustes mais de 12 covariaveis. O estudo conclui que, em pacientes DM2 em diálise, a HbA1c prediz fortemente mortalidade que aumenta quando acima ou abaixo de HbA1c 7-7,9%, sugerindo que esta deva ser a meta para pacientes em dialise.
- Em relação à mortalidade, uma metanálise de ensaios clínicos randomizados (ECRs) também demonstrou que o controle glicêmico intensivo em pacientes com DM2 não reduz a mortalidade geral ou as complicações microvasculares, inclusive a DRD.41
- O estudo STENO 2 foi um ensaio clínico randomizado conduzido com 160 pacientes DM2 com microalbuminúria, com seguimento de 7,8 anos, com o objetivo de avaliar se o controle intensivo da glicemia associado ao controle de outros fatores de risco teria efeito sobre desfechos micro e macrovasculares. O grupo em tratamento intensificado recebeu intervenção múltipla, compreendendo inibidores da enzima conversora da angiotensina (IECA), ácido acetilsalicílico e hipolipemiantes, e controle intensivo da glicemia (HbA1c 7,9% versus 9%). O tratamento intensivo da glicemia associado ao controle da hipertensão, ao controle da dislipidemia e à suspensão do tabagismo revelou efeito benéfico importante do tratamento sobre a perda de função renal avaliada pela TFGe e incluindo redução da albuminúria. Apesar de não ter sido possível individualizar o efeito isolado da redução da glicemia nos desfechos renais, o estudo demonstrou a importância e a necessidade do controle dos diversos fatores de risco, incluindo a glicemia.40
- Conclusão: Analisados em conjunto, os resultados dos estudos em DM2 a seguir sugerem que a obtenção de HbA1c abaixo de 7% por períodos curtos (<5 anos)tem um pequeno efeito na redução da albuminúria e no retardo da progressão da doença renal em pacientes DM2 com DRD estabelecida. A ação protetora de progressão para insuficiência renal é observada somente após longos períodos de bom controle glicêmico.
DM1
- Em pacientes com DM1, o estudo DCCT (Diabetes Control and Complications Trial) não observou redução na progressão de micro para macroalbuminúria nos pacientes que apresentavam microalbuminúria no início do estudo.42 Todavia, o DCCT não teve poder suficiente para demonstrar esse benefício, já que somente 73 pacientes tinham inicialmente microalbuminúria.
- No estudo DCCT (Diabetes Control and Complications Trial),1.441 indivíduos com DM1 foram divididos no início em coortes de prevenção primária (albuminúria <40 mg/24h) e prevenção secundária (albuminúria <200 mg/24h), os quais foram randomizados para tratamento intensivo ou convencional. O grupo tratamento intensivo atingiu e manteve Hb1Ac média em torno de 7%, enquanto o grupo controle manteve a HbA1c em torno de 9%, ao longo de 6,5 anos. Com as duas coortes combinadas, o tratamento intensivo reduziu a incidência de microalbuminúria em 39% (IC 95% 21%-52%) e a ocorrência de macroalbuminúria em 54% (IC 95% 19% – 74%).37
- O estudo EDIC (The Epidemiology of Diabetes Interventions and Complications) foi um prolongamento observacional do DCCT que estendeu os resultados por até 11 anos. Ao final do estudo, a prevalência de microalbuminúria e de macroalbuminúria em indivíduos com DM1 continuou maior no grupo de tratamento convencional, em relação ao controle intensivo, respectivamente: HR 0,62 (0,39 – 0,97), p = 0,04 e HR 0,58 IC 95% 0,37 – 0,91), p = 0,02.38
- Um estudo observacional prospectivo acompanhou 349 pacientes com DM1 da Clínica Joslin, USA, com proteinúria (DRD em estágios 1 a 3) por até 15 anos. O grupo com melhor controle glicêmico durante o período de observação apresentou menor queda da TFGe e menor prevalência de doença renal terminal (29%), em comparação com os pacientes que mantiveram pior controle glicêmico (42%). A diminuição da HbA1c em um ponto foi associada a uma proteção de 24% para evolução de doença renal terminal.43
Nota importante 3: Metas de HbA1c na DRD
- Deve-se considerar que valores muito baixos ou muito elevados de HbA1c podem estar associados a desfechos negativos em pacientes com DRD.
- A curva de mortalidade em U associada à HbA1c também foi demonstrada em 9.000 pacientes com DM em hemodiálise para valores de HbA1c < 7,0% e > 7,9%.45
- Uma metanálise com dez estudos, incluindo 83.684 participantes com DM em diálise, concluiu que indivíduos com HbA1c ≤ 5,4% ou ≥ 8,5% apresentaram aumento do risco de mortalidade.46
- Em pacientes com DRD avançada, nos estágios 4-5, deve-se individualizar a meta de hemoglobina glicada em função do maior risco de hipoglicemia. Assim, em pacientes com DRD avançada ou terminal, a melhor evidência disponível sugere que seja adequada uma HbA1c entre 7 e 7,9%.46,47
TRATAMENTO DA DRD NO DM2
A figura 1 descreve o esquema de tratamento atualmente preconizado pela SBD, o qual deve focar a prevenção da progressão da DRD além do controle da glicemia.
Figura 1. Fluxograma de estratégia de tratamento da hiperglicemia e proteção renal na DRD.
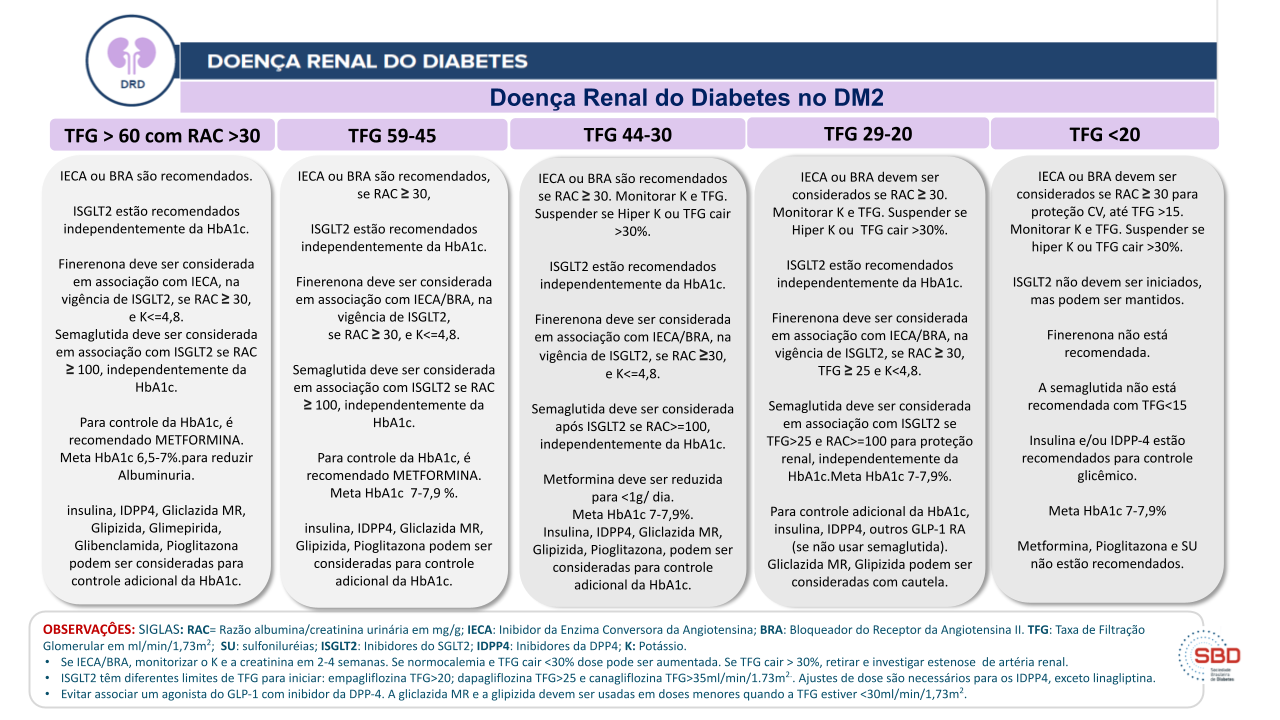
Nota importante 4: Fluxograma do manejo da DRD no DM2
- O início dos ISGLT2 deve ser limitado a pessoas com TFGe >20 ml/min/1,73m2, se empagliflozina; >25 ml/min/1,73m2, se dapagliflozina; e >35 ml/min/1,73m2, se canagliflozina.
- Uma vez em tratamento com ISGLT2, podem ser mantidos até o início da diálise.
- Ajustes de dose para os inibidores da DPP-4 são necessários, exceto para linagliptina e evogliptina (ver tabela 1).
- Inibidores da DPP-4 e agonistas do GLP-1 não devem ser usados concomitantemente.
- Glimepirida não é recomendada com TFGe <30 ml/min/1.73m2.
- Glibenclamida não é recomendada abaixo de 60 ml/min/1.73m2.
MANEJO INICIAL DA HIPERGLICEMIA NA DRD DO DM2
INIBIDORES DO SGLT2
R5. Em pacientes com TFGe maior ou igual a 60 mL/min/1,73m² e RAC maior ou igual a 30 mg/g, a terapia inicial com inibidores do SGLT2 É RECOMENDADA, independentemente da HbA1c.
| Classe I | Nível A |
R6. Em pacientes com TFGe entre 30 e 60 mL/min/1,73m², a terapia inicial com inibidores do SGLT2 É RECOMENDADA, independentemente da RAC ou da HbA1c. A canagliflozina entretanto não deverá ser iniciada com TFGe menor que 35ml/min/1.73m2.
| Classe I | Nível A |
R7. Em pacientes com TFGe entre 20 e 30 mL/min/1,73m², É RECOMENDADO iniciar inibidores do SGLT2, independentemente da RAC ou da HbA1c. A empagliflozina e a dapagliflozina não deverão ser iniciadas com TFGe menor que 20 e menor que 25/min/1.73m2, respectivamente.
| Classe I | Nível A |
R8. Em pacientes com TFGe menor que 20mL/min/1,73m², embora os ISGLT2 não devam ser iniciados, sua manutenção PODE SER CONSIDERADA, independentemente da HBA1c ou da RAC.
| Classe IIb | Nível B |
Sumário de evidências: R5 – R8
- O estudo EMPA-REG OUTCOME (Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients) utilizando a empagliflozina, avaliou como desfecho secundário, desfechos renais em indivíduos com DM2, e observou 38% de redução da microalbuminúria, 44% de redução do número de pacientes que duplicaram a creatinina no tempo de seguimento e uma redução de 55% nos pacientes necessitando de terapia renal substitutiva.48,49
- No estudo CANVAS (Canagliflozin Cardiovascular Assessment Study) a canagliflozina em indivíduos com DM2 demonstrou benefícios na redução da progressão da albuminúria, na necessidade de terapia renal substitutiva e na redução de morte de causa renal.50
- No estudo DECLARE-TIMI 58 (Dapagliflozin Effect on Cardiovascular Events) a dapagliflozina reduziu em 47% o evento composto de perda significativa de TFGe, progressão para diálise e morte renal.51 Uma revisão sistemática e metanálise do uso de iSGLT2 incluiu 13 estudos, com pelo menos seis meses de duração, com N de 90.409 adultos, sendo 82,7% com DM2.52 O desfecho primário foi progressão de doença renal (queda mantida ≥50% na TFGe desde a randomização, uma manutenção de TFGe baixa, falência renal terminal, ou morte por falência renal). A TFGe média no basal foi de 37-85 ml/min/1,73 m2. Comparado com o grupo placebo, os pacientes em uso de iSGLT2 reduziram o risco de progressão de doença renal em 37% (RR 0,63 IC 95% 0,58 a 0,69), com RR similares entre indivíduos com e sem diabetes.
- Uma metanálise de 27 estudos com 7,363 adultos com DM2 e DRC de leve a moderada tratados com iSGLT2 demonstrou que, além da redução da HbA1c (-0,29% IC 95% 0,39 a-0,19), o uso do iSGLT2 melhorou a pressão arterial, reduziu o peso corporal e a albuminúria.53 Além disso, atenuaram o declínio anual da TFGe e reduziram o risco de desfecho renal composto (HR 0,71, IC 95% 0,53 a 0,95).
- Os ensaios clínicos randomizados CREDENCE – Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation)54, DAPA-CKD (Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease)55 e EMPA-Kidney (Empagliflozin in Patients with Chronic Kidney Disease)56 avaliaram o efeito dos inibidores do SGLT2 em pacientes com DM2 e DRD, comprovando a redução de desfechos renais, como a progressão para doença renal avançada, a necessidade de diálise e morte renal.
- No estudo CREDENCE, com canagliflozina, 57,8% dos participantes estavam em uso de metformina e não interferiram nos benefícios renais.54 Uma metanálise de 6 estudos clínicos randomizados, com 51.743 pacientes reportou desfechos renais ou mortalidade em relação ao uso desde o basal de metformina.57 O uso de metformina variou de 21% no DAPA-HF a 82% no DECLARE-TIMI 58. O Hazard Ratio para desfecho composto de piora da função renal, DRT ou morte de causa renal foi de 0,58 (IC 95% de 0,48 a 0,69) com metformina e 0,63 (IC 95% 0,48 a 0,83), sem metformina , com P de interação de 0,62.
- O estudo DAPA-CKD incluiu mais de 4.000 pacientes com DRC, com uma TFGe entre 25-75 mL/min/1,73 m2 e relação albumina/creatinina (> 200mg/g) com e sem DM2.55 Durante um período médio de 2,4 anos, um evento de desfecho primário ocorreu em 197 dos 2.152 participantes (9,2%) no grupo dapagliflozina e em 312 dos 2.152 participantes (14,5%) do grupo placebo (Hazard Ratio , 0,61; IC 95% , 0,51 a 0,72; p <0,001; NNT, 19 [IC 95%, 15 a 27]). O risco para o desfecho composto de um declínio sustentado na TFGe de pelo menos 50%, DRT ou morte por causas renais foi de 0,56 (IC 95%, 0,45 a 0,68; p <0,001), e o risco para o composto de morte por causas cardiovasculares ou hospitalização por insuficiência cardíaca foi de 0,71 (IC 95%, 0,55 a 0,92; p = 0,009). O efeito da dapagliflozina na redução do desfecho primário foi similar no grupo de pacientes com e sem DM.
- O estudo EMPA-Kidneyincluiu 6.609 pacientes com DRC (TFGe entre 20 e 45 ml/min/1,73 m² com ou sem albuminúria, ou TFGe entre 45 e 90 mais a presença de relação albumina/creatinina acima de 200 mg/g).58 Os pacientes foram alocados para empagliflozina 10 mg uma vez ao dia versus placebo. 85% dos pacientes já estavam em uso de inibidor da ECA ou bloqueadores dos receptores de angiotensina, 46% tinham DM, e 27% apresentavam história de doença cardiovascular. O desfecho primário foi o composto de queda sustentada na TFGe em mais de 40%, progressão para doença renal terminal (isto é, atingir TFGe <10, necessidade de diálise ou transplante renal), morte de causa renal ou morte CV. O tempo mediano de seguimento foi de 2 anos. A progressão da doença renal ou morte por DCV ocorreu em 432 de 3.304 (13,1%) no grupo da empaglifozina e em 558 de 3.305 pacientes (16,9%) no grupo placebo (taxa de risco, 0,72; intervalo de confiança [IC] de 95%, 0,64 a 0,82; p <0,001). Os resultados foram semelhantes entre pacientes com ou sem diabetes.
Nota importante 5: Prevenção da progressão da DRD com medidas de estilo de vida
- O tratamento da DRD no DM2 visa evitar a progressão para doença renal terminal, intervir nos eventos cardiovasculares e evitar a morte. Para isso, os fatores de risco de progressão, como a hiperglicemia, hipertensão arterial, albuminúria, dislipidemia, tabagismo, obesidade, alimentação inadequada e sedentarismo, devem ser abordados.
Nota importante 6: Inibidores do SGLT2
- Os inibidores do SGLT2 estão associados a um aumento do risco de infecção genital (RR 3,56, IC 95% 2,84 – 4,46) e um discreto aumento do risco de infecção do trato urinário (RR 1,06, IC95% 1,01-1,12).59
- No estudo CANVAS, a canagliflozina foi associada à maior incidência de fraturas ósseas e amputações de membros inferiores, embora outros estudos não tenham confirmado esses achados.50
- Há raros relatos de casos isolados de gangrena de Fournier (fasceíte necrotizante perineal), mas essa associação não foi observada no estudo DECLARE-TIMI 58.51
- A ocorrência de cetoacidose “euglicêmica” também é rara e está associada à insulinopenia.59
Nota importante 7: Inibidores do ISGLT2 no SUS
- No Brasil, até o momento da atualização desta revisão, a aprovação da ANVISA é para o uso da dapagliflozina 10 mg com TFGe ≥25mL/min/1.73 m² e empagliflozina 10 mg TFGe ≥ 20 mL/min/1.73 m². Entretanto, as diretrizes de Diabetes Luso Brasileira (2023 UPDATE: Luso-Brazilian evidence-based guideline for the management of antidiabetic therapy in type 2 diabetes) e a diretriz da American Diabetes Association (Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO) preconizam valores menores. A tendência será que o valor mínimo da taxa de filtração glomerular seja maior ou igual a 20 mL/min/1,73m². Indicações para dispensação da dapagliflozina 10 mg como Componente Especializado para Diabetes, no SUS
MANEJO ADICIONAL DA HIPERGLICEMIA
METFORMINA
R9. A metformina É RECOMENDADA, em associação ao ISGLT2, para melhora adicional do controle glicemico, visando atingir a meta de HbA1c. A dose de metformina deve ser reduzida para até 1g ao dia, se a TFGe estiver entre 30-45ml/min/1.73m2, e suspensa se menor que 30ml/min/1.73m2, pelo maior risco de acidose lática.
| Classe I | Nível B |
Sumário de evidências:
- Em uma subanálise avaliando os pacientes em uso de metformina do estudo TREAT (Trial to Reduce Cardiovascular Events with Aranesp (darbepoeitin-alfa) Therapy) foram comparados os desfechos cardiovasculares e renais após 4 anos de seguimento entre 3.447 pacientes com DM2 que não usavam metformina e 591 usando metformina, sendo que, destes, 386 apresentavam DRD estágio 3b ou mais avançado. O uso de metformina foi associado a menor risco de mortalidade geral (HR 0,49; IC 95%, 0,36 – 0,69), morte cardiovascular (HR 0,49; IC 95%, 0,32 – 0,74) e desfecho cardiovascular composto (HR 0,67, IC 95%, 0,51 – 0,88), embora sem evidência de benefícios renais específicos. Houve registro de dois casos de acidose lática, confirmando a rara ocorrência desse evento.60 Esses dados sugerem que a metformina parece de fato ser mais segura do que previamente descrito, além de reduzir mortalidade e eventos cardiovasculares em pacientes com DRD avançada.
- Estudo de coorte retrospectivo asiático recente, envolvendo 10.426 pacientes DM2 com DRD, confirma que o uso de metformina foi associado a menor mortalidade geral, com HR 0,65 (IC 95% 0,57 – 0,73; p <0,001) e demonstrou adicionalmente redução de progressão para doença renal terminal, com HR 0,67 (IC 95% 0,58 -0,77; p < 0,001). A metformina não aumentou o risco de acidose lática (HR 0,92; IC 95% 0,668 – 1,276; p = 0,629).61
- Uma revisão sistemática com metanálise recente avaliando segurança e efetividade da metformina em paciente com DRD e TFGe <60ml/min/1,73m2 demostrou a metformina estar associado à redução da mortalidade e sem aumento do risco de acidose com uma TFGe ≥45 mL/min/1,73m2. Entretanto, com TFGe <30mL/min a metformina foi associada a menos benefícios e possíveis aumentos no risco de acidose.62
Nota importante 8: Combinação de ISGLT2 e METFORMINA
- Este painel considerou que o uso dos ISGLT2 deve ser associado desde o início do tratamento à metformina, quando a meta de HbA1c não for atingida, para melhora do controle glicêmico, uma vez que a queda da filtração glomerular reduz a eficácia dos inibidores do SGLT2 no controle da glicemia.
- A metformina é escolhida por ser eficaz e ter sido usada em combinação com ISGLT2 nos grandes estudos em pacientes com DM2. Seu uso, no entanto, deve ser restrito a quando a TFGe estiver acima de 30/ml/min/1,73 m2, e dose máxima de 1g ao dia, se a TFGe estiver entre 30-45 /ml/min/1,73 m2, devido ao maior risco de acidose lática.
AGONISTAS DO GLP-1
SEMAGLUTIDA
R10. Em pacientes DM2 com DRD, TFGe maior que 25 mL/min/1,73 m2 e RAC maior que 100mg/g, a semaglutida DEVE SER CONSIDERADA para redução de desfechos renais.
| Classe IIa | Nível B |
Sumário de evidências:
- O estudo FLOW (Effect of semaglutide versus placebo on the progression of renal impairment in people with type 2 diabetes and chronic kidney disease) é um estudo multicêntrico, que incluiu 3.534 participantes com DM tipo 2 e DRC, conduzido em 28 países. Este estudo duplo-cego, de superioridade, randomizou a semaglutida na dose de 1 mg contra o placebo. O desfecho primário composto foi o declínio persistente da TFGe ≥50% desde o início do ensaio, doença renal terminal, morte por doença renal ou morte por doença cardiovascular. O estudo foi interrompido precocemente por eficácia.68 O ensaio alcançou seu principal objetivo ao demonstrar uma redução estatisticamente significativa e superior na progressão da doença renal, bem como na mortalidade cardiovascular e renal de 24% para as pessoas tratadas com semaglutida 1,0 mg em comparação com o placebo. O desfecho primário combinado incluiu cinco componentes que medem a progressão da DRC e o risco de mortalidade renal e cardiovascular. Tanto os componentes de DRC quanto os componentes cardiovasculares do desfecho primário contribuíram para a redução do risco. Além disso, a superioridade da semaglutida 1 mg em comparação com o placebo foi confirmada para os desfechos secundários.69
OUTROS AGONISTAS DO RECEPTOR DO GLP-1
R11. Em pacientes com DM2, DRD e TFGe maior que 20ml/min/1,73m², os agonistas do GLP-1 (liraglutida, semaglutida e dulaglutida) PODEM SER CONSIDERADOS para redução do risco cardiovascular, do peso e para melhora do controle glicêmico.
| Classe IIb | Nível B |
Sumário de evidências:
- Ensaios clinicos randomizados de segurança cardiovascular mostram que o uso dos agonistas do receptor do GLP-1 (GLP-1 RA), tanto diário63 como semanal64,65 estão associados à diminuição de peso, melhora do controle glicêmico e indiretamente do desfecho renal composto (progressão da albuminúria, duplicação da creatinina e morte de causa renal). Entretanto, o que levou à proteção foi o efeito redutor da albuminúria, chegando a 50%, com pequeno efeito na TFGe e nos demais desfechos.
- Uma metanálise sugere que o efeito na redução da albuminúria é de classe.66 Contudo, é importante destacar que os estudos incluídos nesta metanálise não foram desenhados para avaliar o efeito renal, sendo a albuminúria um desfecho secundário.
- Estudo de vida real com mais de 38 mil pacientes em uso de GLP-1 RA, comparados com inibidores da DPP4, sugere benefício em desfechos duros, com diminuição de 24% de morte renal, de hospitalização por eventos renais ou início de tratamento renal substitutivo.67
INSULINA
R12. O uso de insulina DEVE SER CONSIDERADO como opção para melhora do controle glicêmico em indivíduos com DM2 e DRD e com TFGe maior que 30 mL/min/1,73m2.
| Classe IIa | Nível B |
R13. O uso de insulina É RECOMENDADO para melhora do controle glicêmico em indivíduos com DM2 e DRD com TFGe menor que 30 mL/min/1,73m2, quando a HbA1c estiver acima da meta.
| Classe I | Nível B |
Sumário de evidências: R12 – R13
- O metabolismo da glicose e da insulina é bastante alterado em pacientes com doença renal avançada. Existe um grande risco de hipoglicemia por causa da redução da gliconeogênese renal, da redução da depuração e degradação renal da insulina, do aumento da captação de glicose na diálise, do prejuízo na contra regulação hormonal e da privação nutricional. Então, o uso de insulina com titulação cuidadosa deve ser sempre pensado como a escolha principal para o controle da glicemia.70
- Em relação aos análogos de ação longa, a insulina glargina é segura e eficaz nos pacientes DM2 com DRC avançada, sendo a meia-vida estável e de maior duração de ação. Em um pequeno estudo não randomizado, 89 pacientes com DM2 e DRC (TFGe média de 34,1 ± 11,5 mL/min/1,73 m2) que estavam mal controlados ou que apresentavam hipoglicemias frequentes com agentes orais ou insulina NPH, receberam insulina glargina ao deitar, iniciando com 0,1 U/kg e posteriormente sendo titulada. Em quatro meses, a HbA1c baixou de 8,4% ± 1,6 para 7,7% ± 1,2 (p <0,001), sem afetar o IMC e sem registros de eventos adversos.71
- Um estudo crossover, pequeno, randomizou 34 pacientes DM2 com DRD nos estágios 3 e 4, para insulina glargina U100 ou NPH. Após 24 semanas, a HbA1c foi reduzida com a glargina (-0,91%; p < 0,001), porém não houve benefício com a NPH (0,23%; p = 0,93). Além disso, a incidência de hipoglicemia noturna foi três vezes menor com a glargina (p = 0,047).72
- Em relação ao análogo de ação longa, degludeca, um pequeno estudo observacional, retrospectivo, aberto, com duração de 36 semanas, avaliou seu uso em 36 pacientes com DM2 e TFGe <45 mL/min/1,73 m2. Com a troca de detemir ou glargina (U100 ou U300) para degludeca, a prevalência de hipoglicemia leve reduziu de 78% para 34,2%, e a de hipoglicemia grave, de 8% para 1,3%.73
- O estudo DEVOTE (Dedicated CV outcomes trial), envolvendo 7.637 participantes com DM2 e alto risco de doença cardiovascular, demonstrou a segurança CV da degludeca em relação à glargina-100. A maioria dos pacientes (85,2%) tinha DCV estabelecida ou DRC ou ambos no basal. Houve redução estatisticamente significativa de 40% nas hipoglicemias graves com degludeca versus glargina-100 (4,9 vs. 6,6%; RR 0,60, p < 0,001), com similar controle glicêmico.74
- Uma subanálise do estudo BRIGHT, evidenciou maior redução de HbA1c com a glargina U-300 em relação à degludeca no grupo com TFGe <60 mL/min/1,73m2 (-0.43%; IC 95%: -0.74% a -0.12%), sem diferença na incidência de hipoglicemia. O estudo BRIGHT foi um estudo multicêntrico, aberto, com 24 semanas de duração, com pacientes DM2, que randomizou para glargina-300 noturna (n = 466) ou degludeca-100 (n = 463) com acompanhamento de 24 semanas, com o desfecho principal a redução da HbA1c.75
INIBIDORES DO DPP-4
R14. Em pacientes com DM2 e DRD, com TFGe menor que 30 mL/min/1,73m2 e HbA1c acima da meta, o uso de inibidores da DPP-4 PODE SER CONSIDERADO para melhora do controle glicêmico, desde que observada a correção para TFGe, quando pertinente.
| Classe IIb | Nível B |
Sumário de evidências:
Inibidores da DPP-4
- Em subanálise do ensaio SAVOR-TIMI 53, 336 pacientes com insuficiência renal grave (TFGe <30 mL/min/1,73 m2) foram randomizados para receber saxagliptina ou placebo. Após duração média de dois anos, a saxagliptina não alterou o risco relativo de hospitalização por insuficiência cardíaca, em comparação com o placebo, independentemente da função renal (p = 0,19 para interações). A mediana de HbA1c em um ano foi menor em comparação com o placebo em pacientes tratados com saxagliptina com insuficiência renal grave (7,1% vs. 7,7%, p = 0,002).77
SULFONILUREIAS
R15. O uso da gliclazida MR e da glipizida em pacientes com DM2 e DRD, com TFGe menor que 30 mL/min/1,73m2 PODE SER CONSIDERADO para melhora do controle glicêmico, desde de que com cautela e em doses reduzidas, devido ao maior risco de hipoglicemia nesta população.
| Classe IIb | Nível B |
R16. A glibenclamida está formalmente contra-indicada em pacientes com TFGe menor que 60 mL/min/1,73m2, em função do alto risco de hipoglicemia nestes casos.
| Classe III | Nível C |
Sumário de evidências: R15 – R16
- Devido as sulfonilureias serem pouco estudadas em pacientes com perda de função renal, este painel recomenda cautela no uso destas medicações na DRD e preferentemente em doses menores do que as usuais para minimizar o risco de hipoglicemia.
- A glipizida e a gliclazida sofrem metabolismo hepático quase completo, gerando metabólitos inativos. A função renal, portanto, teoricamente não afeta a depuração ou a meia-vida, podendo estas serem usadas, com cautela e com titulação da dose, quando a TFGe <30 mL/min/1,73m2.73
- Um ensaio clínico randomizado de 54 semanas, com 129 pacientes DM2 acima de 30 anos, com doença renal terminal em diálise e HbA1c 7-9%, comparou glipizida e sitagliptina. O grupo de 64 pacientes usando sitagliptina 25 mg/dia reduziu a HbA1c da linha de base em 0,72% vs. 0,87% nos 65 pacientes que receberam glipizida 2,5 mg/dia. A incidência de hipoglicemias sintomáticas não foi significativamente diferente entre os dois grupos (6,3% com a sitagliptina, e 10,8% com a glipizida). Não ocorreu hipoglicemia grave no grupo com sitagliptina vs. 5 episódios no grupo da glipizida, sem diferença significativa (diferença de 7,8%; IC 95% de -17,1 a -1,9%).76 O tratamento de pacientes DM2 em hemodiálise é seguro tanto com glipizida como com sitagliptina, desde que suas doses sejam ajustadas.
- A Glimepirida pode ser utilizada com TFGe >45ml/min/1.73m2, sendo muito limitada a experiência com TFGe abaixo deste limite.
- A glibenclamida está contra-indicada em bula para pacientes com TFGe <60ml/min/1.73m2 devido à sua excreção renal, embora não tenhamos encontrado estudos em DRD com TFGe abaixo desta faixa.
AJUSTE DE DOSES DE ANTIDIABETICOS DE ACORDO DOM A TFGe
Em relação aos medicamentos utilizados para controle glicêmico na DRD, deve-se levar em conta a TFGe. Na tabela 1 estão apresentados os ajustes dos medicamentos de acordo com o estágio da DRD.78,79
Figura 2. Antidiabéticos com ajustes de dose para a função renal.
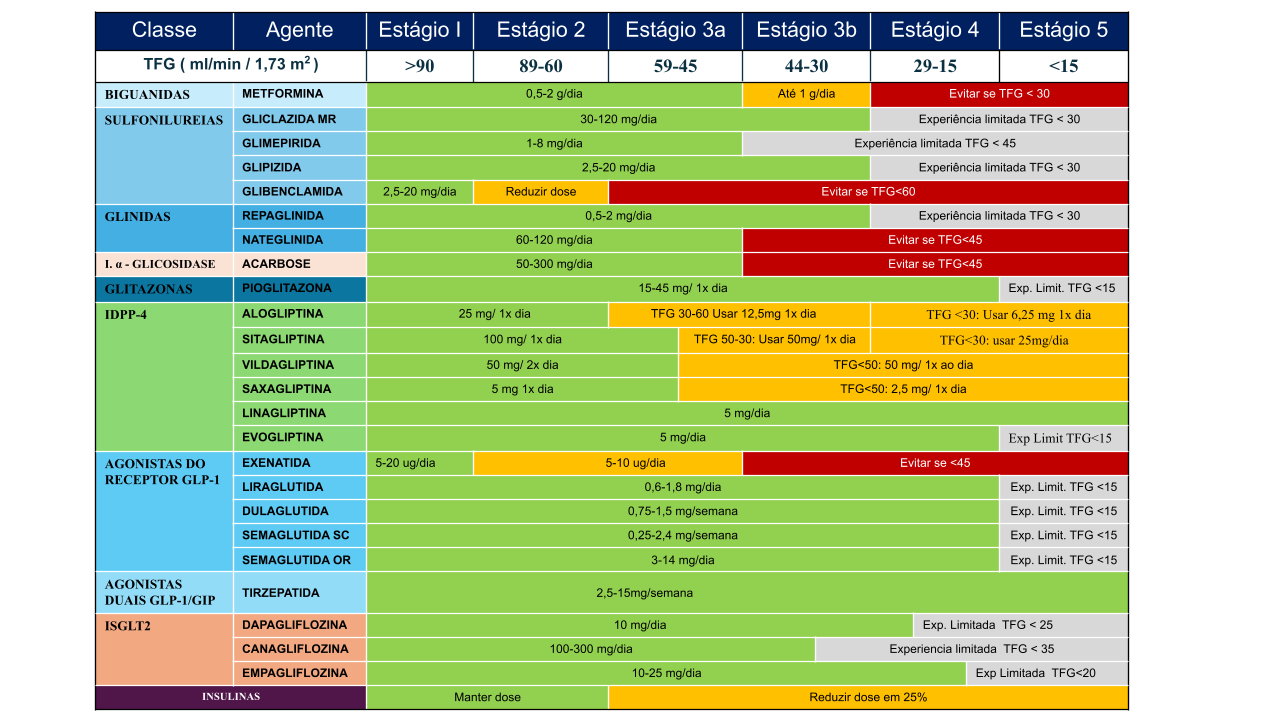
Observações:
A experiência clínica com AR GLP- 1 e AR GLP-1/GIP é limitada quando TFGe <15 mL/min/73 m². Dapagliflozina tem aprovação pela ANVISA para uso na Insuficiência cardíaca com fração de ejeção reduzida e preservada e TFGe >25 mL/min/1,73m2. A pioglitazona, apesar de poder ser usada em todo o espectro da TFGe, está associada a maior risco de descompensação de insuficiência cardíaca, fraturas e aumento de peso, devendo ser avaliado o potencial risco-benefício do uso.
Siglas:
SU: sulfonilureias; in. a-Glicosidase: inibidores da alfa-glicosidase; TFGe: Taxa de filtração glomerular estimada em mL/min/1,73m²; Fonte: Adaptado de Escott et al. (2020).78
Nota importante 9: Opções além da insulina na DRD estágio 5
- Os inibidores da DPP-4 devem ter ajuste de doses de acordo com a TFGe (ver Tabela 1), exceto a linagliptina e a evogliptina, e não devem ser combinados com AR GLP-1 . Os AR GLP-1, isoladamente ou em combinação fixa com insulina podem ser usados apenas quando TFGe estiver acima de 15 mL/min/1,73 m2.
- As sulfonilureias (gliclazida e a glipizida) podem ser utilizadas na DRD grave, porém com cautela e com redução de dose.
- Em adultos com DM2, TFGe <30 mL/min/1,73 m2 e HbA1c acima da meta, os inibidores de DPP-4 ou AR GLP-1 (se TFGe 15–30 mL/min/1,73 m2) PODEM SER CONSIDERADOS para melhorar o controle glicêmico.
Tratamento da hipertensão arterial na DRD
METAS DE PRESSÂO ARTERIAL
R17. É RECOMENDADO o tratamento intensivo da hipertensão arterial sistêmica, em razão dos benefícios cardiovasculares e da evolução da DRD.
| Classe I | Nível A |
Sumário de evidências:
- Metanálise de 40 estudos (70% com subgrupos de DM2 e 30% com DM2 exclusivamente) com 100.354 participantes demonstrou que a redução de 10 mmHg na pressão sistólica está associada a menor risco de mortalidade (RR 0,87; IC 95% 0,78 – 0,96), de eventos cardiovasculares (RR 0,89, IC 95% 0,83 – 0,95), de doença coronariana (RR 0,88; IC 95%; 0,80 – 0,98); de AVC (RR 0,73 IC 95%, 0,64 – 0,83]; de ocorrência de albuminúria (RR 0,83 IC 95% 0,79 –0,87); e de retinopatia (RR 0,87 IC 95% 0,76 – 0,99).81 No entanto, não houve redução na progressão para insuficiência renal dialítica terminal. O maior benefício foi encontrado entre os pacientes com PA sistólica basal ≥140 mmHg. Redução adicional abaixo de 130 mm Hg reduziu os riscos de AVC, retinopatia e albuminúria.81
- Estudos seminais como o de Parving demonstraram redução da EUA com a redução da PA com o uso de captopril.80
R18. A meta de pressão arterial RECOMENDADA para pacientes com DRD é abaixo de 130/80 mmHg, por estar associada a menor risco de AVC, IAM e à redução de albuminúria, em pacientes com DM2.
| Classe I | Nível C |
Sumário de evidências:
- A recomendação para a meta de pressão arterial se baseia na redução do alto risco cardiovascular que estes pacientes apresentam.
- Na presença de DRD, o estudo RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan), envolvendo pacientes com DM tipo 2 proteinúricos, demonstrou que a obtenção de pressão sistólica <130 mmHg foi capaz de desacelerar a progressão da doença renal e adiar a necessidade de diálise.82
- Quanto ao limite inferior de pressão arterial a ser atingido na presença de DRD, o ensaio clínico randomizado, IDNT (Irbesartan Diabetic Nephropathy Trial), evidenciou que níveis de PA ≤120/80 mmHg estão associados a aumento de eventos cardiovasculares.83
- Em metanálise de 19 estudos, incluindo 44.989 participantes (6.960 com DM), que registrou 2.496 eventos cardiovasculares após 3,8 anos (1,0 a 8,4 anos), foi evidenciado que no grupo de tratamento intensivo a pressão atingida foi de 133/76 mmHg, em comparação a 140/81 mmHg, atingida no grupo menos intensivo. No grupo intensivo, foi observada redução do risco relativo de eventos cardiovasculares de 14% (IC 95% 4 – 22%), de IAM 13% (IC 95% 0 – 24%), de AVC 22% (IC 95% 10 – 32%), de albuminúria 10% (IC95% 3 – 16%) e de progressão de retinopatia 19% (IC 95% 0 – 34%). No entanto, não houve benefício para insuficiência cardíaca, mortalidade cardiovascular, mortalidade total ou doença renal terminal. Os benefícios foram evidentes mesmo em pacientes com PA sistólica basal <140 mmHg, sendo mais evidentes nos grupos com doença vascular, renal ou diabetes.84
- A ADA (American Diabetes Association) recomenda que, para indivíduos com alto risco cardiovascular (com doença cardiovascular aterosclerótica (DCVA), ou com risco de DCVA≥15% em dez anos), seja apropriado um alvo de pressão arterial <130/80 mmHg, baseada na análise de risco de estudos prévios.85,86
- Em metanálise recente de dados individuais envolvendo 344.716 indivíduos de 48 ECRs, cerca de 30% com DM, foi demonstrado que a redução de 5 mmHg na pressão arterial sistólica reduziu o risco de eventos cardiovasculares maiores em 10% (AVC fatal e não fatal, IAM fatal e não fatal, cardiopatia isquêmica e insuficiência cardíaca, com morte e internação). Essa redução foi independente do diagnóstico prévio de doença cardiovascular e dos níveis de pressão arterial, havendo benefício mesmo para pressão normal.87
- O estudo STEP (Trial of Intensive Blood-Pressure Control in Older Patients with Hypertension) mostrou benefícios em alcançar metas inferiores a 130/80 mmHg em uma população de idosos. Este estudo incluiu 8.511 participantes, dentre estes, 20% com diagnóstico de diabetes. Durante um período médio de acompanhamento de 3,3 anos, a pressão arterial sistólica média foi de 126 mmHg no grupo de tratamento intensivo e 136 mmHg no grupo de tratamento padrão, com uma diferença média entre os grupos de 9,2 mmHg. O tratamento intensivo resultou em uma redução absoluta de 1,1% no risco de um composto de: acidente vascular encefálico, síndrome coronariana aguda, insuficiência cardíaca descompensada, revascularização, fibrilação atrial ou morte cardiovascular, em relação ao tratamento convencional. O risco relativo foi reduzido em 26%.88
INIBIDORES DA ENZIMA CONVERSORA DA ANGIOTENSINA (IECA) E BLOQUEADORES DO RECEPTOR DA ANGIOTENSINA II (BRA)
R19 – O uso de inibidores da enzima conversora da angiotensina (IECA) ou de bloqueadores do receptor da angiotensina II (BRA) É RECOMENDADO para pacientes que apresentem RAC>30mg/g, com o objetivo de reduzir a progressão da doença renal, independentemente dos níveis da pressão arterial.
| Classe I | Nível A |
Sumário de evidências:
- Os fármacos que bloqueiam o sistema renina-angiotensina-aldosterona (IECA e BRA), reduzem a RAC e a progressão para estágios mais avançados da DRD, independentemente do efeito pressórico.82,89,90,91,95
- Uma metanálise incluindo 24 estudos (20 com IECA e 4 com BRA) demostrou que os IECA e os BRA foram associados a uma tendência para redução de insuficiência renal terminal (RR 0,70; IC 95% 0,46 – 1,05) e (RR 0,78; IC 95% 0,67 – 0,91), respectivamente. Ambos reduziram o risco de duplicação da creatinina (RR 0,71; IC95% 0,56 – 0,91 para IECA e RR 0,79; IC 95% 0,68 – 0,91 para BRA), mas nenhum reduziu mortalidade.91
- Metanálise posterior demonstrou que o bloqueio do SRAA com IECA ou BRA reduz a albuminúria em pacientes com DM1 e com DM2 com microalbuminúria, e a progressão para macroalbuminúria, mas não a insuficiência renal terminal ou a mortalidade.92
- O estudo DETAIL (Diabetics Exposed to Telmisartan and Enalapril) mostrou equivalência das duas classes de fármacos em pessoas com DM2 e DRD com micro ou macroalbuminúria.93
- Outra metanálise com 100 estudos e dados de 22.365 pacientes com DRD, a maioria com DM2, não mostrou diferença entre IECA e BRA para prevenir doença renal terminal e duplicação da creatinina, assim como apresentaram efeitos semelhantes na redução da albuminúria.94
R20 – O uso combinado de IECA e BRA NÃO É RECOMENDADO, pelo maior risco de hipercalemia, piora da função renal, hipotensão postural e síncope.
| Classe III | Nível A |
Sumário de evidências:
- O estudo ONTARGET comparou o IECA, ramipril com o BRA, telmisartana em monoterapia, e em combinação, em um ensaio clinico randomizado duplo-cego com 8.542 pacientes com doença vascular ou diabetes de alto-risco cardiovascular. O desfecho primário foi morte por doença cardiovascular, infarto agudo do miocárdio, AVC e/ou hospitalização por insuficiência cardíaca. O seguimento médio foi de 56 meses. Em torno de 38% dos pacientes tinham DM2. Comparado ao ramipril, a ocorrência do desfecho primário foi semelhante entre os grupos telmisartana e ramipril (16,7% e 16,5%, respectivamente, HR 1,01 (IC95% 0,94-1,09). A combinação ramipril-telmisartana comparada ao grupo ramipril em monoterapia não foi superior em relação ao desfecho primário (16,3% ,HR 0,99 IC95% 0,92-1,07). No entanto, quando comparada ao grupo ramipril, houve aumento dos sintomas de hipotensão (4,8% vs. 1,7% p<0,001, síncope (0,3% vs 0,2% p=0,03 e disfunção renal 13,5% vs 10,2% p<0,001. A combinação portanto, foi associada a maior número de efeitos adversos sem aumento do benefício.133
- O estudo VA-NEPHRON D avaliou o uso de losartana (100 mg/dia) em pacientes DM2 com albuminúria de 300 mg/g e TFGe 30 – 89,9 mL/min/1,73 m2, com randomização para adição de lisinopril (10 mg/dia – 40 mg/dia) ou placebo. O estudo foi interrompido precocemente, e nos 1,448 pacientes com “follow-up” de 2,2 anos, houve 152 eventos no grupo monoterapia e 132 na combinação (HR 0,88; IC 95%, 0,70 – 1,12; p = 0,30). Não houve redução de mortalidade ou de eventos cardiovasculares. No entanto, houve aumento no risco de hipercalemia (6,3 eventos per 100 pessoas/ano vs. 2,6 eventos na monoterapia, p <0,001) e de dano renal agudo (12,2 eventos vs. 6,7 eventos por 100 pessoas-ano, p <0,001).96
ANTAGONISTAS DO RECEPTOR MINERALOCORTICÓIDE (ARM)
R21 – O uso de antagonistas esteroidais do receptor mineralocorticoide (espironolactona, eplerenona) PODE SER CONSIDERADO para controle da pressão arterial e proteção renal, em associação com os IECAs ou BRAs, em pacientes com TFGe maior ou igual a 25 mL/min/1,73 m², com valores de potássio sérico menores ou iguais a 4,8 mEq/L.
| Classe IIb | Nível B |
Sumário de evidências:
- Metanálise recente, avaliando o efeito nefroprotetor dos antagonistas esteroidais dos receptores mineralocorticoides (ARM), envolveu 22 estudos em pacientes com DRD e 12 estudos com doença renal não diabética. Esses agentes, de forma isolada ou em combinação com bloqueio do SRA, reduziram a EUA em 24,55% e a proteinúria em 53,93%, quando comparados com placebo.98
Nota importante 10: Espironolactona
- A espironolactona pode levar à importante redução da albuminúria, mas não se deve esquecer seus efeitos colaterais, principalmente em homens, como a ginecomastia e disfunção sexual.97
R22 – O uso de antagonistas não-esteroidais do receptor mineralocorticoide (finerenona) DEVE SER CONSIDERADO para proteção renal, independentemente da pressão arterial, e em associação a doses máximas toleradas de IECA ou BRA, nos pacientes com DRD e TFGe entre 25 e 60 mL/min/1,73 m², RAC maior que 30 mg/g e potássio sérico menor ou igual a 5,0 mEq/L.
| Classe IIa | Nível A |
Sumário de Evidências:
- A finerenona é um ARM seletivo não-esteroidal que demonstrou bloquear muitos dos efeitos prejudiciais da superativação dos receptores mineralocorticoides, que desempenham um papel importante na progressão da doença cardiorrenal. Os ensaios clínicos randomizados FIDELIO-DKD e FIGARO-DKD em pacientes com DM2 e DRC examinaram os resultados cardiovasculares e renais em diferentes estágios de doença renal em pacientes que utilizaram essa medicação.99,100
- No estudo FIDELIO-DKD, os participantes com DM2, DRD e RAC (razão albumina-creatinina na urina ≥30-5000 mg/g e TFGe ≥25-<75 ml/min/1,73 m2), sem insuficiência cardíaca (IC), sintomática, tratados com IECA ou BRA, otimizados e randomizados para finerenona ou placebo, tiveram o desfecho cardiovascular (CV) composto (morte CV, infarto do miocárdio não fatal, acidente vascular cerebral não fatal ou hospitalização por insuficiência cardíaca) e o desfecho renal composto (insuficiência renal, diminuição sustentada ≥40% na TFGe em relação ao valor basal ou morte renal) avaliados.101 Dos 5.674 pacientes, 436 (7,7%) tinham histórico de IC. Ao longo de um acompanhamento médio de 2,6 anos, os pacientes do braço intervenção tiveram menor incidência do desfecho principal composto (queda sustentada da TFGe >40%, progressão para diálise ou morte renal), com HR 0,82 IC 95% de 0,73 – 0,93, p = 0,001, além de menor desfecho cardiovascular secundário (morte cardiovascular, IAM, AVE não fatal, hospitalização por insuficiência cardíaca), HR 0,86 IC 95% 0,75 – 0,99, p = 0,03. Para admissão no estudo, o valor do potássio sérico deveria ser ≤4,8 mmol/L. A finerenona foi bem tolerada, levando a um discreto aumento da hipercalemia.99
- No estudo FIGARO-DKD, esta observação foi expandida para 7.437 pacientes com DM2 e DRC (relação albumina/creatinina 30–300 mg/g e TFGe entre 25 e 90 mL/min/1,73m2 – DRC estágios 2–4; ou relação albumina/creatinina entre 300 e 5000 mg /g e TFGe superior a 60 mL/min/1,73m 2 -DRC estágios 1–2) randomizados para finerenona ou placebo, além do bloqueio do SRAA na dose máxima tolerada. Pacientes em uso da finerenona tiveram uma redução significativa no desfecho primário composto (MACE) de eventos não fatais (infarto do miocárdio, AVC e hospitalização devido a insuficiência cardíaca) e mortes por causas cardiovasculares (HR 0,87; IC 95% 0,76 a 0,98; p = 0,03). O benefício foi impulsionado principalmente por uma redução da incidência de hospitalização por insuficiência cardíaca no grupo em uso de finerenona, comparado ao placebo (HR 0,71; 95% IC, 0,56 a 0,90). Com relação ao desfecho renal composto secundário (insuficiência renal, diminuição sustentada de ≥40% na TFGe ou óbito por causas renais), ocorreu em 350 pacientes (9,5%) no grupo finerenona e em 395 (10,8%) no grupo placebo (HR 0,87; IC 95%, 0,76 a 1,01). A hipercalemia foi quatro vezes mais frequente no grupo finerenona (1,2% vs. 0,4%).100
- O estudo FIDELITY compilou os dados combinados destes dois ensaios FIDELIO-DKD e FIGARO-DKD que juntos recrutaram 13.026 participantes durante um período de acompanhamento de 3 anos. Dos 13.023 participantes no estudo FIDELITY, 890 (7%) apresentaram DRC em estágio 4 (DRC-4). A razão de risco para o desfecho cardiovascular composto com finerenona em comparação com o placebo foi de 0,78 (IC 95%: 0,57-1,07).102 A suposição proporcional de riscos para o desfecho renal composto renal não foi consistente ao longo do tempo, com um efeito protetor observado apenas até 2 anos, após o qual a direção da associação tornou-se inconsistente e uma perda de precisão ao longo do tempo foi observada nas diferenças de risco entre finerenona e placebo. No entanto, a albuminúria e a taxa de declínio da TFGe foram consistentemente reduzidas com finerenona em comparação ao grupo placebo. Os eventos adversos foram equilibrados entre os grupos de tratamento. A hipercalemia foi o evento adverso mais comum relatado (26% e 13% para finerenona versus placebo, respectivamente); no entanto, a incidência de hipercalemia levando à descontinuação permanente foi baixa (3% e 2% para finerenona versus placebo, respectivamente).
- Os dados da análise FIDELITY sugerem que o uso de finerenona foi associado a uma redução significativa de 20% na doença renal em estágio terminal, bem como reduções em todos os desfechos renais não fatais incluídos no resultado renal composto do estudo. Estes resultados demonstraram que o tratamento com finerenona foi capaz de reduzir o risco de desfechos cardiovasculares e renais comparado ao placebo nos estágios 1 a 4 da doença renal crônica em pacientes com diabetes tipo 2.103
- É importante ressaltar que 6,7% dos pacientes destes estudos, estavam em uso de ISGLT2, terapia hoje estabelecida como padrão para os pacientes com DM2 e DRC, uma vez que os pacientes do estudo foram randomizados entre os anos 2015 e 2018 e e 7,2% estavam em uso de AR GLP-1. Um possível efeito benéfico desta associação de inibidores de SGLT2 com finerenona, além da redução dos desfechos cardiovasculares, é a redução do risco de hipercalemia.
Nota importante 11: Associação de Finerenona com ISGLT2
- Até o momento não há estudos dedicados à associação Finerenona e ISGLT2 em relação a um possivel efeito aditivo na proteção renal. Os dados preliminares são muito escassos advindos de análises de subgrupos da análise combinada FIDELITY que mostram uma tendencia para benefício adicional. Os resultados do estudo CONFIDENCE deverão definir esta questão.
Tratamento da dislipidemia na DRD
TRATAMENTO DA DISLIPIDEMIA NÃO-DIALÍTICA
R23 – O uso de estatinas de alta potência É RECOMENDADO em pacientes com DRD e TFGe menor que 60 mL/min/1,73m² (não dialítica) e em pacientes pós-transplante renal, com o objetivo de reduzir eventos cardiovasculares.
| Classe I | Nível B |
Sumário de evidências:
REDUÇÃO DO RISCO RENAL
- Na subanálise de desfechos renais do estudo CARDS, que randomizou 2.838 indivíduos com DM2 sem doença cardiovascular prévia para receber atorvastatina 10 mg uma vez ao dia ou placebo, 34% dos pacientes tinham TFGe entre 30 e 60 mL/min/1,73 m2 e 21,5% tinham albuminúria. A atorvastatina foi associada a uma modesta melhora da redução anual da TFGe (0,18 mL/min/1,73 m2/ano, IC 95% 0,04 – 0,32); p = 0,01, mas não alterou a incidência de novos casos de albuminúria ou de regressão para normoalbuminúria.104
REDUÇÃO DO RISCO CARDIOVASCULAR
- O uso de estatinas diminui o número de eventos cardiovasculares (desfecho combinado) sem diminuir a mortalidade geral ou cardiovascular nos pacientes com DRD avançada, independentemente das doses utilizadas.105,106
- No estudo CARDS, em 970 pacientes com TFGe 30-60 mL/min/1,73 m2, houve redução de 42% de eventos cardiovasculares maiores no grupo usando atorvastatina 10 mg e redução de 61% de AVC isquêmico, similar ao observado na análise com todos os pacientes do estudo (redução de 37% em eventos cardiovasculares (p de interação = 0,4).107
- As estatinas apresentam efeito modesto sobre a albuminúria e sobre a velocidade de queda de TFGe105 e parecem não afetar a taxa de eventos duros renais, isto é, progressão para insuficiência renal, como sugerido em metanálise com mais de 143.000 participantes.108
- A National Kidney Foundation recomenda o uso de estatinas com o objetivo de reduzir eventos cardiovasculares, porém não a mortalidade, em pacientes com DM pré-dialíticos.109
- No estudo SHARP (Study of Heart and Renal Protection), a combinação de sinvastatina com ezetimiba não reduziu o risco de desfechos primários nos pacientes em diálise. Esses dados indicam que, apesar da redução significativa observada nos valores do LDL colesterol, o uso de estatina deve ser anterior à perda importante da função renal, e não se recomenda iniciar o medicamento nos pacientes em diálise com o objetivo de prevenção primária de eventos cardiovasculares.110 Não existem dados, entretanto, que recomendem a suspensão de estatinas quando já estiverem em uso antes do início da diálise, sendo sugerida, nessa situação, a sua manutenção.111
- No caso dos pacientes pós-transplante renal, no estudo ALERT, o uso de estatinas foi associado a menor risco de morte de origem cardíaca, infarto e procedimentos intervencionistas cardíacos.112 Com base nesse resultado, recomenda-se também o uso de estatinas em pacientes com DM tipo 2 pós-transplante renal.113
Nota importante 12: Uso de fibratos
- O uso de fibratos pode estar associado à discreta queda da TFGe, efeito transitório o qual é revertido com a suspensão do fármaco o qual aparentemente não é secundário à lesão renal.113 Em relação ao efeito sobre a EUA, os fibratos oferecem benefício pequeno em pacientes com DRD.114,115 Assim, os fibratos somente devem ser usados no caso de triglicérides muito elevados (>880 mg/dL), para reduzir o risco de pancreatite aguda. Ressalta-se a necessidade de ajuste das doses de acordo com a função renal.116
TRATAMENTO DA DISLIPIDEMIA NA DRD DIALÍTICA
R24 – Em pacientes com DRD em diálise, sem doença arterial coronariana clínica, NÃO ESTÁ RECOMENDADO iniciar o uso de estatinas. No entanto, nos pacientes que já usavam estatina antes do início da diálise, esta deve ser mantida.
| Classe III | Nível A |
Sumário de evidências:
- No estudo 4D (Die Deutsch Diabetes Dialyze), foram avaliados 1.255 pacientes com DM2 em hemodiálise, sendo que 22% tinham DAC. Eles foram randomizados para atorvastatina 20 mg ou placebo e seguidos por quatro anos. O desfecho primário foi um composto de morte por causas cardíacas, IAM não fatal e AVC. Redução de 42% no LDL-c foi observada em pacientes com atorvastatina, sem redução no desfecho primário. O risco de AVC também foi maior neste grupo.117
- O estudo AURORA (Rosuvastatin and cardiovascular events in patients undergoing hemodialysis) incluiu 2.776 pacientes em hemodiálise (com idade entre 50 anos e 80 anos, 27,9% com DM e 39% com DAC) tratados com rosuvastatina 10 mg/dia ou placebo durante 3,8 anos de média. O desfecho primário foi um composto de infarto do miocárdio não fatal, AVC não fatal e morte cardiovascular. Houve redução de 43% no LDL-c no grupo de intervenção, mas nenhuma diferença no desfecho primário foi observada entre os grupos.118,119
- Em relação aos pacientes com DRC, mas não em hemodiálise, o banco de dados do Pravastatin Pooling Project fez uma análise combinada dos resultados de três ensaios randomizados com pravastatina 40 mg vs. placebo, incluindo 19.700 pacientes com insuficiência renal crônica (TFGe estimada de 60 a 30 mL/min/1,73 m2). Foi observado benefício significativo do tratamento na redução do desfecho primário de infarto do miocárdio, morte coronariana ou revascularização percutânea e mortalidade total neste grupo de pacientes.120
- Nem a atorvastatina nem a rosuvastatina reduziram a mortalidade cardiovascular, infarto e/ou acidente vascular encefálico em pacientes em hemodiálise.117,119 No entanto, em análise post hoc de 731 pacientes com DM2, observou-se redução do risco de eventos cardíacos fatais e não fatais com o uso de rosuvastatina.121
- O estudo SHARP (The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease) teve como objetivo avaliar a eficácia e a segurança da combinação de sinvastatina mais ezetimiba em indivíduos com DRC moderada a grave. Trata-se de estudo randomizado e duplo-cego, que incluiu 9.270 pacientes com DRC (3.023 em diálise e 6.247 não), sem história conhecida de infarto do miocárdio ou revascularização coronariana. Os pacientes foram randomizados para sinvastatina 20 mg mais ezetimiba 10 mg por dia vs. placebo das duas medicações. O principal desfecho pré especificado foi o primeiro evento aterosclerótico maior (infarto do miocárdio não fatal ou morte coronária, AVC não hemorrágico ou qualquer procedimento de revascularização arterial). Um total de 4.650 pacientes foram designados para receber sinvastatina mais ezetimiba e 4.620 para placebo. O grupo alocado para o braço sinvastatina e ezetimiba apresentou redução média de LDL-c de 33 mg/dL durante acompanhamento médio de 4,9 anos. Houve redução proporcional de 17% para os eventos ateroscleróticos maiores para sinvastatina mais ezetimiba, em comparação com o placebo (526; 11,3% vs. 619; 13,4%; RR 0,83; IC 95% 0,74 – 0,94; p = 0,0021). Os pacientes que receberam sinvastatina e ezetimiba não diferiram com relação a infarto do miocárdio não fatal ou morte por doença coronária (213; 4,6% vs. 230; 5,0%; RR 0,92; IC 95% 0,76 – 1,11; p = 0,37). Houve reduções significativas para o AVC não hemorrágico (131; 2,8% vs.174; 3,8%; RR 0,75; IC 95 % 0,60 – 0,94; p = 0,01) e procedimentos de revascularização arterial (284; 6,1% vs. 352; 7,6%; RR 0,79; IC 95% 0,68 – 0,93; p = 0,0036). Após ajustes para subgrupos específicos de LDL-c, não houve diferenças entre os efeitos proporcionais nos desfechos principais e na taxa total de eventos em qualquer subgrupo examinado e, em particular, em pacientes sob diálise vs. aqueles que não estavam em diálise. O estudo concluiu que a redução do LDL-colesterol com sinvastatina 20 mg associada à ezetimiba 10 mg reduziu a incidência de eventos ateroscleróticos maiores em pacientes com DRC avançada.52,110
- Uma subanálise do estudo TNT avaliou como a redução intensiva de lipídios com 80 mg de atorvastatina afetaria a função renal, em comparação com 10 mg, em pacientes com doença coronariana. Um total de 10.001 pacientes com doença coronária e níveis de LDL-c <130 mg/dL foram randomizados de forma duplo-cega para terapia com 10 mg/dia ou 80 mg/dia de atorvastatina. A TFGe utilizando a equação MDRD (Modification of Diet in Renal Disease) foi comparada no início e no final do seguimento em 9.656 participantes. Não foi observado declínio na função renal em cinco anos. Ao contrário, a TFGe estimada melhorou em ambos os grupos de tratamento e foi significativamente maior com a dose de 80 mg, sugerindo que tal benefício pode estar relacionado à dosagem da medicação.122
R25 – Em pacientes em hemodiálise e LDL-c acima de 145 mg/dL e/ou com doença coronariana estabelecida, o início de estatinas de alta potência DEVE SER CONSIDERADO.
| Classe IIa | Nível B |
Sumário de evidências:
- Em análise post-hoc de 731 pacientes com DM2, observou-se redução do risco de eventos cardíacos fatais e não fatais com o uso de rosuvastatina.121 Baseado em análise de subgrupo do estudo 4D, em que pacientes com LDL acima de 145 mg/dL tiveram benefício em redução de mortalidade cardiovascular, IAM não fatal, morte por qualquer causa e morte súbita.122
TERAPIA NUTRICIONAL NA DRD
R26 – Em pacientes com DRD e TFGe entre 15 e 30 mL/min ou abaixo de 15 mL/min, não dialítico, É RECOMENDADA a restrição de proteínas da dieta em 0,8g/kg de peso ideal/dia.
| Classe I | Nível B |
Sumário de evidências:
- A restrição proteica tem sido sugerida em pacientes com DRC de várias etiologias. É uma mudança de estilo de vida difícil de ser implementada, pela baixa aderência. Em razão da falta de consenso na literatura sobre o benefício da restrição proteica em pacientes com DM e aumento de EUA, mas TFGe preservada, não existe recomendação específica para esses pacientes.123,124 Metanálise recente avaliou pacientes com DRD estágio 1 a 3 e observou benefício significativo da dieta hipoproteica (<0,8 g/kg de peso ideal/dia) na redução da proteinúria (SMD − 0.96 unidades, 95% CI − 1.81, − 0.11; P = 0.03).125
- Nos pacientes com aumento da RAC e redução da TFGe, a restrição moderada de proteínas da dieta (0,8 g/kg de peso ideal/dia) é recomendada.47,126
- A ingestão proteica acima de 20% das calorias diárias ou acima de 1,3 g/kg peso ideal/dia está associada à albuminúria aumentada, perda mais rápida da função renal e mortalidade CV; portanto, deve ser evitada. Uma metanálise com 779 pacientes de 13 ECRs demonstrou haver benefício de uma dieta pobre em proteínas com melhora da TFGe e redução da proteinúria.127,128
- O efeito da restrição proteica fica mais evidente quanto maior é a adesão à modificação dietética e quando há o uso de inibidores do SRAA é menos frequente e o controle da PA menos estrito.129
R27 – DEVE SER CONSIDERADO o limite de ingestão de sódio em até 1,5 g/dia, ou de sal, em até 3,75 g/dia, quando houver hipertensão arterial.
| Classe IIa | Nível B |
Sumário de evidências:
- Ao serem feitas recomendações dietoterápicas para pacientes com DRD, deve-se levar em consideração que, em sua maioria, existe hipertensão associada. Assim, limitar a ingestão de sal deve ser um objetivo a ser atingido.130
- A diminuição de sal na dieta potencializa o efeito anti-hipertensivo dos fármacos.Além disso, o efeito renal e cardiovascular dos BRAs são potencializados quando associados à restrição da ingestão de sal.131
- A restrição de sal deve estar incluída em um padrão de dieta do tipo DASH (Dietary Approaches to Stop Hypertension), isto é, com elevado consumo de frutas, vegetais e produtos lácteos magros. Em pacientes com DM2, esse padrão de dieta está associado a menores valores de pressão arterial. Essa dieta, entretanto, não é recomendada para pacientes em diálise.132
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1 – É RECOMENDADO que o primeiro rastreamento da DRD seja feito com amostra de urina aleatória para determinação da Razão Albumina Creatinina (RAC) e determinação da taxa de filtração glomerular estimada (TFGe) determinada pela creatinina sérica, a partir da equação CKD-EPI. O rastreamento deve ser feito logo ao diagnóstico no DM2, e aos 5 anos do diagnóstico de DM1, e repetido, 1 a 4 vezes ao ano. | I | B |
| R2 – É RECOMENDADO que todo teste anormal da RAC seja confirmado em, pelo menos, 2 de 3 amostras repetidas no período de três a seis meses por causa da variabilidade diária. | I | B |
| R3 – Em indivíduos com DM1 ou DM2, É RECOMENDADO buscar a meta de HbA1c 6,5-7%, quando a TFGe for maior que 60 ml/min/1.73m2 e a RAC maior que 30mg/g, para reduzir a progressão da albuminúria e a progressão da DRD a longo prazo. | I | A |
| R4 – É RECOMENDADO atingir e manter a meta de HbA1c entre 7-7,9% em indivíduos com DM1 ou DM2, quando a TFGe for menor que 60 ml/min/1.73m2 ou o paciente estiver em diálise, para evitar excesso de mortalidade. | I | B |
| R5 – Em pacientes com TFGe maior ou igual a 60 mL/min/1,73m² e RAC maior ou igual a 30 mg/g, a terapia inicial com inibidores do SGLT2 É RECOMENDADA, independentemente da HbA1c. | I | A |
| R6 – Em pacientes com TFGe entre 30 e 60 mL/min/1,73m², a terapia inicial com inibidores do SGLT2 É RECOMENDADA, independentemente da RAC ou da HbA1c. A canagliflozina entretanto não deverá ser iniciada com TFGe menor que 35ml/min/1.73m2. | I | A |
| R7 – Em pacientes com TFGe entre 20 e 30 mL/min/1,73m², É RECOMENDADO iniciar inibidores do SGLT2, independentemente da RAC ou da HbA1c. A empagliflozina e a dapagliflozina não deverão ser iniciadas com TFGe menor que 20 e menor que 25/min/1.73m2, respectivamente. | I | A |
| R8 – Em pacientes com TFGe menor que 20mL/min/1,73m², embora os ISGLT2 não devam ser iniciados, sua manutenção PODE SER CONSIDERADA, independentemente da HBA1c ou da RAC. | IIb | B |
| R9 – A metformina É RECOMENDADA, em associação ao ISGLT2, para melhora adicional do controle glicemico, visando atingir a meta de HbA1c. A dose de metformina deve ser reduzida para até 1g ao dia, se a TFGe estiver entre 30-45ml/min/1.73m2, e suspensa se menor que 30ml/min/1.73m2, pelo maior risco de acidose lática. | I | B |
| R10 – Em pacientes DM2 com DRD, TFGe maior que 25 mL/min/1,73 m2 e RAC maior que 100mg/g, a semaglutida DEVE SER CONSIDERADA para redução de desfechos renais. | IIa | B |
| R11 – Em pacientes com DM2, DRD e TFGe maior que 20ml/min/1,73m², os agonistas do GLP-1 (liraglutida, semaglutida e dulaglutida) PODEM SER CONSIDERADOS para redução do risco cardiovascular, do peso e para melhora do controle glicêmico. | IIb | B |
| R12 – O uso de insulina DEVE SER CONSIDERADO como opção para melhora do controle glicêmico em indivíduos com DM2 e DRD e com TFGe maior que 30 mL/min/1,73m2. | IIa | B |
| R13 – O uso de insulina É RECOMENDADO para melhora do controle glicêmico em indivíduos com DM2 e DRD com TFGe menor que 30 mL/min/1,73m2, quando a HbA1c estiver acima da meta. | I | B |
| R14 – Em pacientes com DM2 e DRD, com TFGe menor que 30 mL/min/1,73m2 e HbA1c acima da meta, o uso de inibidores da DPP-4 PODE SER CONSIDERADO para melhora do controle glicêmico, desde que observada a correção para TFGe, quando pertinente. | IIb | B |
| R15 – O uso da gliclazida MR e da glipizida em pacientes com DM2 e DRD, com TFGe menor que 30 mL/min/1,73m2 PODE SER CONSIDERADO para melhora do controle glicêmico, desde de que com cautela e em doses reduzidas, devido ao maior risco de hipoglicemia nesta população. | IIb | B |
| R16 – A glibenclamida está formalmente CONTRA-INDICADA em pacientes com TFGe menor que 60 mL/min/1,73m2, em função do alto risco de hipoglicemia nestes casos. | III | C |
| R17 – É RECOMENDADO o tratamento intensivo da hipertensão arterial sistêmica, em razão dos benefícios cardiovasculares e da evolução da DRD. | I | A |
| R18 – A meta de pressão arterial RECOMENDADA para pacientes com DRD é abaixo de 130/80 mmHg, por estar associada a menor risco de AVC, IAM e à redução de albuminúria, em pacientes com DM2. | I | C |
| R19 – O uso de inibidores da enzima conversora da angiotensina (IECA) ou de bloqueadores do receptor da angiotensina II (BRA) É RECOMENDADO para pacientes que apresentem RAC>30mg/g, com o objetivo de reduzir a progressão da doença renal, independentemente dos níveis da pressão arterial. | I | A |
| R20 – O uso combinado de IECA e BRA NÃO É RECOMENDADO, pelo maior risco de hipercalemia, piora da função renal, hipotensão postural e síncope. | III | A |
| R21 – O uso de antagonistas esteroidais do receptor mineralocorticoide (espironolactona, eplerenona) PODE SER CONSIDERADO para controle da pressão arterial e proteção renal, em associação com os IECAs ou BRAs, em pacientes com TFGe maior ou igual a 25 mL/min/1,73 m², com valores de potássio sérico menores ou iguais a 4,8 mEq/L. | IIb | B |
| R22 – O uso de antagonistas não-esteroidais do receptor mineralocorticoide (finerenona) DEVE SER CONSIDERADO para proteção renal, independentemente da pressão arterial, e em associação a doses máximas toleradas de IECA ou BRA, nos pacientes com DRD e TFGe entre 25 e 60 mL/min/1,73 m², RAC maior que 30 mg/g e potássio sérico menor ou igual a 5,0 mEq/L. | IIa | A |
| R23 – O uso de estatinas de alta potência É RECOMENDADO em pacientes com DRD e TFGe menor que 60 mL/min/1,73m² (não dialítica) e em pacientes pós-transplante renal, com o objetivo de reduzir eventos cardiovasculares. | I | B |
| R24 – Em pacientes com DRD em diálise, sem doença arterial coronariana clínica, NÃO ESTÁ RECOMENDADO iniciar o uso de estatinas. No entanto, nos pacientes que já usavam estatina antes do início da diálise, esta deve ser mantida. | III | A |
| R25 – Em pacientes em hemodiálise e LDL-c acima de 145 mg/dL e/ou com doença coronariana estabelecida, o início de estatinas de alta potência DEVE SER CONSIDERADO. | IIa | B |
| R26 – Em pacientes com DRD e TFGe entre 15 e 30 mL/min ou abaixo de 15 mL/min, não dialítico, É RECOMENDADA a restrição de proteínas da dieta em 0,8g/kg de peso ideal/dia. | I | B |
| R27 – DEVE SER CONSIDERADO o limite de ingestão de sódio em até 1,5 g/dia, ou de sal, em até 3,75 g/dia, quando houver hipertensão arterial. | IIa | B |
Referências
- Colhoun HM, Lee ET, Bennett PH, et al. Risk factors for renal failure: the WHO Mulinational Study of Vascular Disease in Diabetes. Diabetologia 2001;44 Suppl 2:S46-53. (In eng). DOI: 10.1007/pl00002939.
- Nerbass FB, Lima HdN, Moura-Neto JA, Lugon JR, Sesso R. Censo Brasileiro de Diálise 2022. Brazilian Journal of Nephrology 2024;46(2). DOI: https://doi.org/10.1590/2175-8239-JBN-2023-0062pt.
- Wu AY, Kong NC, de Leon FA, et al. An alarmingly high prevalence of diabetic nephropathy in Asian type 2 diabetic patients: the MicroAlbuminuria Prevalence (MAP) Study. Diabetologia 2005;48(1):17-26. (In eng). DOI: 10.1007/s00125-004-1599-9.
- de Boer IH, Rue TC, Hall YN, Heagerty PJ, Weiss NS, Himmelfarb J. Temporal trends in the prevalence of diabetic kidney disease in the United States. Jama 2011;305(24):2532-9. (In eng). DOI: 10.1001/jama.2011.861.
- Afkarian M, Zelnick LR, Hall YN, et al. Clinical Manifestations of Kidney Disease Among US Adults With Diabetes, 1988-2014. Jama 2016;316(6):602-10. (In eng). DOI: 10.1001/jama.2016.10924.
- Janmohamed MN, Kalluvya SE, Mueller A, et al. Prevalence of chronic kidney disease in diabetic adult out-patients in Tanzania. BMC Nephrol 2013;14:183. (In eng). DOI: 10.1186/1471-2369-14-183.
- Nichols GA, Déruaz-Luyet A, Hauske SJ, Brodovicz KG. The association between estimated glomerular filtration rate, albuminuria, and risk of cardiovascular hospitalizations and all-cause mortality among patients with type 2 diabetes. J Diabetes Complications 2018;32(3):291-297. (In eng). DOI: 10.1016/j.jdiacomp.2017.12.003.
- Salinero-Fort M, San Andrés-Rebollo FJ, de Burgos-Lunar C, et al. Cardiovascular and all-cause mortality in patients with type 2 diabetes mellitus in the MADIABETES Cohort Study: Association with chronic kidney disease. J Diabetes Complications 2016;30(2):227-36. (In eng). DOI: 10.1016/j.jdiacomp.2015.10.007.
- So WY, Kong APS, Ma RCW, et al. Glomerular Filtration Rate, Cardiorenal End Points, and All-Cause Mortality in Type 2 Diabetic Patients. Diabetes Care 2006;29(9):2046-2052. DOI: 10.2337/dc06-0248.
- Bruno G, Merletti F, Bargero G, et al. Estimated glomerular filtration rate, albuminuria and mortality in type 2 diabetes: the Casale Monferrato study. Diabetologia 2007;50(5):941-8. (In eng). DOI: 10.1007/s00125-007-0616-1.
- Adler AI, Stevens RJ, Manley SE, et al. Development and progression of nephropathy in type 2 diabetes: The United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney International 2003;63(1):225-232. DOI: https://doi.org/10.1046/j.1523-1755.2003.00712.x.
- Mogensen CE, Vestbo E, Poulsen PL, et al. Microalbuminuria and potential confounders. A review and some observations on variability of urinary albumin excretion. Diabetes Care 1995;18(4):572-81. (In eng). DOI: 10.2337/diacare.18.4.572.
- KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes and Chronic Kidney Disease. Am J Kidney Dis 2007;49(2 Suppl 2):S12-154. (In eng). DOI: 10.1053/j.ajkd.2006.12.005.
- Teng J, Dwyer KM, Hill P, et al. Spectrum of renal disease in diabetes. Nephrology (Carlton) 2014;19(9):528-36. (In eng). DOI: 10.1111/nep.12288.
- Caramori ML, Fioretto P, Mauer M. The need for early predictors of diabetic nephropathy risk: is albumin excretion rate sufficient? Diabetes 2000;49(9):1399-408. (In eng). DOI: 10.2337/diabetes.49.9.1399.
- Oshima M, Shimizu M, Yamanouchi M, et al. Trajectories of kidney function in diabetes: a clinicopathological update. Nat Rev Nephrol 2021;17(11):740-750. (In eng). DOI: 10.1038/s41581-021-00462-y.
- Perkins BA, Ficociello LH, Silva KH, Finkelstein DM, Warram JH, Krolewski AS. Regression of microalbuminuria in type 1 diabetes. N Engl J Med 2003;348(23):2285-93. (In eng). DOI: 10.1056/NEJMoa021835.
- KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2024;105(4s):S117-s314. (In eng). DOI: 10.1016/j.kint.2023.10.018.
- Matsushita K, van der Velde M, Astor BC, et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375(9731):2073-81. (In eng). DOI: 10.1016/s0140-6736(10)60674-5.
- Zafari N, Churilov L, Wong LY, et al. Evaluation of the diagnostic performance of the creatinine-based Chronic Kidney Disease Epidemiology Collaboration equation in people with diabetes: A systematic review. Diabet Med 2021;38(1):e14391. (In eng). DOI: 10.1111/dme.14391.
- Gross JL, de Azevedo MJ, Silveiro SP, Canani LH, Caramori ML, Zelmanovitz T. Diabetic nephropathy: diagnosis, prevention, and treatment. Diabetes Care 2005;28(1):164-76. (In eng). DOI: 10.2337/diacare.28.1.164.
- Miller WG, Bruns DE, Hortin GL, et al. Current issues in measurement and reporting of urinary albumin excretion. Clin Chem 2009;55(1):24-38. (In eng). DOI: 10.1373/clinchem.2008.106567.
- Silveiro SP, Araújo GN, Ferreira MN, Souza FD, Yamaguchi HM, Camargo EG. Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equation pronouncedly underestimates glomerular filtration rate in type 2 diabetes. Diabetes Care 2011;34(11):2353-5. (In eng). DOI: 10.2337/dc11-1282.
- Vassalotti JA, Stevens LA, Levey AS. Testing for Chronic Kidney Disease: A Position Statement From the National Kidney Foundation. American Journal of Kidney Diseases 2007;50(2):169-180. DOI: 10.1053/j.ajkd.2007.06.013.
- Association AD. 11. Microvascular Complications and Foot Care: Standards of Medical Care in Diabetes—2021. Diabetes Care 2020;44(Supplement_1):S151-S167. DOI: 10.2337/dc21-S011.
- Kramer CK, Camargo J, Ricardo ED, et al. Does bacteriuria interfere with albuminuria measurements of patients with diabetes? Nephrol Dial Transplant 2009;24(4):1193-6. (In eng). DOI: 10.1093/ndt/gfn629.
- Zelmanovitz T, Gross JL, Oliveira JR, Paggi A, Tatsch M, Azevedo MJ. The receiver operating characteristics curve in the evaluation of a random urine specimen as a screening test for diabetic nephropathy. Diabetes Care 1997;20(4):516-9. (In eng). DOI: 10.2337/diacare.20.4.516.
- Wu HY, Peng YS, Chiang CK, et al. Diagnostic performance of random urine samples using albumin concentration vs ratio of albumin to creatinine for microalbuminuria screening in patients with diabetes mellitus: a systematic review and meta-analysis. JAMA Intern Med 2014;174(7):1108-15. (In eng). DOI: 10.1001/jamainternmed.2014.1363.
- Gross JL, Zelmanovitz T, Oliveira J, de Azevedo MJ. Screening for diabetic nephropathy: is measurement of urinary albumin-to-creatinine ratio worthwhile? Diabetes Care 1999;22(9):1599-600. (In eng). DOI: 10.2337/diacare.22.9.1599.
- Incerti J, Zelmanovitz T, Camargo JL, Gross JL, de Azevedo MJ. Evaluation of tests for microalbuminuria screening in patients with diabetes. Nephrol Dial Transplant 2005;20(11):2402-7. (In eng). DOI: 10.1093/ndt/gfi074.
- Viana LV, Gross JL, Camargo JL, Zelmanovitz T, da Costa Rocha EP, Azevedo MJ. Prediction of cardiovascular events, diabetic nephropathy, and mortality by albumin concentration in a spot urine sample in patients with type 2 diabetes. J Diabetes Complications 2012;26(5):407-12. (In eng). DOI: 10.1016/j.jdiacomp.2012.04.014.
- Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998;352(9131):837-53. (In eng).
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial. Lancet 2010;376(9739):419-30. (In eng). DOI: 10.1016/s0140-6736(10)60576-4.
- Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358(24):2560-72. (In eng). DOI: 10.1056/NEJMoa0802987.
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360(2):129-39. (In eng). DOI: 10.1056/NEJMoa0808431.
- Nathan DM, Genuth S, Lachin J, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329(14):977-86. (In eng). DOI: 10.1056/nejm199309303291401.
- Nathan DM, Zinman B, Cleary PA, et al. Modern-day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005). Arch Intern Med 2009;169(14):1307-16. (In eng). DOI: 10.1001/archinternmed.2009.193.
- Zoungas S, Chalmers J, Neal B, et al. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N Engl J Med 2014;371(15):1392-406. (In eng). DOI: 10.1056/NEJMoa1407963.
- Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358(6):580-91. (In eng). DOI: 10.1056/NEJMoa0706245.
- Hemmingsen B, Lund SS, Gluud C, et al. Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. Bmj 2011;343:d6898. (In eng). DOI: 10.1136/bmj.d6898.
- Effect of intensive therapy on the development and progression of diabetic nephropathy in the Diabetes Control and Complications Trial. The Diabetes Control and Complications (DCCT) Research Group. Kidney Int 1995;47(6):1703-20. (In eng). DOI: 10.1038/ki.1995.236.
- Skupien J, Warram JH, Smiles A, Galecki A, Stanton RC, Krolewski AS. Improved glycemic control and risk of ESRD in patients with type 1 diabetes and proteinuria. J Am Soc Nephrol 2014;25(12):2916-25. (In eng). DOI: 10.1681/asn.2013091002.
- Shurraw S, Hemmelgarn B, Lin M, et al. Association between glycemic control and adverse outcomes in people with diabetes mellitus and chronic kidney disease: a population-based cohort study. Arch Intern Med 2011;171(21):1920-7. (In eng). DOI: 10.1001/archinternmed.2011.537.
- Ramirez SP, McCullough KP, Thumma JR, et al. Hemoglobin A(1c) levels and mortality in the diabetic hemodialysis population: findings from the Dialysis Outcomes and Practice Patterns Study (DOPPS). Diabetes Care 2012;35(12):2527-32. (In eng). DOI: 10.2337/dc12-0573.
- Hill CJ, Maxwell AP, Cardwell CR, et al. Glycated hemoglobin and risk of death in diabetic patients treated with hemodialysis: a meta-analysis. Am J Kidney Dis 2014;63(1):84-94. (In eng). DOI: 10.1053/j.ajkd.2013.06.020.
- KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int 2020;98(4s):S1-s115. (In eng). DOI: 10.1016/j.kint.2020.06.019.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375(4):323-34. (In eng). DOI: 10.1056/NEJMoa1515920.
- Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373(22):2117-28. (In eng). DOI: 10.1056/NEJMoa1504720.
- Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017;377(7):644-657. (In eng). DOI: 10.1056/NEJMoa1611925.
- Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019;380(4):347-357. (In eng). DOI: 10.1056/NEJMoa1812389.
- Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011;377(9784):2181-92. (In eng). DOI: 10.1016/s0140-6736(11)60739-3.
- Toyama T, Neuen BL, Jun M, et al. Effect of SGLT2 inhibitors on cardiovascular, renal and safety outcomes in patients with type 2 diabetes mellitus and chronic kidney disease: A systematic review and meta-analysis. Diabetes Obes Metab 2019;21(5):1237-1250. (In eng). DOI: 10.1111/dom.13648.
- Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019;380(24):2295-2306. (In eng). DOI: 10.1056/NEJMoa1811744.
- Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020;383(15):1436-1446. (In eng). DOI: 10.1056/NEJMoa2024816.
- Empagliflozin in Patients with Chronic Kidney Disease. New England Journal of Medicine 2023;388(2):117-127. DOI: doi:10.1056/NEJMoa2204233.
- Neuen BL, Arnott C, Perkovic V, et al. Sodium-glucose co-transporter-2 inhibitors with and without metformin: A meta-analysis of cardiovascular, kidney and mortality outcomes. Diabetes Obes Metab 2021;23(2):382-390. (In eng). DOI: 10.1111/dom.14226.
- Herrington WG, Staplin N, Wanner C, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2023;388(2):117-127. (In eng). DOI: 10.1056/NEJMoa2204233.
- Lin DS, Lee JK, Chen WJ. Clinical Adverse Events Associated with Sodium-Glucose Cotransporter 2 Inhibitors: A Meta-Analysis Involving 10 Randomized Clinical Trials and 71 553 Individuals. J Clin Endocrinol Metab 2021;106(7):2133-2145. (In eng). DOI: 10.1210/clinem/dgab274.
- Charytan DM, Solomon SD, Ivanovich P, et al. Metformin use and cardiovascular events in patients with type 2 diabetes and chronic kidney disease. Diabetes Obes Metab 2019;21(5):1199-1208. (In eng). DOI: 10.1111/dom.13642.
- Kwon S, Kim YC, Park JY, et al. The Long-term Effects of Metformin on Patients With Type 2 Diabetic Kidney Disease. Diabetes Care 2020;43(5):948-955. (In eng). DOI: 10.2337/dc19-0936.
- Orloff J, Min JY, Mushlin A, Flory J. Safety and effectiveness of metformin in patients with reduced renal function: A systematic review. Diabetes Obes Metab 2021;23(9):2035-2047. (In eng). DOI: 10.1111/dom.14440.
- Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016;375(4):311-22. (In eng). DOI: 10.1056/NEJMoa1603827.
- Mann JFE, Hansen T, Idorn T, et al. Effects of once-weekly subcutaneous semaglutide on kidney function and safety in patients with type 2 diabetes: a post-hoc analysis of the SUSTAIN 1-7 randomised controlled trials. Lancet Diabetes Endocrinol 2020;8(11):880-893. (In eng). DOI: 10.1016/s2213-8587(20)30313-2.
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016;375(19):1834-1844. (In eng). DOI: 10.1056/NEJMoa1607141.
- Kristensen SL, Rørth R, Jhund PS, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019;7(10):776-785. (In eng). DOI: 10.1016/s2213-8587(19)30249-9.
- Pasternak B, Wintzell V, Eliasson B, et al. Use of Glucagon-Like Peptide 1 Receptor Agonists and Risk of Serious Renal Events: Scandinavian Cohort Study. Diabetes Care 2020;43(6):1326-1335. (In eng). DOI: 10.2337/dc19-2088.
- Rossing P, Baeres FMM, Bakris G, et al. The rationale, design and baseline data of FLOW, a kidney outcomes trial with once-weekly semaglutide in people with type 2 diabetes and chronic kidney disease. Nephrol Dial Transplant 2023;38(9):2041-2051. (In eng). DOI: 10.1093/ndt/gfad009.
- Perkovic V, Tuttle KR, Rossing P, et al. Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes. New England Journal of Medicine;0(0). DOI: doi:10.1056/NEJMoa2403347.
- Galindo RJ, Beck RW, Scioscia MF, Umpierrez GE, Tuttle KR. Glycemic Monitoring and Management in Advanced Chronic Kidney Disease. Endocr Rev 2020;41(5):756-74. (In eng). DOI: 10.1210/endrev/bnaa017.
- Niafar M, Nakhjavani M, Esteghamati A, et al. Efficacy and Safety of Insulin Glargine in Type 2 Diabetic Patients with Renal Failure. J Diabetes Metab 2012;3:1-4. DOI: 10.4172/2155-6156.1000189.
- Betônico CC, Titan SMO, Lira A, et al. Insulin Glargine U100 Improved Glycemic Control and Reduced Nocturnal Hypoglycemia in Patients with Type 2 Diabetes Mellitus and Chronic Kidney Disease Stages 3 and 4. Clin Ther 2019;41(10):2008-2020.e3. (In eng). DOI: 10.1016/j.clinthera.2019.07.011.
- Garcia de Lucas MD, Olalla Sierra J, Aviles Bueno B. Degludec is effective and safe in real-life treatment for patients with type 2 diabetes mellitus and chronic kidney disease stage 3B. Int J Clin Pract 2018;72(6):e13098. (In eng). DOI: 10.1111/ijcp.13098.
- Marso SP, McGuire DK, Zinman B, et al. Efficacy and Safety of Degludec versus Glargine in Type 2 Diabetes. N Engl J Med 2017;377(8):723-732. (In eng). DOI: 10.1056/NEJMoa1615692.
- Haluzík M, Cheng A, Müller-Wieland D, et al. Differential glycaemic control with basal insulin glargine 300 U/mL versus degludec 100 U/mL according to kidney function in type 2 diabetes: A subanalysis from the BRIGHT trial. Diabetes Obes Metab 2020;22(8):1369-1377. (In eng). DOI: 10.1111/dom.14043.
- Arjona Ferreira JC, Corry D, Mogensen CE, et al. Efficacy and safety of sitagliptin in patients with type 2 diabetes and ESRD receiving dialysis: a 54-week randomized trial. Am J Kidney Dis 2013;61(4):579-87. (In eng). DOI: 10.1053/j.ajkd.2012.11.043.
- Udell JA, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes and moderate or severe renal impairment: observations from the SAVOR-TIMI 53 Trial. Diabetes Care 2015;38(4):696-705. (In eng). DOI: 10.2337/dc14-1850.
- Escott GM, da Silveira LG, Cancelier VDA, Dall’Agnol A, Silveiro SP. Monitoring and management of hyperglycemia in patients with advanced diabetic kidney disease. J Diabetes Complications 2021;35(2):107774. (In eng). DOI: 10.1016/j.jdiacomp.2020.107774.
- Kulozik F, Hasslacher C. Insulin requirements in patients with diabetes and declining kidney function: differences between insulin analogues and human insulin? Ther Adv Endocrinol Metab 2013;4(4):113-21. (In eng). DOI: 10.1177/2042018813501188.
- Parving HH, Hommel E, Mathiesen E, et al. Prevalence of microalbuminuria, arterial hypertension, retinopathy and neuropathy in patients with insulin dependent diabetes. Br Med J (Clin Res Ed) 1988;296(6616):156-60. (In eng). DOI: 10.1136/bmj.296.6616.156.
- Emdin CA, Rahimi K, Neal B, Callender T, Perkovic V, Patel A. Blood pressure lowering in type 2 diabetes: a systematic review and meta-analysis. Jama 2015;313(6):603-15. (In eng). DOI: 10.1001/jama.2014.18574.
- Bakris GL, Weir MR, Shanifar S, et al. Effects of blood pressure level on progression of diabetic nephropathy: results from the RENAAL study. Arch Intern Med 2003;163(13):1555-65. (In eng). DOI: 10.1001/archinte.163.13.1555.
- Berl T, Hunsicker LG, Lewis JB, et al. Impact of achieved blood pressure on cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial. J Am Soc Nephrol 2005;16(7):2170-9. (In eng). DOI: 10.1681/asn.2004090763.
- Xie X, Atkins E, Lv J, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet 2016;387(10017):435-43. (In eng). DOI: 10.1016/s0140-6736(15)00805-3.
- Cushman WC, Evans GW, Byington RP, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010;362(17):1575-85. (In eng). DOI: 10.1056/NEJMoa1001286.
- Association AD. 10. Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes—2021. Diabetes Care 2020;44(Supplement_1):S125-S150. DOI: 10.2337/dc21-S010.
- Pharmacological blood pressure lowering for primary and secondary prevention of cardiovascular disease across different levels of blood pressure: an individual participant-level data meta-analysis. Lancet 2021;397(10285):1625-1636. (In eng). DOI: 10.1016/s0140-6736(21)00590-0.
- Zhang W, Zhang S, Deng Y, et al. Trial of Intensive Blood-Pressure Control in Older Patients with Hypertension. N Engl J Med 2021;385(14):1268-1279. (In eng). DOI: 10.1056/NEJMoa2111437.
- Should All Patients with Type 1 Diabetes Mellitus and Microalbuminuria Receive Angiotensin-Converting Enzyme Inhibitors? Annals of Internal Medicine 2001;134(5):370-379. DOI: 10.7326/0003-4819-134-5-200103060-00009.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001;345(12):851-60. (In eng). DOI: 10.1056/NEJMoa011303.
- Sarafidis PA, Stafylas PC, Kanaki AI, Lasaridis AN. Effects of renin-angiotensin system blockers on renal outcomes and all-cause mortality in patients with diabetic nephropathy: an updated meta-analysis. Am J Hypertens 2008;21(8):922-9. (In eng). DOI: 10.1038/ajh.2008.206.
- Hirst JA, Taylor KS, Stevens RJ, et al. The impact of renin-angiotensin-aldosterone system inhibitors on Type 1 and Type 2 diabetic patients with and without early diabetic nephropathy. Kidney Int 2012;81(7):674-83. (In eng). DOI: 10.1038/ki.2011.413.
- Rippin J, Bain SC, Barnett AH. Rationale and design of diabetics exposed to telmisartan and enalapril (DETAIL) study. J Diabetes Complications 2002;16(3):195-200. (In eng). DOI: 10.1016/s1056-8727(01)00165-9.
- Cai J, Huang X, Zheng Z, Lin Q, Peng M, Shen D. Comparative efficacy of individual renin-angiotensin system inhibitors on major renal outcomes in diabetic kidney disease: a network meta-analysis. Nephrol Dial Transplant 2018;33(11):1968-1976. (In eng). DOI: 10.1093/ndt/gfy001.
- Haller H, Ito S, Izzo JL, Jr., et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364(10):907-17. (In eng). DOI: 10.1056/NEJMoa1007994.
- Fried LF, Emanuele N, Zhang JH, et al. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med 2013;369(20):1892-903. (In eng). DOI: 10.1056/NEJMoa1303154.
- Mehdi UF, Adams-Huet B, Raskin P, Vega GL, Toto RD. Addition of angiotensin receptor blockade or mineralocorticoid antagonism to maximal angiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol 2009;20(12):2641-50. (In eng). DOI: 10.1681/asn.2009070737.
- Alexandrou ME, Papagianni A, Tsapas A, et al. Effects of mineralocorticoid receptor antagonists in proteinuric kidney disease: a systematic review and meta-analysis of randomized controlled trials. J Hypertens 2019;37(12):2307-2324. (In eng). DOI: 10.1097/hjh.0000000000002187.
- Bakris GL, Agarwal R, Anker SD, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med 2020;383(23):2219-2229. (In eng). DOI: 10.1056/NEJMoa2025845.
- Pitt B, Filippatos G, Agarwal R, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med 2021;385(24):2252-2263. (In eng). DOI: 10.1056/NEJMoa2110956.
- Filippatos G, Pitt B, Agarwal R, et al. Finerenone in patients with chronic kidney disease and type 2 diabetes with and without heart failure: a prespecified subgroup analysis of the FIDELIO-DKD trial. Eur J Heart Fail 2022;24(6):996-1005. (In eng). DOI: 10.1002/ejhf.2469.
- Sarafidis P, Agarwal R, Pitt B, et al. Outcomes with Finerenone in Participants with Stage 4 CKD and Type 2 Diabetes: A FIDELITY Subgroup Analysis. Clin J Am Soc Nephrol 2023;18(5):602-12. (In eng). DOI: 10.2215/cjn.0000000000000149.
- Agarwal R, Filippatos G, Pitt B, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J 2022;43(6):474-484. (In eng). DOI: 10.1093/eurheartj/ehab777.
- Colhoun HM, Betteridge DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004;364(9435):685-96. (In eng). DOI: 10.1016/s0140-6736(04)16895-5.
- LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352(14):1425-35. (In eng). DOI: 10.1056/NEJMoa050461.
- Slinin Y, Ishani A, Rector T, et al. Management of hyperglycemia, dyslipidemia, and albuminuria in patients with diabetes and CKD: a systematic review for a KDOQI clinical practice guideline. Am J Kidney Dis 2012;60(5):747-69. (In eng). DOI: 10.1053/j.ajkd.2012.07.017.
- Colhoun H, Dj B, Pn D, et al. Effects of atorvastatin on kidney outcomes and cardiovascular disease in patients with diabetes: an analysis from the Collaborative Atorvastatin Diabetes Study (CARDS). American Journal of Kidney Diseases 2009;54:810-819.
- Su X, Zhang L, Lv J, et al. Effect of Statins on Kidney Disease Outcomes: A Systematic Review and Meta-analysis. Am J Kidney Dis 2016;67(6):881-92. (In eng). DOI: 10.1053/j.ajkd.2016.01.016.
- Molitch ME, Adler AI, Flyvbjerg A, et al. Diabetic kidney disease: a clinical update from Kidney Disease: Improving Global Outcomes. Kidney Int 2015;87(1):20-30. (In eng). DOI: 10.1038/ki.2014.128.
- Sharp Collaborative G. Study of Heart and Renal Protection (SHARP): randomized trial to assess the effects of lowering low-density lipoprotein cholesterol among 9,438 patients with chronic kidney disease. Am Heart J 2010;160(5):785-794.e10. (In eng). DOI: 10.1016/j.ahj.2010.08.012.
- Bertoluci MC, Pimazoni-Netto A, Pires AC, et al. Diabetes and cardiovascular disease: from evidence to clinical practice – position statement 2014 of Brazilian Diabetes Society. Diabetol Metab Syndr 2014;6:58. (In eng). DOI: 10.1186/1758-5996-6-58.
- Holdaas H, Fellström B, Cole E, et al. Long-term cardiac outcomes in renal transplant recipients receiving fluvastatin: the ALERT extension study. Am J Transplant 2005;5(12):2929-36. (In eng). DOI: 10.1111/j.1600-6143.2005.01105.x.
- Newman CB, Blaha MJ, Boord JB, et al. Lipid Management in Patients with Endocrine Disorders: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2020;105(12) (In eng). DOI: 10.1210/clinem/dgaa674.
- Ansquer JC, Foucher C, Rattier S, Taskinen MR, Steiner G. Fenofibrate reduces progression to microalbuminuria over 3 years in a placebo-controlled study in type 2 diabetes: results from the Diabetes Atherosclerosis Intervention Study (DAIS). Am J Kidney Dis 2005;45(3):485-93. (In eng). DOI: 10.1053/j.ajkd.2004.11.004.
- Davis TM, Ting R, Best JD, et al. Effects of fenofibrate on renal function in patients with type 2 diabetes mellitus: the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) Study. Diabetologia 2011;54(2):280-90. (In eng). DOI: 10.1007/s00125-010-1951-1.
- Ferro CJ, Mark PB, Kanbay M, et al. Lipid management in patients with chronic kidney disease. Nat Rev Nephrol 2018;14(12):727-749. (In eng). DOI: 10.1038/s41581-018-0072-9.
- Wanner C, Krane V, März W, et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005;353(3):238-48. (In eng). DOI: 10.1056/NEJMoa043545.
- Athyros VG, Tziomalos K, Karagiannis A, Mikhailidis DP. Statins and cardiovascular events in patients with end-stage renal disease on hemodialysis. The AURORA results suggest the need for earlier intervention. Curr Vasc Pharmacol 2009;7(3):264-6. (In eng). DOI: 10.2174/157016109788340712.
- Fellström BC, Jardine AG, Schmieder RE, et al. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med 2009;360(14):1395-407. (In eng). DOI: 10.1056/NEJMoa0810177.
- Tonelli M, Isles C, Curhan GC, et al. Effect of pravastatin on cardiovascular events in people with chronic kidney disease. Circulation 2004;110(12):1557-63. (In eng). DOI: 10.1161/01.Cir.0000143892.84582.60.
- Holdaas H, Holme I, Schmieder RE, et al. Rosuvastatin in diabetic hemodialysis patients. J Am Soc Nephrol 2011;22(7):1335-41. (In eng). DOI: 10.1681/asn.2010090987.
- Shepherd J, Kastelein JJ, Bittner V, et al. Effect of intensive lipid lowering with atorvastatin on renal function in patients with coronary heart disease: the Treating to New Targets (TNT) study. Clin J Am Soc Nephrol 2007;2(6):1131-9. (In eng). DOI: 10.2215/cjn.04371206.
- Evert AB, Boucher JL, Cypress M, et al. Nutrition therapy recommendations for the management of adults with diabetes. Diabetes Care 2014;37 Suppl 1:S120-43. (In eng). DOI: 10.2337/dc14-S120.
- Wheeler ML, Dunbar SA, Jaacks LM, et al. Macronutrients, food groups, and eating patterns in the management of diabetes: a systematic review of the literature, 2010. Diabetes Care 2012;35(2):434-45. (In eng). DOI: 10.2337/dc11-2216.
- Li Q, Wen F, Wang Y, et al. Diabetic Kidney Disease Benefits from Intensive Low-Protein Diet: Updated Systematic Review and Meta-analysis. Diabetes Ther 2021;12(1):21-36. (In eng). DOI: 10.1007/s13300-020-00952-5.
- Ikizler TA, Burrowes JD, Byham-Gray LD, et al. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Am J Kidney Dis 2020;76(3 Suppl 1):S1-s107. (In eng). DOI: 10.1053/j.ajkd.2020.05.006.
- Li XF, Xu J, Liu LJ, et al. Efficacy of low-protein diet in diabetic nephropathy: a meta-analysis of randomized controlled trials. Lipids Health Dis 2019;18(1):82. (In eng). DOI: 10.1186/s12944-019-1007-6.
- Nezu U, Kamiyama H, Kondo Y, Sakuma M, Morimoto T, Ueda S. Effect of low-protein diet on kidney function in diabetic nephropathy: meta-analysis of randomised controlled trials. BMJ Open 2013;3(5) (In eng). DOI: 10.1136/bmjopen-2013-002934.
- Hansen HP, Tauber-Lassen E, Jensen BR, Parving HH. Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy. Kidney Int 2002;62(1):220-8. (In eng). DOI: 10.1046/j.1523-1755.2002.00421.x.
- Frisoli TM, Schmieder RE, Grodzicki T, Messerli FH. Salt and hypertension: is salt dietary reduction worth the effort? Am J Med 2012;125(5):433-9. (In eng). DOI: 10.1016/j.amjmed.2011.10.023.
- Lambers Heerspink HJ, Holtkamp FA, Parving HH, et al. Moderation of dietary sodium potentiates the renal and cardiovascular protective effects of angiotensin receptor blockers. Kidney Int 2012;82(3):330-7. (In eng). DOI: 10.1038/ki.2012.74.
- Paula TP, Viana LV, Neto AT, Leitão CB, Gross JL, Azevedo MJ. Effects of the DASH Diet and Walking on Blood Pressure in Patients With Type 2 Diabetes and Uncontrolled Hypertension: A Randomized Controlled Trial. J Clin Hypertens (Greenwich) 2015;17(11):895-901. (In eng). DOI: 10.1111/jch.12597.
Cite este artigo

