Autores: José Francisco Kerr Saraiva, Marcello Bertoluci.
Última revisão em: 28/05/2024
DOI: 10.29327/5412848.2024-9 | Cite este Artigo
INTRODUÇÃO
A insuficiência cardíaca (IC) é uma síndrome clínica com sinais e sintomas causados por anomalias cardíacas estruturais ou funcionais, associada à congestão pulmonar e à edema periférico, corroborado por elevação de peptídeos natriuréticos e alterações em exames de imagem ou em medidas hemodinâmicas invasivas.1,2
A IC é um grave problema de saúde pública. A estimativa mundial é de que haja 64 milhões de pessoas com IC. No Brasil, estima-se que mais de 4 milhões de indivíduos tenham IC.3 Entre as doenças não transmissíveis, a IC é a que tem as maiores taxas de mortalidade.3 Em um estudo observacional com 3.957.520 usuários do Medicare americano, hospitalizados por IC entre 1992 e 1999, a mortalidade anual variou entre 32.5% e 31.7%.4
A mortalidade tem caído ao longo do tempo. Uma análise da Mayo Clinic comparando os períodos de 1979-1984 e 1996-2000, a qual incluiu pacientes hospitalizados por IC, mostrou queda da incidência anual de 30% para 21% nos homens e de 20% para 17% nas mulheres.5
FATORES DE RISCO PARA IC
O diabetes (DM) é um dos principais fatores de risco independentes para IC. Pacientes com DM2 tem aproximadamente 2x mais risco de desenvolver IC quando comparados a indivíduos sem DM2.6 Além disso, 30-40% das pessoas com IC tem DM2 ou pré-Diabetes, uma taxa que aumenta em 50% nos pacientes hospitalizados por IC.7
O controle glicêmico ruim foi associado a risco maior para desenvolver IC. Em um estudo de coorte (n=48.858) com um acompanhamento de 2,2 anos, observou-se que, para cada 1% de aumento da HbA1c houve um aumento de 8% no risco de IC.8
Há também maior risco de IC em mulheres comparado aos homens. No Framingham Heart Study (n=5209, idade 45-74 anos) o risco relativo ajustado para desenvolver IC em pacientes com DM foi de 1,82 para homens e 3,75 para mulheres.9
Dados observacionais identificaram outros fatores de risco independentes para IC como a doença arterial obstrutiva periférica (DAOP), o maior tempo de duração do diabetes, o envelhecimento, o aumento do IMC e a doença renal crônica como importantes fatores adicionais fortemente associado à IC em indivíduos com DM.9–12
Os principais fatores de risco para desenvolver IC em pessoas com DM2 estão descritos no Quadro 1.
| Quadro 1. Fatores Risco para IC em adultos com DM2¹¹² |
|
Fatores clínicos: Idade Duração do DM2 Obesidade Uso de insulina Controle glicêmico inadequado Hipertensão Arterial Doença Arterial Coronariana Isquêmica (DAC) Doença Arterial Obstrutiva Periférica (DAOP) História prévia de IAM Revascularização miocárdica |
|
Achados laboratoriais ou imagem de risco para IC: Microalbuminúria Redução da função renal NT-proBNP ≥125 pg/mL Proteína C reativa de alta sensibilidade ≥3 mg/L Hipertrofia do Ventrículo Esquerdo |
PREVALÊNCIA DE IC EM PACIENTES DM2 ASSINTOMÁTICOS
É importante salientar que a IC não reconhecida é frequente no DM2. A prevalência de disfunção diastólica em pessoas assintomáticas com DM2 e comorbidades pre-existentes varia de 48% a 81% entre vários estudos.13,14,15 Em um estudo conduzido na Australia, Wang et al. relataram uma prevalência de 58% de pacientes assintomáticos no estágio B da IC em pacientes assintomáticos com DM2 e IC de fração preservada.16 Em um estudo italiano, os investigadores reportaram que 68% dos DM2 assintomáticos tinham alterações funcionais do VE detectáveis.17 Em outro estudo australiano 62% de pessoas caucasianas com DM2 que tinham pelo menos 1 fator de risco cardiovascular foram detectadas como estando no estágio B da IC. Ao nível da comunidade, entretanto, a prevalência de IC no estágio B é aproximadamente 35%.18
CLASSIFICAÇÃO DA IC
CLASSIFICAÇÃO FUNCIONAL
Tabela 1 – Classificação funcional NYHA (New York Heart Association)19
| Tabela 1. Classificação Funcional da IC | |
| (NYHA) | Classificação |
| I | Com doença cardíaca mas sem limitação funcional pela atividade física. Atividade física usual não causa fadiga, palpitações, dispneia ou angina. |
| II | Leve limitação funcional à atividade física. Atividade física usual causa fadiga, palpitações, dispneia ou angina. |
| III | Marcada limitação funcional pela atividade física. Confortável em repouso, porém atividade física menos intensa que a usual causa fadiga, palpitações, dispneia ou angina. |
| IV | Incapacidade de fazer qualquer atividade física sem desconforto. Sintomas de IC ou de angina podem estar presentes mesmo em repouso. Qualquer atividade física aumenta o desconforto. |
Tabela 2 – Classificação por estágios segundo a ACC/AHA20
| Tabela 2. Estágios da IC segundo ACC/AHA²⁰ | ||
| Estágio | Descrição | Abordagem |
| A |
Apenas risco para desenvolver IC. Não há doença estrutural ou sintomas de IC. |
Controlar fatores de risco para IC: tabagismo, dislipidemia, hipertensão arterial, etilismo, diabetes e obesidade. |
| B |
Presença de doença estrutural cardíaca. Sem sintomas de IC. |
Considerar IECA, beta bloqueador, e antagonistas mineralocorticóides. |
| C |
Doença estrutural cardíaca presente. Sintomas prévios e atuais de IC. |
Tratamento clínico otimizado, Medidas adicionais. Considerar TRC, CDI e tratamento cirúrgico. Manejo com equipe multidisciplinar. |
| D | IC refratária ao tratamento clínico. |
Requer intervenção especializada. Todas as medidas acima. Considerar transplante cardíaco e dispositivos de assistência ventricular. |
| CDI: Cardiodesfibrilador; TRC: Terapia de ressincronização cardíaca; | ||
Tabela 3 – Classificação da insuficiência cardíaca de acordo com a fração de ejeção do ventrículo esquerdo (FEVE)21
| Tabela 3. Classificação de IC de acordo com a fração de ejeção | |||
|
ICFEr (FEVE reduzida) |
ICFE lr (FEVE levemente reduzida) |
ICFEp (FEVE preservada) |
|
| Função ventricular | FEVE<40% | FEVE 40-49% | FEVE >=50% |
| Biomarcadores |
BNP ou NTproBNP elevados |
BNP ou NTproBNP elevados |
BNP ou NTproBNP elevados |
| Ecocardiograma |
Alteração estrutural e/ou disfunção sistólica |
Alteração estrutural e/ou disfunção diastólica |
Alteração estrutural e/ou disfunção diastólica |
SINAIS E SINTOMAS
A insuficiência cardíaca pode se manifestar com fração de ejeção preservada (ICFEp), levemente reduzida (ICFElr) ou reduzida ICFEr.21
Os sintomas mais comuns são dispneia, edema nos tornozelos e fadiga. Os sinais podem não estar presentes na fase inicial ou em pacientes que recebem diuréticos. Na prática clínica, os sinais e sintomas de IC coexistem nas várias formas de IC, independentemente da fração de ejeção. Entretanto a soma de sinais na IC guarda relação direta com morbi-mortalidade.22
Sinais e sintomas da IC inicial podem não ser claros. Na IC avançada são variáveis e incluem os abaixo na tabela 4:
Tabela 4 – Sinais e sintomas da Insuficiência Cardíaca
| Tabela 4. Sinais e sintomas de IC | |
| Sintomas Típicos | Sinais mais específicos |
|
Dispnéia Ortopnéia Dispnéia paroxística noturna Fadiga e cansaço Intolerância ao exercício Bendopneia |
Pressão venosa jugular elevada Refluxo hepatojugular Terceira bulha cardíaca Impulso apical desviado para a esquerda |
| Sintomas menos típicos | Sinais menos específicos |
|
Tosse noturna Ganho de peso Dor Abdominal Perda de apetite Perda de peso Noctúria ou oligúria |
Crepitações pulmonares Taquicardia Hepatomegalia e ascite Extremidades frias Edema periférico |
DIAGNÓSTICO
O diagnóstico de IC é dado pela presença de achados clinicos considerados critérios maiores e menores, de acordo com Framingham (tabela 5). O diagnóstico de IC é feito na presença de 2 critérios maiores ou 1 maior e 2 menores.
| Tabela 5. Critérios diagnósticos de Framingham para IC²³ | |
| Critérios Maiores | Critérios Menores |
|
Edema pulmonar agudo Cardiomegalia Refluxo Hepato-jugular Distensão de veias do pescoço Dispneia Paroxística noturna Ortopnéia Estertores crepitantes nas bases pulmonares Ritmo de Galope S3 - Terceira bulha |
Edema do tornozelo Dispneia de esforço Hepatomegalia Tosse noturna Derrame pleural Taquicardia > 120bpm |
| O diagnóstico de IC é feito na presença de 2 critérios maiores ou 1 maior e 2 menores. | |
Se apenas um dos sintomas e sinais estiverem presentes, pode-se suspeitar de IC e são recomendados os testes diagnósticos para confirmação diagnóstica apresentados na Tabela 6, Quadros 2 e 3)
| Tabela 6. Peptídeo Natriurético Atrial: Níveis normais²⁴ | |
| BNP (peptídeo natriurético atrial) | <35-50 pg/ml |
| NT pro BNP (peptídeo natriurético atrial tipo B) | <125 pg/ml |
| Quadro 2. Ecocardiografia²⁵ |
|
| Quadro 3. Exames necessários para determinar etiologia da IC |
|
TRATAMENTO DA HIPERGLICEMIA NO PACIENTE COM DM2 E IC
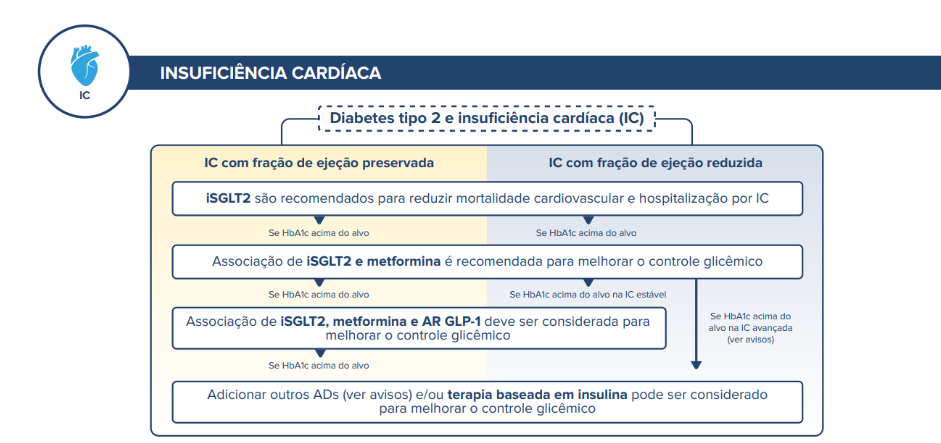
O tratamento da ICFEr abrange modificações terapêuticas no estilo de vida, bem como terapias farmacológicas com benefícios confirmados em estudos clínicos randomizados. A maioria dos estudos mostrou incidência de DM2 entre 30 e 40%. O foco da presente diretriz será no manejo específico da hiperglicemia no paciente com DM2 e IC, e tem por base a diretriz Luso-Brasileira UPDATE 2023 endossado pela SBD. Não é objetivo deste capítulo abordar o manejo completo da IC. 28
Figura 1. Fluxograma proposto pela SBD para manejo da hiperglicemia no paciente com DM2 e IC28
RECOMENDAÇÕES
AVALIAÇÃO DIAGNÓSTICA
R1 – É RECOMENDADO que, em todos os indivíduos adultos com DM2, seja realizado uma história médica detalhada e um exame clínico buscando fatores de risco, sinais e sintomas sugestivos de IC.
| Classe I | Nível C |
R2 – É RECOMENDADO que, na presença de sinais e sintomas de IC, uma avaliação laboratorial incluindo NT-ProBNP (ou BNP), ECG, Raio X de Tórax e Ecocardiograma Transtorácico sejam realizados, quando disponíveis, para confirmação diagnóstica.
| Classe I | Nível C |
Sumários de evidências R1 e R2:
- A IC é uma síndrome clínica, e portanto detectável ao exame clínico. Dada a alta prevalência de IC em pacientes com DM2, este painel recomenda por opinião de experts que todos indivíduos adultos com DM2 sejam examinados e avaliados para sinais e sintomas de IC.
R3 – DEVE SER CONSIDERADO o rastreamento com NT-ProBNP (ou BNP), quando disponíveis, para disfunção ventricular em pacientes com DM2 assintomáticos, que sejam de alto risco para IC.
| Classe IIa | Nível C |
Sumário de evidências:
- Pacientes DM2 com alto risco cardiovascular têm maior propensão para desenvolver disfunção VE sem sinais e sintomas.
- Pacientes com pré-IC (estágio B) tem taxas de mortalidade consideráveis. Em revisão sistemática, a mortalidade por todas as causas de pacientes com pré-IC (estágio B) nos EUA foi estimada em 0.8 por 100 pessoas-ano.29 Em outra revisão sistemática, 1.6% dos pacientes com pre-IC (n = 2380) no Japão morreram em uma mediana de 12.7 meses.30 Na Italia, foi relatado que 0.6% dos pacientes em risco de IC(n = 337) tiveram morte cardiovascular e 0.9% morte não-cardiaca em uma mediana mediana de 22 meses.31
- A identificação e início precoce de tratamento da IC pode melhorar o prognóstico. Nos estudos EMPAREG, CANVAS E DECLARE houve redução de internação por IC em pacientes de alto risco CV sem diagnóstico prévio de IC. 32,33,34
META DE CONTROLE GLICÊMICO PARA PACIENTES COM DM2 E IC
R4 – Em pacientes DM2 com ICFEP ou ICFEr DEVE SER CONSIDERADO buscar o controle glicêmico otimizado, procurando atingir e manter de forma estável a meta de HbA1c 6,5-7,5%, devendo ser evitadas reduções abruptas.
| Classe IIa | Nível B |
Sumário de evidências:
- Não foram encontrados estudos em pacientes com DM comparando o tratamento da hiperglicemia para metas de HbA1c com desfechos relacionados à IC.
- Estudo observacional entretanto mostrou relação direta entre niveis de HbA1c e desfechos relacionados à IC em pessoas com DM2. No estudo de Rawshani, uma coorte com 271,174 pacientes com DM2 registrados no Swedish National Diabetes Register e 1,355,870 controles sem diabetes pareados por idade, sexo e região, foram acessados pacientes com diabetes de acordo com a idade categoria de acordo com a presença de 5 fatores de risco, incluindo HbA1C e outros fatores de risco. O desfecho estudado foi morte, infarto agudo do miocardio, AVC e hospitalização por IC. Ao longo de 5,7 anos houve 175.345 mortes. A HbA1c fora da meta foi o principal fator preditivo para IAM e AVC. O risco de hospitalização por IC foi menor quando o nível de HbA1c era menor do que 7%.35
- Niveis elevados de HbA1c estão claramente associados a piores desfechos relacionados à IC. Um estudo de coorte com 25.858 homens e 22.900 mulheres com DM2, sem história de IC avaliou a associação HbA1c e risco de hospitalização ou morte por IC. Houve 955 eventos em 2,2 anos. Após ajustes para diversos fatores de risco, observou-se uma relação linear direta onde, para cada aumento de 1% na HbA1c houve um aumento associado de 8% no risco de desfechos relacionados à IC. Comparativamente a uma HbA1c<7%, uma HbA1c acima do que 10% foi associada a um risco 1,56x maior para IC.36
- Uma coorte prospectiva do Sing Health Diabetes Registry (SDR) com 17,389 pacientes diagnosticados com DM2 de 2013 a 2016 com registros de estendendo até 2019 procurou observar a trajetória da HbA1c e sua relação com hospitalização por IC (HIC). Associação entre trajetórias de HbA1c e risco para primeira HIC foi quantificada pelo modelo de Cox. Ao todo, 5 trajetórias distintas de HbA1c foram identificadas: 1. Baixa e estável (36.1%), 2. Elevada e estável (40.4%), 3. Elevada, caindo gradualmente (3.5%), 4. Elevada caindo rapidamente (10.8%), e 5. moderada, caindo gradualmente (9.2%) ao longo de 7 anos do estudo. Trajetórias de HbA1c mal controladas (Classes 3, 4, and 5) foram associadas a maior risco de HIC. Pacientes que tiveram trajetorias estaveis entre 6,5-7,5% de HbA1c de forma estavel tiveram menor numero de internações por IC.37
TRATAMENTO FARMACOLÓGICO: PRIMEIRA ESCOLHA
R5 – Em pacientes DM2 e IC, com qualquer fração de ejeção, É RECOMENDADO o uso de inibidores do SGLT2 como anti-diabéticos de primeira escolha para controle glicêmico, redução de hospitalização por IC e de morte cardiovascular, independentemente do nível de HbA1c.
| Classe I | Nível A |
Sumário de evidências:
- Dois ensaios randomizados controlados por placebo investigaram o efeito de um inibidor de SGLT2 em comparação com placebo adicionado à terapia médica ideal (OMT) em pacientes com ICFEr com e sem diabetes. O estudo DAPA-HF (Dapagliflozina e Prevenção de Resultados Adversos em Insuficiência Cardíaca) incluiu pacientes com IC em classe da New York Heart Association (NYHA) II-IV com FEVE ≤40% apesar da NT-proBNP em ritmo sinusal ≥600 pg/mL, em Fibrilação Atrial ≥900 mg/mL ou ≥400 pg/mL se tiverem sido hospitalizados por IC nos últimos 12 meses). Pacientes com DM1 ou TFGe <30 mL/min/1,73 m2 foram excluídos. A terapia com dapagliflozina 10 mg /dia vs placebo reduziu o risco do desfecho primário, um composto de piora da IC (hospitalização ou visita hospitalar de urgência resultando em terapia intravenosa para IC) ou morte CV, em 26% (HR 0,74; IC 95%, 0,65–0,85). Além disso, a dapagliflozina reduziu a mortalidade por todas as causas (HR 0,83; IC 95%, 0,71–0,97) , melhorou os sintomas, a capacidade física e a qualidade de vida em pacientes com ICFEr. Todos os benefícios clínicos observados foram independentes do estado basal de diabetes e terapia de redução da glicemia de base, e consistente em todo o espectro de HbA1c.38
- O estudo EMPEROR-Reduced (Empagliflozin Outcome Trial in Pacientes com Insuficiência Cardíaca Crônica com Fração de Ejeção Reduzida) avaliou empagliflozina versus placebo com ICFEr com e sem diabetes e incluiu pacientes com ICFEr em classe II-IV da NYHA e FEVE ≤40% apesar com TFGe ≥20 mL/min/1,73 m2 e NT-proBNP elevado (FE ≤30% ou FE ≤40% e hospitalização por IC em 12 meses: NT-proBNP ≥600 pg/mL; FE 31–35%: NT-proBNP ≥1000 pg/mL; FE 36–40%: NT-proBNP ≥2500 pg/mL). A Empagliflozina 10 mg o.d. reduziu o risco do desfecho primário, um composto de morte CV ou hospitalização por IC, em 25% vs. placebo (HR 0,75; IC 95%, 0,65–0,86). Este efeito foi consistente entre pacientes com e sem diabetes em linha de base.39
- O tratamento com empagliflozina melhorou a qualidade de vida35. Uma meta-análise dos ensaios DAPA-HF e EMPEROR-Reduced mostrou uma redução consistente na hospitalização por IC ou morte CV, morte CV e mortalidade por todas as causas por Tratamento com inibidor de SGLT2 sem heterogeneidade significativa entre os ensaios.42
- O inibidor combinado de SGLT1 e SGLT2 sotagliflozina foi investigado em pacientes com DM2 que foram recentemente hospitalizados por piora da IC, independentemente de sua FEVE (ensaio SOLOIST-WHF [Effect of Sotagliflozin on Cardiovascular Events in Patient with Type 2 Diabetes Post Worsening Heart Failure]). Foram excluídos pacientes com TFGe <30 mL/min/1,73 m2. A sotagliflozina reduziu significativamente o RR do desfecho primário composto (morte CV, hospitalização por IC ou consulta urgente por IC) em 33% em comparação com o placebo (HR 0,67; IC 95%, 0,52–0,85). O efeito do tratamento foi consistente em todo o espectro da FEVE.41
- O estudo EMPULSE (Um Estudo para Testar o Efeito da Empagliflozina em Pacientes que Estão Hospitalizados por Insuficiência Cardíaca Aguda) randomizou 530 pacientes hospitalizados com e sem diabetes com diagnóstico primário de IC aguda de novo ou descompensada, independentemente da FEVE quando clinicamente estável, para receber empagliflozina ou placebo. Um numero maior pacientes tratados com empagliflozina tiveram benefício clínico (taxa de vitória 1,36; IC 95%, 1,09–1,68) em comparação com placebo. Este efeito foi consistente para IC aguda de novo e crónica descompensada e foi observado independentemente da FEVE ou da presença de diabetes.4 Nestes ensaios, foram notificados muito poucos casos de cetoacidose diabética euglicémica; ainda assim, os médicos que tratam pacientes com diabetes com inibidores do SGLT2 neste cenário devem estar cientes desta complicação rara, mas potencialmente grave. É digno de nota que a interpretação incorreta das alterações da TFGe pode levar à descontinuação inadequada de agentes modificadores da doença e deve ser evitada.42
Pacientes com IC de fração de ejeção preservada ou levemente reduzida
- O estudo EMPEROR-Preserved (Empagliflozin Outcome Trial in Pacients with Heart Failure with preserved Ejection Fraction) incluiu pacientes com classe II-IV da NYHA, FEVE >40% e NT-proBNP elevado (>300 pg/mL em ritmo sinusal; >900 pg/mL na FA). Pacientes com TFGe <20 mL/min/1,73 m2 foram excluídos. Em comparação com o placebo, a empagliflozina reduziu o risco do desfecho primário, um composto de morte CV ou hospitalização por IC, em 21%, o que foi principalmente relacionado a um risco 29% menor de hospitalização por IC. Este efeito foi independente da presença de diabetes.43
- O estudo DELIVER (Avaliação de Dapagliflozina na redução de desfechos em pacientes com insuficiência cardíaca com fração de ejeção preservada) incluiu 6.263 pacientes com classe II-IV da NYHA, uma FEVE >40%, NT-proBNP elevado (>300 pg/mL em ritmo sinusal; >600 pg/mL em FA) e TFGe ≥25 mL/min/1,73 m2. A dapagliflozina reduziu o desfecho primário, um composto de agravamento da IC ou morte CV, em 18%, o que foi impulsionado principalmente por uma redução na hospitalização por IC. Este efeito foi independente da presença de diabetes.44
- Uma meta-análise incluindo 12.251 participantes do DELIVER e do EMPEROR-Preserved mostrou que os inibidores do SGLT2, em comparação com o placebo, reduziram um composto de morte CV e primeira hospitalização por IC (HR 0,80; IC 95%, 0,73–0,87), com reduções consistentes em ambos os componentes: morte CV (HR 0,88; IC 95%, 0,77–1,00) e primeira hospitalização por IC (HR 0,74; IC 95%, 0,67–0,83).45
METFORMINA
R6 – Em pacientes com DM2 e IC crônica, o uso de metformina ESTÁ RECOMENDADO em associação com os inibidores do ISGLT2, para controle da glicemia, redução de mortalidade e risco de admissão por IC, desde que a TFG esteja acima de 30ml/min/1,73m2.
| Classe I | Nível B |
Sumário de evidências:
- Embora não tenham sido realizados estudos randomizados e controlados de segurança cardiovascular, com metformina, estudos observacionais tem mostrado associação com menor número de eventos cardiovasculares. menor risco de morte e de hospitalização por IC em comparação a pacientes usando insulina e sulfonilureias.
Redução de mortalidade:
- Em uma coorte retrospectiva com 16.417 pacientes idosos com diabetes com alta após hospitalização por IC, o tratamento com metformina foi associado a uma redução significativa de 18% no risco de morte por todas as causas. (HR=0.87, 95% CI 0.78 to 0.97).46
- Em estudo retrospectivo utilizando a base de dados do The Saskatchewan Health diseases, 12.272 novos usuários de antidiabéticos orais foram identificadis entre 1991 e 1996. Pacientes com IC incidente (n=1.833) foram identificados e agrupados de acordo com o tipo de terapia: metformina monoterapia (n=208) sulfonilureia monoterapia (n=773) ou combinação (n=852). Após o seguimento d 2,5 anos, análise multivariada de Cox mostrou uma menor mortalidade em pacientes usando metformina em relação aos usando sulfoniluréias: HR 0.70 (0,54-0,91).47,48,49,50
- Metanálises de estudos observacionais e de ensaios clinicos randomizados confirmam a redução da mortalidade cardiovascular com metformina em monoterapia em comparação com as sulfonilureias e da redução da mortalidade por todas as causas em pacientes com DM2 tratados com metformina.51,52,53
- Em metanálise incluindo 40 estudos observacionais, prospectivos e retrospectivos, com mais de 1 milhão de pacientes com DM2, metformina reduziu mortalidade por todas as causas e a incidência de eventos CV em pessoas com IC e DAC comparado as sulfonilureias ou nenhuma medicação.54
- Em pacientes com ICFEp a metformina reduziu mortalidade a longo prazo seguindo admissão por IC aguda e mortalidade por todas as causas em pacientes com mau controle glicêmico.55,56
- Uma revisão sistemática com meta regressão mostrou uma redução significativa de mortalidade na ICFEp pela metformina mesmo após ajustes para outras terapias de IC, incluindo beta-bloqueadores e IECA.57
- Em estudo de coorte com pacientes diabéticos com IC avançada (II e IV) a sobrevida de 1 ano nos pacientes tratados e não tratados com foi 91% and 76% respectively, um resultado não estatisticamente significativo após ajustes multivariados.58
Risco de hospitalização por IC
- Metformina reduziu o risco de admissões por IC comparado a pioglitazona, sulfonilureias, ou outros esquemas sem metformina, e comparativamente às sulfonilureias em pacientes DM2 que persistiram com metformina apesar da redução da filtração glomerular. Este beneficio foi confirmado em revisões sistemáticas e metanálises. 46,59,60,61,62
- Em um estudo observacional retrospectivo, os benefícios da metformina em reduzir exacerbações da IC dissipou-se após poucos dias de suspensão do seu uso, e uma exposição cumulativa não diminuiu o risco de exacerbações da IC.63
- Em outro estudo, a metformina foi associada a menor risco de hospitalização por IC, associado a menor risco de hospitalização por IC em um padrão dose-reposta dependente, com benefício especialmente quando usada por mais de 2,5 anos.64
Risco de novos casos de IC
- Em alguns estudos, o tratamento crônico com metformina se associou a menor risco de IC de inicio recente.65,66
- McAlister et al. estimaram que em cada 4,4 casos de IC por 100 tratamentos-ano ocorreram em pacientes usando sulfonilureias em monoterapia versus 3.3 casos de IC por 100 tratamentos-ano naqueles usando monoterapia com metformina.67
Nota Importante 1: Metformina na IC grave
- A metformina não deve ser usada em pacientes com IC grave ou instável, em razão de maior risco de desenvolvimento de acidose lática.
- A metformina é segura na IC quando a Taxa de filtração Glomerular estiver >30 mL/min/1,73 m2). Acidose láctica é muito rara.68,69
AGONISTAS DO GLP-1
R7 – Em pacientes com DM2 e ICFEp, com obesidade ou sobrepeso, a semaglutida está RECOMENDADA em associação com os ISGLT2 para reduzir a glicemia, reduzir o peso e aumentar a qualidade de vida nestes pacientes.
| Classe IIa | Nível B |
Sumário de evidências:
- O estudo STEP-HFpEF avaliou o efeito da semaglutida em pacientes obesos com IC de fração de ejeção preservada em desfechos primários duplos (alteração no Kansas City Cardiomyopathy Questionnaire-Clinical Summary Score (KCCQ-CSS) e no peso corporal) e desfechos secundários confirmatórios (alteração na distância caminhada de 6 minutos (DTC6), composto hierárquico (óbito, eventos de IC, alteração no KCCQ-CSS e DTC6) e alteração na proteína C reativa (PCR) na obesidade classes I–III (índice de massa corporal (IMC) 30,0–34,9 kg m2, 35,0–39,9 kg m2 e ≥40 kg m2) após 52 semanas. A semaglutida melhorou consistentemente os resultados em todas as categorias de obesidade.70
- No estudo STEP-HFpEF DM foram randomizados pacientes com ICFEp, IMC >30kg/m2 e DM2 para receber semaglutida SC 2,4mg 1x semana por 52 semanas. O desfecho primário foi a alteração média no KCCQ-CSS (13,7 pontos para semaglutida e 6,4 pontos para o placebo) um aumento de 7,3 pontos (95% IC 4,1 a 10,4 p<0,001. O percentual de perda de peso foi -9,8% com a semaglutida e -3,4% com o placebo. Entre pacientes com IC relacionada à obesidade e DM2 com FE preservada a semaglutida SC 2,4mg levou a maiores reduções de sintomas relacionados à IC e das limitações físicas quando comparadas ao placebo.71
- A meta-análise de Sattar e cols incluindo 8 ensaios clinicos randomizados que incluíram 60.080 pacientes com DM2 sem IC mostrou que os agonistas do GLP-1, reduziram hospitalização por IC em 11% (HR 0,89 IC 95 0,82-0,98 p=0,013 pelo AR GLP-1 em comparação com o placebo.72
- Uma metanalise de 9 ensaios clinicos randomizados incluindo apenas pacientes com IC, onde agonistas GLP-1 foram comparados a placebo, com, ao todo, 871 pacientes, não mostrou redução de mortalidade, hospitalização por IC.73
- Agonistas do receptor GLP-1 reduziram o risco de hospitalização por IC e morte cardiovascular em pacientes sem IC. Oito estudos de segurança cardiovascular foram concluídos com agonistas do GLP-1 em pacientes com DM2, e a prevalência de IC estabelecida nesses ensaios variou entre 9% e 24%. A maioria dos AR de GLP-1 teve um efeito neutro no risco de hospitalização por IC nos estudos clínicos randomizados e controlados por placebo que avaliaram a segurança CV de medicamentos anti-hiperglicemiantes em pacientes com DM2 com DCV ou com alto risco. 74–82
- Três pequenos ECRs de AR GLP-1 foram conduzidos em pacientes com ICFEr.83
- O estudo LIVE distribuiu aleatoriamente 241 pacientes com ICFER crônica estável, com ou sem DM, para placebo ou liraglutida. Embora não tenha ocorrido alterações na FEVE, qualidade de vida ou classe funcional, após 24 semanas de tratamento foram observados eventos cardíacos adversos mais graves (taquicardia ventricular sustentada, FA requerendo intervenção e agravamento de DIC; 12 [10%] vs. 3 [3%] para liraglutida e placebo , respectivamente; P = 0,04).84
- O Estudo SELECT avaliou a semaglutida na redução de desfechos cardiovasculares em uma população com obesidade e doença cardiovascular sem diabetes. O SELECT foi um estudo clínico randomizado, duplo-cego, controlado por placebo. Os desfechos primários incluíram morte cardiovascular, infarto do miocárdio não fatal e acidente vascular cerebral não fatal. O segundo objetivo do estudo foi avaliar a segurança da semaglutida no contexto da amostra definida62. Um total de 17.604 pacientes foram incluídos; 8.803 foram designados para receber semaglutida e 8.801 para receber placebo. A duração média (±DP) da exposição à semaglutida ou placebo foi de 34,2±13,7 meses e a duração média do acompanhamento foi de 39,8±9,4 meses. Em relação às características da população, a idade média foi de 61 anos, sendo 27% mulheres. O índice de massa corporal (IMC) médio foi 33 kg/m2, sendo que mais de 70% desses pacientes apresentavam IMC>30 kg/m2. 66% dos pacientes apresentaram HbA1c>5,7%, caracterizando alta incidência de pacientes com síndrome metabólica. Além disso, mais de 75% destes pacientes já haviam apresentado infarto prévio e cerca de 25% possuíam insuficiência cardíaca. Em relação aos objetivos primários, a semaglutida proporcionou uma redução de 20% nos resultados combinados de morte cardiovascular, infarto e acidente vascular cerebral não fatal (p<0.01). Além disso, observou-se uma redução de 18% nos desfechos combinados de mortalidade cardiovascular ou internação por insuficiência cardíaca (IC 95% 0.71-0.96).85
- Uma análise pré-especificada do estudo SELECT analisou os efeitos da semaglutida em desfechos relacionados à insuficiência cardíaca, em pacientes com IC prévia. De 13.314 indivíduos incluídos, 4286 possuíam histórico de Insuficiência cardíaca, dos quais 2.273 tinham diagnóstico de ICFER e 1.347 de ICFeP. No subgrupo de indivíduos com ICFeR observou-se uma redução de 35 % IC (0,49-087) de desfechos combinados com a semaglutida. Nos indivíduos com ICFeP houve uma redução de 31% IC (0,51-0.91) com o uso da semaglutida. Quando se comparou indivíduos com IC com os sem IC, não se observou interação entre os grupos.111
R8 – Em pacientes com DM2 e ICFEr, os agonistas do GLP-1 PODEM SER CONSIDERADOS em associação com os ISGLT2 e metformina para reduzir a glicemia. Devem, no entanto, nos casos graves de IC, serem usados com cautela, em função do risco aumentado de arritmias.
| Classe IIb | Nível B |
Sumário de evidências:
- O estudo FIGHT (Functional Impact of GLP1 for HF Treatment) distribuiu aleatoriamente 300 pacientes com e sem DM com ICFEr e uma hospitalização recente por IC para liraglutida ou placebo. Após 180 dias de tratamento, o desfecho primário (tempo até a morte, tempo até a reinternação por IC e mudança proporcional média no tempo no nível de NT-proBNP desde o início até 180 dias) não foi diferente entre os grupos. Além disso, houve uma diferença não significativa de 41% entre os grupos no número de reinternações por IC no grupo liraglutida vs 34% no grupo placebo; (HR 1,30, IC 95% , 0,89–1,88; P = 0,17) e observou-se um aumento significativo na ocorrência de arritmias ventriculares.86
INIBIDORES DA DPP-4
R9 – Os inibidores da DPP-4 (sitagliptina, linagliptina) PODEM SER CONSIDERADOS para tratamento da hiperglicemia em pacientes com DM2 com IC, ou em risco de IC.
| Classe IIb | Nível B |
Sumário de evidências:
- Quatro inibidores da DPP-4 (sitagliptina, saxagliptina, alogliptina e linagliptina) foram testados em ensaios dedicados de segurança CV controlados por placebo em pacientes com DM2 com ou com alto risco de DCV. A sitagliptina e a linagliptina tiveram um efeito neutro e são consideradas seguras na IC.87–90
Nota importante 2: Inibidores da DPP-4 com risco indefinido na IC
- A alogliptina foi associada a uma tendência não significativa de aumento na hospitalização por IC.91
- A vildagliptina, não foi testada em CVOTs em pacientes com IC.92
R10 – A saxagliptina não é recomendada em pacientes com IC ou em risco de IC por aumentar o risco de hospitalizações por IC.
| Classe III | Nível B |
Sumário de evidências:
- A saxagliptina aumentou significativamente o risco de hospitalização por IC e não é recomendada em pacientes com DM com ou com risco aumentado de IC.93
SULFONILUREIAS
R11 – O uso de sulfonilureias PODE SER CONSIDERADO em pacientes com DM2 e IC crônica, entretanto devem ser usadas com cautela por promoverem ganho de peso e maior risco de hipoglicemia.
| Classe IIb | Nível B |
Sumário de evidências:
- Os dados sobre os efeitos das sulfonilureias na IC são controversos.A grande heterogeneidade deriva especialmente do comparador que é utilizado, e pelo fato da maioria dos estudos serem observacionais. Quando comparadas à metformina, 2 estudos retrospectivos, com 111.971 pacientes DM2, mostraram uma taxa de mortalidade ∼20–60% maior e um risco de IC ∼20–30% maior.94,95 No entanto, em ensaios clinicos randomizados como os estudo UKPDS, NAVIGATOR (Nateglinide And Valsartan in Impaired Glucose Tolerance Outcomes Research) e ADOPT, não houve aumento dos sinais de IC.96–98
- Em dados mais recente, a segurança das sulfonilureias foi comprovada no ensaio clínico randomizado CARMELINA, que comparou a linagliptina vs. glimepirida em uma população de alto risco cardiovascular com DM2, não mostrou aumento de risco de hospitalização por IC por esta sulfonilureia.99
- O ensaio clinico randomizado e aberto, TOSCA.IT, comparou a pioglitazona com sulfonilureias em pacientes DM2 de meia idade que estavam usando metformina. Os pacientes foram randomicamente alocados para receber pioglitazona ou uma sulfonilurea (glibenclamida, glimepirida, or gliclazida). A escolha da sulfonilureia era determinada pela prática local. O desfecho primário era a ocorrência de eventos ateroscleróticos isquêmicos (morte cardiovascular, IAM não fatal e AVC não-fatal. Durante um seguimento médio de 4,7 anos os investigadores não relataram diferenças entre os dois grupos de tratamento e o desfecho primário.
- A incidência cumulativa de IC no TOSCA.IT durante um seguimento médio de 4,7 anos foi 1.0% (0,8% no braço sulfonilureia e 1,2% no braço pioglitazona, com uma taxas anualizada de 0,2% ao ano. (IC era desfecho secundário e foi adjudicado por um comitê independente.100
- Os investigadores do TOSCA.IT relatam que a incidência de IC no trial foi baixa e não diferente entre os dois tratamentos. A diferença no risco de IC entre os dois grupos teria sido pequena e difícil de definir devido ao pequeno número de eventos. Os investigadores concluiram que não houve diferença no risco de IC nos 2 grupos de tratamento. No entanto há ainda discussões sobre o uso de sulfonilureias em pacientes com IC, uma vez que o risco de IC foi semelhante ao da pioglitazona que é conhecida por aumentar o risco de IC.101
- Um estudo nacional realizado na Escócia avaliou a segurança cardiovascular de mundo real para sulfonilureias, em comparação com inibidores da dipeptidilpeptidase-4 e tiazolidinedionas, através do desenvolvimento de metodologia robusta para inferência causal. O desfecho primário foi o composto eventos cardiovasculares adversos maiores (MACE), incluindo hospitalização por IM, hospitalização para acidente vascular cerebral isquêmico, hospitalização por Insuficiencia cardíaca e morte CV. Comparando SU com não-SU (DPP4i/TZD), a taxa de risco (HR) para MACE foi de 1,00 (IC 95%: 0,91–1,09) e 1,02 (0,91–1,13). Para todas as causas de morte, a taxa de risco foi 1,03 (0,94–1,13), Este estudo observacional demonstrou baixa probabilidade das sulfonilureias usadas como terapia hipoglicemiante de segunda linha aumentem risco cardiovascular,risco de hospitalização por IC ou mortalidade por todas as causas em uma população não selecionada com ou sem alto risco cardiovascular de eventos cardiovasculares maiores pré-existentes.107.
- O risco de IC parece ser dependente da dose da sulfonilurea. Doses maiores levariam a maiores riscos. Em uma metanalise de estudos observacionais foi observado um aumento de risco de IC de 17% em pacientes já usando sulfonilureias e de 22% nos novos usuários de sulfonilureas.102
TIAZOLINENEDIONAS
R12 – A pioglitazona NÃO É RECOMENDADA para o tratamento da hiperglicemia em pacientes com DM2 com IC ou em risco de IC, por estar associada a agravamento e maior número de internações por IC.
| Classe III | Nível A |
Sumário de evidências:
- As tiazolidinedionas aumentaram o risco de hospitalização por IC em vários ensaios clinicos e não são recomendadas em pacientes com diabetes com sintomas ou em risco de IC. 103-106
TERAPIA BASEADA EM INSULINA:
R13 – O uso de insulina em paciente com IC PODE SER CONSIDERADO para tratamento da hiperglicemia em pacientes com DM2 com IC, devendo ser utilizada com cautela nos pacientes com IC grave.
| Classe IIb | Nível C |
Sumário de evidências:
- Não encontramos estudos randomizados com insulina em pacientes com IC. Em um estudo retrospectivo de pacientes DM2 com IC avançada (estagio 4), o uso de insulina esteve associado a um prognóstico significativamente pior. No entanto, este estudo é limitado, pois os pacientes usando insulina eram sabidamente mais graves, com mais doença coronariana isquêmica e bem mais tempo de diabetes, o que limita as conclusões do estudo.108
R14 – Os análogos de insulina basal (glargina e degludeca) DEVEM SER CONSIDERADOS para melhora do controle glicêmico em pacientes com DM2 e IC, quando a HbA1c não atingir a meta.
| Classe IIa | Nível B |
Sumário de evidências:
- Dois análogos de insulina basal foram avaliados em ensaios clinicos randomizados dedicados a desfechos cardiovasculares. No estudo ORIGIN, com 12.537 pacientes (idade média de 63,5 anos) com alto risco CV, com intolerância à glicose ou DM2, foram randomizados para receber insulina glargina titulada para um nível de glicemia em jejum de ≤5,3 mmol/L (≤95 mg/ dL) ou cuidados padrão. Após um acompanhamento médio de 6,2 anos, a insulina glargina não apresentou aumento nas hospitalizações por IC.109
- O estudo randomizado DEVOTE, uma comparação duplo-cego da insulina degludec de ação ultralonga, uma vez ao dia, vs insulina glargina, recrutou 7.637 pacientes com DM2 com DCVA ou em alto Risco CV. O tratamento com insulina degludec versus insulina glargina não diferiu em relação à hospitalização por IC.110
RESUMO DAS RECOMENDAÇÕES
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1 – É RECOMENDADO que, em todos os indivíduos adultos com DM2, seja realizado uma história médica detalhada e um exame clínico buscando fatores de risco, sinais e sintomas sugestivos de IC. | I | C |
| R2 – É RECOMENDADO que, na presença de sinais e sintomas de IC, uma avaliação laboratorial incluindo NT-ProBNP (ou BNP), ECG, Raio X de Tórax e Ecocardiograma Transtorácico sejam realizados, quando disponíveis, para confirmação diagnóstica. | I | C |
| R3 – DEVE SER CONSIDERADO o rastreamento com NT-ProBNP (ou BNP), quando disponíveis, para disfunção ventricular em pacientes com DM2 assintomáticos, que sejam de alto risco para IC. | IIa | C |
| R4 – Em pacientes DM2 com ICFEP ou ICFEr DEVE SER CONSIDERADO buscar o controle glicêmico otimizado, procurando atingir e manter de forma estável a meta de HbA1c 6,5-7,5%, devendo ser evitadas reduções abruptas. | IIa | B |
| R5 – Em pacientes DM2 e IC, com qualquer fração de ejeção, É RECOMENDADO o uso de inibidores do SGLT2 como anti-diabéticos de primeira escolha para controle glicêmico, redução de hospitalização por IC e de morte cardiovascular, independentemente do nível de HbA1c. | I | A |
| R6 – Em pacientes com DM2 e IC crônica, o uso de metformina ESTÁ RECOMENDADO em associação com os inibidores do ISGLT2, para controle da glicemia, redução de mortalidade e risco de admissão por IC, desde que a TFG esteja acima de 30ml/min/1,73m2. | I | B |
| R7 – Em pacientes com DM2 e ICFEp, com obesidade ou sobrepeso, a semaglutida está RECOMENDADA em associação com os ISGLT2 para reduzir a glicemia, reduzir o peso e aumentar a qualidade de vida nestes pacientes. | IIa | B |
| R8 – Em pacientes com DM2 e ICFEr, os agonistas do GLP-1 PODEM SER CONSIDERADOS em associação com os ISGLT2 e metformina para reduzir a glicemia. Devem, no entanto, nos casos graves de IC, serem usados com cautela, em função do risco aumentado de arritmias. | IIb | B |
| R9 – Os inibidores da DPP-4 (sitagliptina, linagliptina) PODEM SER CONSIDERADOS para tratamento da hiperglicemia em pacientes com DM2 com IC, ou em risco de IC. | IIb | B |
| R10 – A saxagliptina não é recomendada em pacientes com IC ou em risco de IC por aumentar o risco de hospitalizações por IC. | III | B |
| R11 – O uso de sulfonilureias PODE SER CONSIDERADO em pacientes com DM2 e IC crônica, entretanto devem ser usadas com cautela por promoverem ganho de peso e maior risco de hipoglicemia. | IIb | B |
| R12 – A pioglitazona NÃO É RECOMENDADA para o tratamento da hiperglicemia em pacientes com DM2 com IC ou em risco de IC, por estar associada a agravamento e maior número de internações por IC. | III | A |
| R13 – O uso de insulina em paciente com IC PODE SER CONSIDERADO para tratamento da hiperglicemia em pacientes com DM2 com IC, devendo ser utilizada com cautela nos pacientes com IC grave. | IIb | C |
| R14 – Os análogos de insulina basal (glargina e degludeca) DEVEM SER CONSIDERADOS para melhora do controle glicêmico em pacientes com DM2 e IC, quando a HbA1c não atingir a meta. | IIa | B |
REFERÊNCIAS
- Marcondes-Braga FG, Moura LAZ, Issa VS, Vieira JL, Rohde LE, Simões MV, et al. Emerging Topics Update of the Brazilian Heart Failure Guideline – 2021. Arq Bras Cardiol. 2021;116(6):1174–212.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2021;42:3599–3726
- Flor LS, Campos MR. The prevalence of diabetes mellitus and its associated factors in the Brazilian adult population: evidence from a population-based survey. Rev Bras Epidemiol. 2017 Jan-Mar;20(1):16-29. Portuguese, English.
- Kosiborod M, Lichtman JH, Heidenreich PA, Normand SL, Wang Y, Brass LM, Krumholz HM. National trends in outcomes among elderly patients with heart failure. Am J Med. 2006 Jul;119(7):616.e1-7.
- Roger VL, Weston SA, Redfield MM, Hellermann-Homan JP, Killian J, Yawn BP, Jacobsen SJ. Trends in heart failure incidence and survival in a community-based population. JAMA. 2004 Jul 21;292(3):344-50.
- Nichols GA, Gullion CM, Koro CE, Ephross SA, Brown JB (2004) The incidence of congestive heart failure in type 2 diabetes: an update. Diabetes Care 27 (8):1879–84.
- Dei Cas A, Khan SS, Butler J et al (2015) Impact of diabetes on epidemiology, treatment, and outcomes of patients with heart failure. JACC Heart Fail 3(2):136–45.
- Iribarren C, Karter AJ, Go AS, et al. Glycemic control and heart failure among adult patients with diabetes. Circulation 2001;103:2668e7.
- Kannel WB, McGee DL. Diabetes and cardiovascular disease. The Framingham study. JAMA 1979;241:2035e8.
- Pham I, Cosson E, Nguyen MT, Banu I, Genevois I, Poignard P, et al. Evidence for a specific diabetic cardiomyopathy: an observational retrospective echocardiographic study in 656 asymptomatic type 2 diabetic patients. Int J Endocrinol 2015;2015:743503.
- Kannel WB, McGee DL. Diabetes and cardiovascular disease. The Framingham study. JAMA 1979;241:2035e8.
- Gottdiener JS, Arnold AM, Aurigemma GP, Polak JF, Tracy RP, Kitzman DW, Gardin JM, Rutledge JE, Boineau RC. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study. J Am Coll Cardiol. 2000 May;35(6):1628-37.
- Liu JE, Palmieri V, Roman MJ, et al. The impact of diabetes on left ventricular filling pattern in normotensive and hypertensive adults: the strong heart study. J Am Coll Cardiol 2001;37:1943–9.
- Kiencke S, Handschin R, von Dahlen R, et al. Pre-clinical diabetic cardiomyopathy: prevalence, screening, and outcome. Eur J Heart Fail 2010;12:951–7.
- Patil VC, Patil HV, Shah KB, et al. Diastolic dysfunction in asymptomatic type 2 diabetes mellitus with normal systolic function. J Cardiovasc Dis Res 2011;2:213–22.
- Wang Y, Yang H, Huynh Q, et al. Diagnosis of nonischemic stage B heart failure in type 2 diabetes mellitus: optimal parameters for prediction of heart failure. JACC Cardiovasc Imaging 2018;11:1390–400.
- Faden G, Faganello G, De Feo S, et al. The increasing detection of asymptomatic left ventricular dysfunction in patients with type 2 diabetes mellitus without overt cardiac disease: data from the SHORTWAVE study. Diabetes Res Clin Pract 2013;101:309–16.
- Yang H, Negishi K, Wang Y, et al. Echocardiographic screening for non-ischaemic stage B heart failure in the community. Eur J Heart Fail 2016;18:1331–9.
- The Criteria Committee of the New York Heart Association. (1994). Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels (9th ed.). Boston: Little, Brown & Co. pp. 253–256.
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, Deswal A, Drazner MH, Dunlay SM, Evers LR, Fang JC, Fedson SE, Fonarow GC, Hayek SS, Hernandez AF, Khazanie P, Kittleson MM, Lee CS, Link MS, Milano CA, Nnacheta LC, Sandhu AT, Stevenson LW, Vardeny O, Vest AR, Yancy CW; WRITING COMMITTEE MEMBERS. 2022 American College of Cardiology/American Heart Association/Heart Failure Society of America Guideline for the Management of Heart Failure: Executive Summary. J Card Fail. 2022 May;28(5):810-830.
- Bozkurt B, Coats JS, Tsutsui H et al ,Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association Eur J Heart Fail 2021 Mar;23(3):352-380. doi: 10.1002/ejhf.2115. Epub 2021 Mar 3.
- Jering K, Claggett B, Redfield M et al. Burden of Heart Failure Signs and Symptoms, Prognosis, and Response to Therapy.The PARAGON-HF Trial Volume 9, Issue 5, May 2021, Pages 386-397.
- Maestre A, Gil V, Gallego J, Aznar J, Mora A, Martín-Hidalgo A. Diagnostic accuracy of clinical criteria for identifying systolic and diastolic heart failure: cross-sectional study. J Eval Clin Pract. 2009 Feb;15(1):55-61.
- King M, Kingery J, Casey B. Diagnosis and evaluation of heart failure. Am Fam Physician. 2012 Jun 15;85(12):1161-8.
- Seferović P, Farmakis D, Bayes-Genis A, Gal TB, Böhm M, Chioncel O, et al. Biomarkers for the prediction of heart failure and cardiovascular events in patients with type 2 diabetes: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2022;24:1162–1170.
- Finocchiaro G, Merlo M, Sheikh N, De Angelis G, Papadakis M, Olivotto I, Rapezzi C, Carr-White G, Sharma S, Mestroni L, Sinagra G. The electrocardiogram in the diagnosis and management of patients with dilated cardiomyopathy. Eur J Heart Fail. 2020 Jul;22(7):1097-1107.
- Wang CS, FitzGerald JM, Schulzer M, Mak E, Ayas NT. Does this dyspneic patient in the emergency department have congestive heart failure?. JAMA. 2005;294(15):1944-1956.
- Bertoluci MC, Silva Júnior WS, Valente F, Araujo LR, Lyra R, de Castro JJ, Raposo JF, Miranda PAC, Boguszewski CL, Hohl A, Duarte R, Salles JEN, Silva-Nunes J, Dores J, Melo M, de Sá JR, Neves JS, Moreira RO, Malachias MVB, Lamounier RN, Malerbi DA, Calliari LE, Cardoso LM, Carvalho MR, Ferreira HJ, Nortadas R, Trujilho FR, Leitão CB, Simões JAR, Dos Reis MIN, Melo P, Marcelino M, Carvalho D. 2023 UPDATE: Luso-Brazilian evidence-based guideline for the management of antidiabetic therapy in type 2 diabetes. Diabetol Metab Syndr. 2023 Jul 19;15(1):160.
- Xanthakis V, Enserro DM, Larson MG, Wollert KC, Januzzi JL, Levy D, et al. Prevalence, neurohormonal correlates, and prognosis of heart failure stages in the community. JACC Heart Fail. 2016;4(10):808–15. https:// doi. org/ 10. 1016/j. jchf. 2016. 05. 001.
- Miura M, Sakata Y, Nochioka K, Takada T, Tadaki S, Ushigome R, et al. Prevalence, predictors and prognosis of patients with heart failure requiring nursing care. Circ J. 2014;78(9):2276–83. https:// doi. org/ 10. 1253/ circj. cj- 14- 0387.
- Pugliese NR, Fabiani I, La Carrubba S, Carerj S, Conte L, Colonna, et al. Prognostic value of a tissue Doppler index of systo-diastolic function in patients with asymptomatic heart failure. J Cardiovasc Echogr. 2018;28(2):95–100. https:// doi. org/ 10. 4103/jcecho. jcecho_ 59_ 17.
- Zinman B, Lachin JM, Inzucchi SE. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2016 Mar 17;374(11):1094. doi: 10.1056/NEJMc1600827. PMID: 26981940
- Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017 Aug 17;377(7):644-657.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS; DECLARE–TIMI 58 Investigators. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019 Jan 24;380(4):347-357.
- Rawshani A, Rawshani A, Franzén S, Sattar N, Eliasson B, Svensson AM, Zethelius B, Miftaraj M, McGuire DK, Rosengren A, Gudbjörnsdottir S. Risk Factors, Mortality, and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2018 Aug 16;379(7):633-644.
- Iribarren C, Karter AJ, Go AS, Ferrara A, Liu JY, Sidney S, Selby JV. Glycemic control and heart failure among adult patients with diabetes. Circulation. 2001 Jun 5;103(22):2668-73.
- Tee C, Xu H, Fu X, Cui D, Jafar TH, Bee YM. Longitudinal HbA1c trajectory modelling reveals the association of HbA1c and risk of hospitalization for heart failure for patients with type 2 diabetes mellitus. PLoS One. 2023 Jan 20;18(1):e0275610.
- Docherty KF, Jhund PS, Bengtsson O, DeMets DL, Inzucchi SE, Køber L, et al. Effect of dapagliflozin in DAPA-HF according to background glucose-lowering therapy. Diabetes Care 2020;43:2878–2881.
- Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383: 1413–1424.
- Butler J, Anker SD, Filippatos G,Khan MS,Ferreira JP,Pocock SJ,etal.Empagliflozin and health-related quality of life outcomes in patients with heart failure with reduced ejection fraction: the EMPEROR-Reduced trial. Eur Heart J 2021;42:1203–1212.
- Bhatt DL, Szarek M, Steg PG, Cannon CP, Leiter LA, McGuire DK, et al. Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med 2021;384: 117–128.
- Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernandez AF, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. Lancet 2022;400:757–767.
- Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021;385:1451–1461.
- Solomon SD, McMurray JJ, Claggett B, de Boer RA, DeMets D, Hernandez AF, et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med 2022;387:1089–1098.
- Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernandez AF, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. Lancet 2022;400:757–767.
- Masoudi, F.A.; Inzucchi, S.E.; Wang, Y.; Havranek, E.P.; Foody, J.M.; Krumholz, H.M. Thiazolidinediones, metformin, and outcomes in older patients with diabetes and heart failure: An observational study. Circulation 2005, 111, 583–590.
- Eurich, D.T.; Majumdar, S.R.; McAlister, F.A.; Tsuyuki, R.T.; Johnson, J.A. Improved clinical outcomes associated with metformin in patients with diabetes and heart failure. Diabetes Care 2005, 28, 2345–2351.
- Dludla, P.V.; Nyambuya, T.M.; Johnson, R.; Silvestri, S.; Orlando, P.; Mazibuko- Mbeje, S.E.; Gabuza, K.B.; Mxinwa, V.; Mokgalaboni, K.; Tiano, L.; et al. Metformin and heart failure-related outcomes in patients with or without diabetes: A systematic review of randomized controlled trials. Heart Fail. Rev. 2021, 26, 1437–1445.
- MacDonald, M.R.; Eurich, D.T.; Majumdar, S.R.; Lewsey, J.D.; Bhagra, S.; Jhund, P.S.; Petrie, M.C.; McMurray, J.J.; Petrie, J.R.; McAlister, F.A. Treatment of type 2 diabetes and outcomes in patients with heart failure: A nested case-control study from the U.K. General Practice Research Database. Diabetes Care 2010, 33, 1213–1218.
- Romero, S.P.; Andrey, J.L.; Garcia-Egido, A.; Escobar, M.A.; Perez, V.; Corzo, R.; Garcia-Domiguez, G.J.; Gomez, F. Metformin therapy and prognosis of patients with heart failure and new-onset diabetes mellitus. A propensity-matched study in the community. Int. J. Cardiol. 2013, 166, 404–412.
- Lamanna, C.; Monami, M.; Marchionni, N.; Mannucci, E. Effect of metformin on cardiovascular events and mortality: A meta-analysis of randomized clinical trials. Diabetes Obes. Metab. 2011, 13, 221–228.
- Bolen, S.; Tseng, E.; Hutfless, S.; Segal, J.B.; Suarez-Cuervo, C.; Berger, Z.; Wilson, L.M.; Chu, Y.; Iyoha, E.; Maruthur, N.M. Diabetes Medications for Adults with Type 2 Diabetes: An Update; 2016 Apr. Report No.: 16-EHC013-EF; Agency for Healthcare Research and Quality: Rockville, MD, USA, 2016. 191.
- Crowley, M.J.; Diamantidis, C.J.; McDuffie, J.R.; Cameron, C.B.; Stanifer, J.W.; Mock, C.K.; Wang, X.; Tang, S.; Nagi, A.; Kosinski, A.S.; et al. Clinical outcomes of metformin use in populations with chronic kidney disease, congestive heart failure, or chronic liver disease: A systematic review. Ann. Intern. Med. 2017, 166, 191–200.
- Han, Y.; Xie, H.; Liu, Y.; Gao, P.; Yang, X.; Shen, Z. Effect of metformin on all-cause and cardiovascular mortality in patients with coronary artery diseases: A systematic review and an updated meta-analysis. Cardiovasc. Diabetol. 2019, 18, 96.
- Fácila, L.; Fabregat-Andrés, Ó.; Bertomeu, V.; Navarro, J.P.; Miñana, G.; García-Blas, S.; Valero, E.; Morell, S.; Sanchis, J.; Núñez, J. Met-formin and risk of long-term mortality following an admission for acute heart failure. J. Cardiovasc. Med. 2017, 18, 69–73.
- Wang, J.; Lu, Y.; Min, X.; Yuan, T.; Wei, J.; Cai, Z. The Association Between Metformin Treatment and Outcomes in Type 2 Diabetes Mellitus Patients With Heart Failure With Preserved Ejection Fraction: A Retrospective Study. Front. Cardiovasc. Med. 2021, 8, 648212.
- Halabi, A.; Sen, J.; Huynh, Q.; Marwick, T.H. Metformin treatment in heart failure with preserved ejection fraction: A systematic review and meta-regression analysis. Cardiovasc. Diabetol. 2020, 19, 124.
- Shah, D.D.; Fonarow, G.C.; Horwich, T.B. Metformin therapy and outcomes in patients with advanced systolic heart failure and diabetes. J. Card. Fail. 2010, 16, 200–206.
- Eurich, D.T.; Majumdar, S.R.; McAlister, F.A.; Tsuyuki, R.T.; Johnson, J.A. Improved clinical outcomes associated with metformin in patients with diabetes and heart failure. Diabetes Care 2005, 28, 2345–2351.
- Lamanna, C.; Monami, M.; Marchionni, N.; Mannucci, E. Effect of metformin on cardiovascular events and mortality: A meta-analysis of randomized clinical trials. Diabetes Obes. Metab. 2011, 13, 221–228.
- Bolen, S.; Tseng, E.; Hutfless, S.; Segal, J.B.; Suarez-Cuervo, C.; Berger, Z.; Wilson, L.M.; Chu, Y.; Iyoha, E.; Maruthur, N.M. Diabetes Medications for Adults with Type 2 Diabetes: An Update; 2016 Apr. Report No.: 16-EHC013-EF; Agency for Healthcare Research and Quality: Rockville, MD, USA, 2016.
- Crowley, M.J.; Diamantidis, C.J.; McDuffie, J.R.; Cameron, C.B.; Stanifer, J.W.; Mock, C.K.; Wang, X.; Tang, S.; Nagi, A.; Kosinski, A.S.; et al. Clinical outcomes of metformin use in populations with chronic kidney disease, congestive heart failure, or chronic liver disease: A systematic review. Ann. Intern. Med. 2017, 166, 191–200.
- Weir, D.L.; Abrahamowicz, M.; Beauchamp, M.E.; Eurich, D.T. Acute vs cumulative benefits of metformin use in patients with type 2 diabetes and heart failure. Diabetes Obes. Metab. 2018, 20, 2653–2660.
- Tseng, C.H. Metformin use is associated with a lower risk of hospitalization for heart failure in patients with type 2 diabetes mellitus: A retrospective cohort analysis. J. Am. Heart Assoc. 2019, 8, e011640.
- Nichols, G.A.; Koro, C.E.; Gullion, C.M.; Ephross, S.A.; Brown, J.B. The incidence of congestive heart failure associated with antidiabetic therapies. Diabetes Metab. Res. Rev. 2005, 21, 51–57.
- Pantalone, K.M.; Kattan, M.W.; Yu, C.; Wells, B.J.; Arrigain, S.; Jain, A.; Atreja, A.; Zimmerman, R.S. The risk of developing coronary artery disease or congestive heart failure, and overall mortality, in type 2 diabetic patients receiving rosiglitazone, pioglitazone, metformin, or sulfonylureas: A retrospective analysis. Acta Diabetol. 2009, 46, 145–154.
- McAlister, F.A.; Eurich, D.T.; Majumdar, S.R.; Johnson, J.A. The risk of heart failure in patients with type 2 diabetes treated with oral agent monotherapy. Eur. J. Heart Fail. 2008, 10, 703–708.
- Eurich DT, Weir DL, Majumdar SR, Tsuyuki RT, Johnson JA, Tjosvold L, et al. Comparative safety and effectiveness of metformin in patients with diabetes mellitus and heart failure: systematic review of observational studies involving 34000 patients. Circ Heart Fail 2013;6:395–402. https://doi.org/10.1161/CIRCHEARTFAILURE.112. 000162
- Inzucchi SE, Lipska KJ, Mayo H, Bailey CJ, McGuire DK. Metformin in patients with type 2 diabetes and kidney disease: a systematic review. JAMA 2014;312:2668–2675.
- Kosiborod, M. N. et al. Once weekly semaglutide in heart failure with preserved ejection fraction and obesity. N. Engl. J. Med. 2023.
- Sattar N, Lee MM, Kristensen SL, Branch KR, Del Prato S, Khurmi NS, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol 2021;9:653–662.
- Merza N, Akram M, Mengal A, Rashid AM, Mahboob A, Faryad M, Fatima Z, Ahmed M, Ansari SA. The Safety and Efficacy of GLP-1 Receptor Agonists in Heart Failure Patients: A Systematic Review and Meta-Analysis. Curr Probl Cardiol. 2023 May;48(5):101602.
- Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375: 311–322.
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375:1834–1844.
- Pfeffer MA, Claggett B, Diaz R, Dickstein K, Gerstein HC, Køber LV, et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med 2015;373: 2247–2257.
- Holman RR, Bethel MA, Mentz RJ, Thompson VP, Lokhnygina Y, Buse JB, et al. Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2017;377:1228–1239.
- Hernandez AF, Green JB, Janmohamed S, D’Agostino RB Sr, Granger CB, Jones NP, et al. Albiglutide and cardiovascular outcomes in patients with type 2 diabetes and cardiovascular disease (Harmony Outcomes): a double-blind, randomised placebo-controlled trial. Lancet 2018;392:1519–1529.
- Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomized placebo-controlled trial. Lancet 2019;394:121–130.
- Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR, et al. Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2019;381:841–851.
- Gerstein HC, Sattar N, Rosenstock J, Ramasundarahettige C, Pratley R, Lopes RD, et al. Cardiovascular and renal outcomes with efpeglenatide in type 2 diabetes. N Engl J Med 2021;385:896–907.
- Marso SP, Baeres FM, Bain SC, Goldman B, Husain M, Nauck MA, et al. Effects of liraglutide on cardiovascular outcomes in patients with diabetes with or without heart failure. J Am College Cardiol 2020;75:1128–1141.
- Khan MS, Fonarow GC, McGuire DK, Hernandez AF, Vaduganathan M, Rosenstock J, et al. Glucagon-like peptide 1 receptor agonists and heart failure: the need for further evidence generation and practice guidelines optimization. Circulation 2020;142: 1205–1218.
- Jorsal A, Kistorp C, Holmager P, Tougaard RS, Nielsen R, Hänselmann A, et al. Effect of liraglutide, a glucagon-like peptide-1 analog, on left ventricular function in stable chronic heart failure patients with and without diabetes (LIVE)—a multicentre, double-blind, randomised, placebo-controlled trial. Eur J Heart Fail 2017;19:69–77.
- Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. N Engl J Med.
- Margulies KB, Hernandez AF, Redfield MM, Givertz MM, Oliveira GH, Cole R, et al. Effects of liraglutide on clinical stability among patients with advanced heart failure and reduced ejection fraction: a randomized clinical trial. JAMA 2016;316:500–508.GreenJB, Bethel MA, Armstrong PW,BuseJB, Engel SS,GargJ,et al. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;373:232–242.
- Rosenstock J, Perkovic V, Johansen OE, Cooper ME, Kahn SE, Marx N, et al. Effect of linagliptin vs placebo on major cardiovascular events in adults with type 2 diabetes and high cardiovascular and renal risk: the CARMELINA randomized clinical trial. JAMA 2019;321:69–79.
- McGuire DK, Van de Werf F, Armstrong PW, Standl E, Koglin J, Green JB, et al. Association between sitagliptin use and heart failure hospitalization and related outcomes in type 2 diabetes mellitus: secondary analysis of a randomized clinical trial. JAMA Cardiol 2016;1:126–135.
- McGuire DK, Alexander JH, Johansen OE, Perkovic V, Rosenstock J, Cooper ME, et al. Linagliptin effects on heart failure and related outcomes in individuals with type 2 diabetes mellitus at high cardiovascular and renal risk in CARMELINA. Circulation 2019; 139:351–361.
- Rosenstock J, Kahn SE, Johansen OE, Zinman B, Espeland MA, Woerle HJ, et al. Effect of linagliptin vs glimepiride on major adverse cardiovascular outcomes in patients with type 2 diabetes: the CAROLINA randomized clinical trial. JAMA 2019;322:1155–1166.
- White WB, Cannon CP, Heller SR, Nissen SE, Bergenstal RM, Bakris GL, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013;369:1327–1335.
- McMurray JJ, Ponikowski P, Bolli GB, Lukashevich V, Kozlovski P, Kothny W, et al. Effects of vildagliptin on ventricular function in patients with type 2 diabetes mellitus and heart failure: a randomized placebo-controlled trial. JACC Heart Fail 2018;6: 8–17.
- Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317–1326.
- Pantalone KM, Kattan MW, Yu C, Wells BJ, Arrigain S, Jain A, et al. The risk of developing coronary artery disease or congestive heart failure, and overall mortality, in type 2 diabetic patients receiving rosiglitazone, pioglitazone, metformin, or sulphonylureas: a retrospective analysis. Acta Diabetol 2009;46:145–154.
- Tzoulaki I, Molokhia M, Curcin V, Little MP, Millett CJ, Ng A, et al. Risk of cardiovascular disease and all-cause mortality among patients with type 2 diabetes prescribed oral antidiabetes drugs: retrospective cohort study using UK general practice research database. BMJ 2009;339:b4731.
- Viberti G, Kahn SE, Greene DA, Herman WH, Zinman B, Holman RR, et al. A Diabetes Outcome Progression Trial (ADOPT). An international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes. Diabetes Care 2002;25:1737–1743.
- Holman RR, Haffner SM, McMurray JJ, Bethel MA, Holzhauer B, Hua TA, et al. Effect of nateglinide on the incidence of diabetes and cardiovascular events. N Engl J Med 2010; 362:1463–1476.
- UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ 1998;317:703–713.
- McGuire DK, Alexander JH, Johansen OE, Perkovic V, Rosenstock J, Cooper ME, et al. Linagliptin effects on heart failure and related outcomes in individuals with type 2 diabetes mellitus at high cardiovascular and renal risk in CARMELINA. Circulation 2019; 139:351–361.
- Vaccaro O, et al: Thiazolidinediones Or Sulfonylureas Cardiovascular Accidents Intervention Trial (TOSCA.IT) study group; Italian Diabetes Society. Effects on the incidence of cardiovascular events of the addition of pioglitazone versus sulfonylureas in patients with type 2 diabetes inadequately controlled with metformin (TOSCA.IT): a randomised, multicentre trial. Lancet Diabetes Endocrinol. 2017 Nov;5(11):887-897.
- Packer M. Are physicians neglecting the risk of heart failure in diabetic patients who are receiving sulfonylureas? Lessons from the TOSCA.IT trial. Eur J Heart Fail. 2018 Jan;20(1):49-51.
- McAlister FA, Eurich DT, Majumdar SR, Johnson JA. The risk of heart failure in patients with type 2 diabetes treated with oral agent monotherapy. Eur J Heart Fail 2008;10:703–70.
- de Jong M, van der Worp HB, van der Graaf Y, Visseren FL, Westerink J. Pioglitazone and the secondary prevention of cardiovascular disease. A meta-analysis of randomized controlled trials. Cardiovasc Diabetol 2017;16:134.
- Gerstein HC, Yusuf S, Bosch J, Pogue J, Sheridan P, Dinccag N, et al. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet 2006;368:1096–1105.
- Hernandez AV, Usmani A, Rajamanickam A, Moheet A. Thiazolidinediones and risk of heart failure in patients with or at high risk of type 2 diabetes mellitus. Am J Cardiovasc Drugs 2011;11:115–128.
- Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomized, open-label trial. Lancet 2009;373:2125–2135.
- Wang H, Cordiner1R L.M, Huang Yet al Cardiovascular Safety in Type 2 Diabetes With Sulfonylureas as Second-Line Drugs: A Nation-Wide Population-Based Comparative Safety Study Diabetes Care 2023;46(5):1–11.
- Smooke S, Horwich TB, Fonarow GC. Insulin-treated diabetes is associated with a marked increase in mortality in patients with advanced heart failure. Am Heart J 2005;149:168–174.
- Gerstein HC, Bosch J, Dagenais GR, Díaz R, Jung H, Maggioni AP, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012;367:319–328.
- Pratley RE, Husain M, Lingvay I, Pieber TR, Mark T, Saevereid HA, et al. Heart failure with insulin degludec versus glargine U100 in patients with type 2 diabetes at high risk of cardiovascular disease: DEVOTE 14. Cardiovasc Diabetol 2019;18:156.
- Deanfield JE et al Semaglutide and Cardiovascular outcomes in Patients with overweight or obesity and Heart failure : SELECT Trial Presented at ESC HF SCIENTIFIC SESSION in late break Clínical trials in may 14th 2024.
- Nichols GA, Hillier TA, Erbey JR, Brown JB. Congestive heart failure in type 2 diabetes: prevalence, incidence, and risk factors. Diabetes Care. 2001 Sep;24(9):1614-9.
Cite este artigo
José Francisco Kerr Saraiva, Marcello Bertoluci. Tratamento da hiperglicemia em pacientes com DM2 e Insuficiência Cardíaca Crônica (IC). Diretriz Oficial da Sociedade Brasileira de Diabetes (2024). DOI: 10.29327/5412848.2024-9, ISBN: 978-65-272-0704-7.