Autores: Emerson Cestari Marino, Denise Momesso, Marcos Tadashi Kakitani Toyoshima, Maria Fernanda Ozorio, Beatriz D´agord Schaan, Leandra Negretto, Augusto Cézar Santomauro Júnior, Priscilla Cukier, Paulo Roberto Rizzo Genestreti, Alina Coutinho Rodrigues Feitosa, Jorge Eduardo da Silva Soares Pinto, Rodrigo Nunes Lamounier
Editor Chefe: Marcello Bertoluci
Última revisão em: 20/06/2024
DOI: 10.29327/5412848.2024-5 | Cite este Artigo
Introdução
A Hiperglicemia hospitalar (HH) é definida tradicionalmente pela presença de glicemia capilar ou plasmática acima de 140 mg/dL em indivíduos hospitalizados. Entretanto o tratamento farmacológico é necessário para glicemias acima de 180mg/dL, que estão associadas a maiores riscos de complicações e estão fora das metas de controle de glicemia intra-hospitalar. Sendo assim a glicemia acima de 180mg/dL foi definida por este painel como ponto de corte mais custo-efetivo para rastreio e intervenção. A HH, independentemente da presença de DM, está associada a piores desfechos, incluindo maiores taxas de mortalidade hospitalar, maior número de admissões em unidades de terapia intensiva e maior tempo de hospitalização.¹ ⁻ ⁵
A HH tem sido relatada em 22-46% dos pacientes não-críticos hospitalizados. Dados do Annual National Diabetes Inpatient Audit do Reino-Unido sugerem que a prevalência de diabetes em pacientes internados aumentou de 15% em 2010 para quase 20% em 2019. O controle glicêmico do paciente internado tende a ser subestimado, o que leva à inércia clínica no manejo glicêmico intra-hospitalar⁶.
Estudos clínicos sobre o tratamento da HH mostram melhora em diversos desfechos, sendo os mais frequentes a redução da incidência de infecções nosocomiais, principalmente aquelas relacionadas aos sítios cirúrgicos e pneumonia, assim como a redução do tempo de internamento e custos. Estes desfechos são potencializados quando o seguimento é realizado por uma equipe especializada e dedicada ao controle glicêmico hospitalar.⁷⁻¹¹
Pacientes que apresentem mais de 2 glicemias ao dia acima de 180mg/dL, classificado como HH persistente, necessitam de formas de controle efetivas da glicemia, sendo desaconselhado neste caso o uso das tradicionais escalas de correção de insulina de forma isolada.⁷ ⁻ ¹² ⁻ ¹³ O tratamento que é acessível em todos os hospitais, públicos ou privados, é a insulinoterapia, que deve ser prescrita com doses pré determinadas, como sugerido abaixo e nas recomendações:
Tabela 1 – Conduta para controle glicêmico nas diversas faixas glicêmicas:
| Tabela 1: Conduta para controle glicêmico nas diversas faixas glicêmicas: | |
|
Glicemia descoberta ao acaso em paciente internado sem insulina |
Ação |
|
Glicemias < 180mg/dL, sem fatores de risco. |
Sem necessidade de acompanhamento |
|
>180 mg/dL ou presença de fatores de risco* (ver rodapé) |
|
| 180 a 200 mg/dL |
|
|
>200 a 250 mg/dL ou uso domiciliar de dose total de insulina diária abaixo de 0,6 UI/kg |
|
|
>250mg/dL, ou história prévia de DM1, LADA, DM secundário à pancreatectomia ou uso domiciliar de dose total de insulina diária acima de 0,6 UI/kg. |
|
|
Hiperglicemia Associada Ao Glicocorticóide (GC) |
|
|
*FATORES DE RISCO: Uso de glicocorticóide, pós-transplante de órgãos, pós-operatório (24-48h), dieta enteral ou parenteral, jejum, uso de soluções glicosadas, SIRS, SEPSE, hipertensão arterial, dislipidemia, obesidade, história prévia de hiperglicemia hospitalar ou diabetes mellitus. |
|
Recomendações
DEFINIÇÃO DE HIPERGLICEMIA HOSPITALAR:
R1. É RECOMENDADO utilizar o critério de HIPERGLICEMIA HOSPITALAR para todo paciente que apresente glicemia capilar ou plasmática acima de 180mg/dL, independentemente da existência prévia de diabetes, por estar associada a maior necessidade de tratamento.
| Classe I | Nível B |
Sumário de evidências:
- Murad MA et al., publicaram em 2012 uma metanálise e revisão sistemática da literatura com objetivo de avaliar impacto de controle glicêmico no desfecho clínico de pacientes não-críticos. Foram incluídos 9 estudos randomizados e 10 observacionais, com metas de glicemias no grupo intensivo variáveis de 80 a < 200 mg/dl, e com glicemias atingidas < 180 mg/dl. Foi observada uma redução significativa no risco relativo de infecção RR= 0,41 (IC 95%- 0,21- 0,77).⁹
- McAlister F et al. em estudo multicêntrico, prospectivo, com 2.471 pacientes hospitalizados por pneumonia comunitária, sendo 44% com DM, descreveu que os pacientes com glicemias na admissão > 198 mg/dl em comparação com aqueles com glicemias mais baixas apresentavam maior mortalidade (13% vs 9%, p= 0,03) e complicações hospitalares 29% vs 22%, p= 0,01.¹⁴
- Bhatti JM et al., avaliaram a associação entre controle glicêmico e desfecho clínico de pacientes hospitalizados com COVID 19 (n=638), sendo observado maior risco de ventilação mecânica com glicemias de admissão acima de 250 mg/dl e maior necessidade de suporte em terapia intensiva com glicemias de admissão acima de 160 mg/dl.¹⁵
- Van den Boom et al., em uma análise retrospectiva de 431.480 cirurgias realizadas na “Duke University Health System” evidenciaram a associação da média das glicemias capilares nos primeiros três dias de pós-operatório com a mortalidade em 30 dias. Para procedimentos cardíacos, houve uma relação em forma de U entre glicemia e mortalidade, variando de 4,5% a 100 mg/dL a um nadir de 1,5% a 140 mg/dL e subindo novamente para 6,9% a 200 mg/dL. Devido ao aumento de complicações quando de glicemias acima de 140mg/dL, este corte tem sido proposto como marcador por alguns autores.¹⁶
- Kosiborod et al., em um estudo retrospectivo de 16.871 casos de infarto agudo do miocárdio de pacientes com ou sem DM, avaliaram as glicemias médias de 24, 48 e 72h, assim como de toda internação, observando aumentos consistentes de mortalidade a cada 10mg/dL acima de 120mg/dL e abaixo de 70mg/dL, sendo estatisticamente significante quando comparados valores de 140-170mg/dL em relação à referência abaixo de 110mg/dL e valores de 110-140mg/dL.¹⁷
- Fong et al., em um estudo retrospectivo de 52107 pacientes internados em unidades de terapia intensiva de 208 hospitais norte-americanos, sendo 15.652 deles com diagnóstico de DM, avaliaram as glicemias médias (GM), episódios de hipoglicemias e variabilidade glicêmica por coeficiente de variação (CV) relacionadas à mortalidade nos grupos com e sem DM. Pacientes sem DM demonstraram uma associação em forma de J de GM e mortalidade, com um risco de mortalidade abaixo da média na faixa de 80-120 mg/dL. Em contraste, os pacientes com DM mostraram uma associação atenuada e desviada para a direita entre a GM e a mortalidade hospitalar, com um risco de mortalidade abaixo da média variando de 90 a 150 mg/dL. A hipoglicemia foi associada ao aumento da mortalidade em ambos os grupos, mas em menor grau nos pacientes com DM. Foi observada associação entre CV e mortalidade hospitalar apenas em pacientes sem DM.¹⁸
Nota importante 1: Hiperglicemia Hospitalar Persistente
- A denominação “ HIPERGLICEMIA HOSPITALAR PERSISTENTE “ deve ser utilizada para todo paciente que apresente 2 ou mais episódios de glicemia capilar ou plasmática acima de 180mg/dL em 24 horas, pois estas taxas estão associadas a piores desfechos clínicos.
- Embora existam relatos de aumento de risco de desfechos desfavoráveis associados a glicemias a partir de 140 mg/dL, muitos destes pacientes não terão hiperglicemia persistente confirmada e as evidências para pacientes não-críticos não são consistentes na faixa entre 140 e 180 mg/dL . Este painel considera, portanto, que o monitoramento nestes casos não é custo-efetivo, já que só há indicação de intervenção acima de 180 mg/dL.
RASTREAMENTO:
QUANDO MEDIR A GLICEMIA NO PACIENTE INTERNADO
R2. É RECOMENDADO rastrear a hiperglicemia hospitalar com um teste de glicemia capilar ou plasmática em todo o paciente adulto ao internar, independentemente do diagnóstico prévio de DM.
| Classe I | Nível C |
Sumário de evidências:
- Abdelmalak et al. conduziram um estudo que avaliou a prevalência de DM não diagnosticado em pacientes submetidos a cirurgia não-cardíaca e encontraram uma prevalência de 10%. Além disso, descobriram que a concentração média de glicemia pré-operatória em pacientes com DM não-diagnosticado foi maior do que em pacientes que sabiam ter DM.¹⁹
- Considerando que, no Brasil, muitas pessoas com DM desconhecem o diagnóstico, é racional rastrear a hiperglicemia em pacientes sem DM conhecido.²⁰
- Umpierrez et al., em um estudo retrospectivo com 2.030 internações consecutivas, demonstraram a ocorrência de hiperglicemia hospitalar em 38% das internações de um hospital geral, sendo que 12% não tinham diagnóstico prévio de DM e em 26% tinham. A mortalidade entre os pacientes com hiperglicemia sem relato de diagnóstico prévio de DM foi maior que a de pacientes com DM, que por sua vez foi maior que de pacientes sem hiperglicemia, respectivamente: 16%, 3% e 1,7% (p<0,01 para ambos), demonstrando além da ocorrência, a maior gravidade destes casos.¹
QUANDO DOSAR A HbA1c NO PACIENTE INTERNADO
R3. É RECOMENDADO solicitar dosagem de HbA1c para todos os pacientes com hiperglicemia hospitalar confirmada ou que também já tenham diagnóstico de DM, desde que não tenha sido realizada nos últimos 3 meses, visando diagnosticar casos desconhecidos de DM, quando esta estiver acima de 6,5%, e auxiliar no processo de alta hospitalar.
| Classe I | Nível B |
Sumário de evidências:
- A dosagem de HbA1c em pacientes hospitalizados permite diagnóstico diferencial entre o DM e a hiperglicemia de estresse. A avaliação do controle glicêmico prévio à internação pode predizer a ocorrência de disglicemia durante a internação, auxiliando na otimização terapêutica.
- Em pacientes hospitalizados com hiperglicemia, o diagnóstico de DM pode ser realizado com a dosagem de HbA1c > ou = a 6,5%, na ausência de interferentes (ver nota importante 5, conforme preconizado no capítulo “Diagnóstico do diabetes e rastreamento do diabetes tipo 2” da Diretriz SBD.²⁰
- Greci et al. avaliaram a utilidade da HbA1c no diagnóstico de novos casos de DM em pacientes hospitalizados com hiperglicemia. A dosagem de HbA1c >6,0% apresentou sensibilidade de 57% e especificidade de 100% no diagnóstico de DM, enquanto que a HbA1c <5,7% excluiu o diagnóstico de DM com sensibilidade de 100% e especificidade de 50%.²¹
- Pasquel et al., avaliaram o papel da HbA1c da admissão em predizer controle glicêmico durante internação em revisão sistemática que compilou dados de quatro estudos controlados e randomizados. Pacientes com níveis de HbA1c elevados apresentaram menor chance de apresentar bom controle glicêmico durante internação do que aqueles com HbA1c ≤7% (HbA1c >7–9%, odds ratio 0,45 [IC 95% 0,22–0,92]; HbA1C >9%, 0,37 [IC 95% 0,17– 0,75]). Pacientes com HbA1c ≤7% necessitaram de menores doses de insulina durante a internação.²²
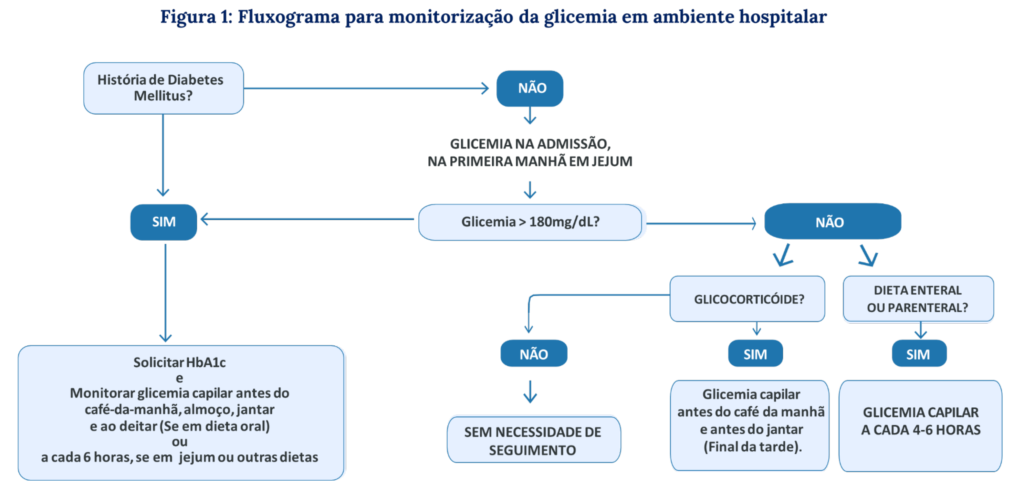
Figura 1: Fluxograma para monitorização da glicemia no hospital
Nota importante 2: Interferentes na dosagem de HbA1c
- A análise laboratorial da HbA1c foi padronizada pelo método de cromatografia líquida de alta eficiência (HPLC), e sua validação necessita ser certificada pelo National Glycohemoglobin Standardization Program (NGSP), estabelecida para a aplicabilidade no estudo Diabetes Control and Complications Trial (DCCT).²³
- Condições que afetam o ciclo de vida das hemácias, como anemias e hemólise, drogas que aumentem a eritropoiese, doença renal crônica, gestação, hemoglobinopatias podem causar discrepâncias entre o valor de HbA1c e a glicemia média estimada.²⁴
- A frutosamina pode ser uma alternativa para avaliação do controle glicêmico prévio ao internamento em pacientes com interferentes para avaliação da HbA1c, entretanto os ensaios não são padronizados, dificultando a estipulação de um valor de corte para diagnóstico.²⁵
MONITORAMENTO DA GLICEMIA NO PACIENTE NÃO-CRÍTICO
R4. É RECOMENDADO o monitoramento com glicemias capilares em todos pacientes com hiperglicemia hospitalar que apresentem glicemias acima de 180 mg/dL.
| Classe I | Nível C |
Sumário de evidências:
- Todos os estudos randomizados utilizaram como base as glicemias em jejum e antes das refeições para titular as doses de insulinas ou ADOs, sendo assim, a aferição da glicemia nestes horários é de extrema importância, apesar da inexistência de estudos que compararam qual a melhor frequência para realizar os testes em pacientes que apresentam hiperglicemia hospitalar.
- A glicemia ao deitar é um parâmetro importante de segurança para evitar hipoglicemias na madrugada daqueles que estão insulinizados, permitindo checar a queda ou ascensão da glicemia no período da madrugada e auxiliar no ajuste de dose da insulina basal.⁷ ⁻ ¹² ⁻ ²⁶ ⁻ ²⁷
- Ribeiro et al., avaliaram o impacto da introdução de um programa institucional de rastreio e monitoramento de glicemias em um hospital privado brasileiro, aumentando o monitoramento de 27,7% para 75,5% dos pacientes internados, aumentando a identificação de hiperglicemias de 9,3 para 12,2% dos pacientes internados e hipoglicemias de 1,5% para 3,3% dos pacientes.²⁸
Nota importante 3: Quando monitorar glicemia no hospital
- O esquema de monitoramento glicêmico deve ser individualizado de acordo com o perfil de cada paciente:
- antes de dietas orais,
- a cada 4-6 horas em dieta contínua,
- às 3h da manhã em caso de risco de hipoglicemia na madrugada,
- em gestantes, 1 hora após as refeições.
- É importante medir a glicemia venosa ou plasmática quando o valor da glicemia capilar estiver acima do limite superior da capacidade de detecção do glicosímetro (Alerta Hi).
- É importante checar a bula do aparelho padronizado no hospital para saber o limite de glicemia aceito por ele. Caso a leitura não seja possível por estar acima do limite, é imprescindível realizar um teste plasmático ou arterial para definir a glicemia real do paciente, fazendo o diagnóstico correto e podendo acompanhar a evolução do tratamento instituído.
Nota importante 4: Glicosímetros para uso hospitalar
- É importante que os hospitais utilizem aparelhos validados para uso hospitalar, com avaliação frequente de sua acurácia, para que os resultados apresentados sejam compatíveis com valores obtidos por glicemia plasmática, sendo assim, os valores de glicemia capilar são equivalentes aos obtidos por glicemia plasmática.
- Estes glicosímetros apresentam integração com a maioria dos sistemas hospitalares, o que garante que os resultados sejam ligados aos respectivos pacientes e registrados em local padronizado, facilitando o controle das glicemias, além de possibilitar uma busca ativa dos casos que não estejam em acompanhamento.
- Com estes dados, é possível rastrear e identificar todo o processo em busca de falhas e aprimoramentos, garantindo que o resultado seja real.
- O uso de glicosímetros de uso domiciliar para este fim exige um grande comprometimento de toda a equipe assistencial, com registro preciso em campos próprios para registro de glicemia capilar nos prontuários, além de comparações frequentes com amostras plasmáticas simultâneas e consideração sobre os interferentes citados na nota importante 5.²⁹
Nota importante 5: Interferentes na glicemia capilar e plasmática
Interferentes pré e pós-analíticos:
|
R5. É RECOMENDADO realizar teste para cetonemia capilar ou cetonúria nas seguintes situações: pacientes que apresentem glicemias acima de 250mg/dL, pacientes com sinais ou sintomas sugestivos de cetoacidose, especialmente que estejam em uso de inibidores de SGLT2, mesmo com glicemia normal.
| Classe I | Nível C |
Sumário de evidências:
- A dosagem de cetonemia capilar é um método acurado e rápido para detecção de corpos cetônicos séricos. O teste para detecção de cetonas em sangue capilar tem uma sensibilidade de 98% e uma especificidade de 79%, em comparação com o teste de urinálise de cetona, que tem uma sensibilidade de 98% e especificidade de 35%.³⁰
- Uma revisão sistemática com 5 estudos, somando 2019 pacientes, identificou maior acurácia com a pesquisa de beta-hidroxibutirato no sangue capilar do que com a dosagem de cetonúria para diagnóstico de cetoacidose diabética.³¹
- Cetoacidose euglicêmica é complicação potencial nos pacientes em uso de inibidores de SGLT2. No ambiente hospitalar a cetoacidose euglicêmica é sub diagnosticada.³²
- No Canadá e Reino Unido (mais de 350.000 pacientes e 500 eventos de cetoacidose euglicêmica), inibidores de SGLT2 foram associados a risco maior de cetoacidose em relação ao inibidores da DPP-4 (incidência 2,03 vs 0,75 para cada 1000 pacientes-ano, [RR 2,85 (IC 95% 1,99 a 4,08)].³³
R6. Em pacientes em uso de glicocorticóide, independentemente do diagnóstico prévio de DM, É RECOMENDADO realizar glicemias capilares ao acordar e antes do jantar.
| Classe I | Nível C |
Sumário de evidências:
- Toyoshima et al., em um estudo piloto observacional, acompanharam prospectivamente, com sensores de monitorização contínua de glicose (CGM), 15 pacientes que seriam submetidos a transplante de células tronco hematopoiéticas em uso de dexametasona ou prednisona, encontrando hiperglicemia em 60% da amostra, com pico de glicemia entre as 14:00 e 19:00h.³⁴
- Donihi et al., em um estudo retrospectivo, com 50 pacientes que receberam o equivalente a 40mg de prednisona ao dia, encontraram hiperglicemia em 64% do total de pacientes, sendo 52% nos pacientes sem DM prévio.³⁵
- Le et al., em um estudo observacional retrospectivo com 517 pacientes admitidos com COVID-19 severa, encontraram 65% de incidência de hiperglicemia hospitalar, o que ocorreu especialmente em pacientes em insuficiência respiratória e em uso de glicocorticóides, semelhante a outras publicações.³⁶
TRATAMENTO:
METAS DE CONTROLE GLICÊMICO NO PACIENTE COM HH NÃO-CRÍTICO
R7. Em pacientes com HH não-críticos com ou sem DM, É RECOMENDADO utilizar a meta de controle glicêmico entre 100 a 180 mg/dL, visando evitar hiper e hipoglicemias.
| Classe I | Nível B |
Sumário de evidências:
- Murad et al. publicaram em 2012 uma metanálise com revisão sistemática da literatura com objetivo de avaliar impacto de controle glicêmico no desfecho clínico de pacientes não críticos. Foram incluídos 9 estudos randomizados e 10 observacionais, com metas de glicemias no grupo intensivo variáveis de 80 a < 200 mg/dl, com glicemias < 180 mg/dl. Foi observada redução significativa no risco relativo de infecção RR= 0,41 (IC 95%- 0,21- 0,77)⁹
- McAlister et al. em estudo multicêntrico, prospectivo, com 2471 pacientes hospitalizados por pneumonia comunitária, sendo 44% com DM, descreveu que os pacientes com glicemias na admissão > 198 mg/dl em comparação com aqueles com glicemias mais baixas apresentavam maior mortalidade (13% vs 9%, p= 0,03) e complicações hospitalares 29% vs 22%, p= 0,01.¹⁴
- Fong et al. em um estudo retrospectivo de 52107 pacientes internados em unidades de terapia intensiva de 208 hospitais norte-americanos, sendo 15652 deles com diagnóstico de DM, avaliaram as glicemias médias (GM), hipoglicemias e variabilidade glicêmica por coeficiente de variação (CV) relacionadas à mortalidade nos grupos com e sem DM. Pacientes sem DM demonstraram uma associação em forma de J de GM e mortalidade, com um risco de mortalidade abaixo da média na faixa de 80-120 mg/dL. Em contraste, os pacientes com DM mostraram uma associação atenuada e desviada para a direita entre a GM e a mortalidade hospitalar, com um risco de mortalidade abaixo da média variando de 90 a 150 mg/dL. A hipoglicemia foi associada ao aumento da mortalidade em ambos os grupos, mas em menor grau nos pacientes com DM. A glicemia média > 180 mg/dl esteve associada a um risco relativo (RR) de mortalidade de 4,20 (4,07- 4,33) em pacientes sem DM e 1,14 (1,08- 1,20) em pacientes com DM, tendo como referência a GM de 100 mg/dl e ajustado por demais fatores de risco. Foi observada associação entre CV e mortalidade hospitalar apenas em pacientes sem DM.¹⁸
- Bhatti JM et al., avaliaram a associação entre controle glicêmico e desfecho clínico de pacientes hospitalizados com COVID 19 (n=638), sendo observado maior risco de ventilação mecânica com glicemias de admissão acima de 250 mg/dl e maior necessidade de suporte em terapia intensiva com glicemias de admissão acima de 160 mg/dl.¹⁵
- Kosiborod et al., em um estudo retrospectivo de 16.871 casos de infarto agudo do miocárdio de pacientes com ou sem DM, avaliaram as glicemias médias de 24, 48 e 72h, assim como de toda internação, observando aumentos consistentes de mortalidade a cada 10 mg/dL abaixo de 70mg/dL, sendo importante evitar estes níveis em pacientes hiperglicêmicos.¹⁷
- O estudo clínico randomizado SHINE incluiu 1151 pacientes com acidente vascular cerebral agudo e descreveu ausência de benefícios nos desfechos funcionais com controle glicêmico intensivo (metas glicemia 80-130 mg/dl) em comparação com controle glicêmico padrão (metas de glicemias 80- 179 mg/dl).³⁷
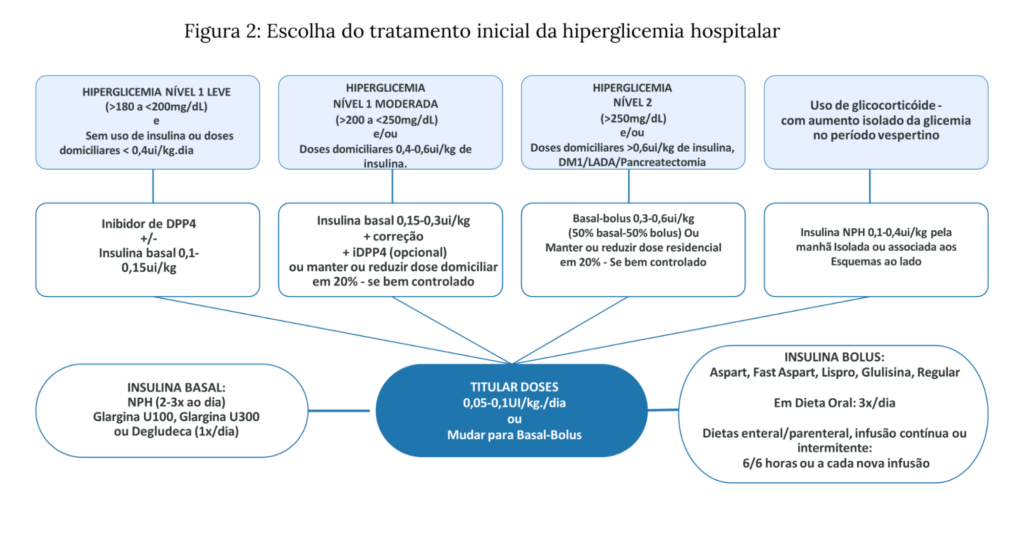
TRATAMENTO DA HIPERGLICEMIA HOSPITALAR
R8. É RECOMENDADO o uso de insulina basal, se necessário associada a bolus pré-prandiais para o tratamento de hiperglicemia persistente em pacientes hospitalizados não-críticos, por estar relacionado ao melhor controle glicêmico, redução de desfechos desfavoráveis e do tempo de internação.
| Classe I | Nível A |
Nota importante 6: Esquemas de insulinoterapia no hospital
- A insulinoterapia no hospital pode ser administrada apenas como insulina basal, insulina basal com uma dose de bolus pré-prandial (basal-plus) ou insulina basal-bolus, sempre com tabela de correção de acordo com a glicemia pré-prandial.
Sumário de evidências:
Escalas de correção
- Todos os estudos realizados comparando o esquema em escala de correção com outros esquemas mostraram inferioridade e ineficácia deste em controlar a hiperglicemia. Portanto, quando pacientes internados apresentarem mais de duas glicemias acima de 180mg/dL em 24 horas, qualquer hiperglicemia acima de 250mg/dL ou já utilizam insulina em regime domiciliar, uma forma de tratamento efetivo da hiperglicemia deve ser implementada, o que contraindica utilizar a escala de correção isoladamente. A escala de correção deve ser padronizada pela instituição e ajustada para que não ocorra hipercorreção e seja eficaz em baixar a glicemia.
Basal associado à correção
- Umpierrez et al. realizaram um estudo multicêntrico randomizado, com 375 pacientes divididos em três grupos: basal-bolus, basal associado à escala de correção (chamado no estudo de basal-plus) e apenas escala de correção. A seleção de pacientes contou com pacientes internados, com diagnóstico de DM tipo 2, em uso de medicamentos orais ou insulina até a dose de 0,4 UI/kg.dia. Os grupos basal-bolus e basal-plus obtiveram resultados semelhantes, com menos hiperglicemia e médias glicêmicas mais baixas que o grupo de escala de correção, sem aumento de hipoglicemias mais graves, entretanto, ambos apresentaram aumento de hipoglicemias leves em relação à escala de correção.³⁸
- Pasquel et al. avaliaram um grupo de 279 pacientes com DM tipo 2 internados, usuários de medicamentos orais ou insulina até a dose total de 0,6 UI/kg.dia e glicemias abaixo de 400mg/dL, em um estudo multicêntrico e randomizado, comparando um grupo de insulina basal associada à sitagliptina com um grupo em insulinoterapia basal-bolus. Os desfechos foram não inferiores em Médias glicêmicas diárias (171 +- 48,6mg/dL vs 169,2 +- 48,6mg/dL), Hipoglicemias (9% vs 12%) e Falência de tratamento (16% vs 19%) grupo Sitagliptina + Basal vs. Basal-bolus respectivamente.²⁶
Basal Bolus
- Umpierrez et al. compararam em um estudo multicêntrico a segurança e eficácia do esquema basal-bolus com glargina uma vez ao dia e glulisina antes das refeições com o esquema em escalonamento de doses em 213 pacientes com diabetes tipo 2 submetidos à cirurgia. A glicemia média após o primeiro dia de regime basal-bolus foi 145±32 mg/dL e no grupo de escalonamento de doses 172±47 mg/dL (p<0,01). Valores de glicemia abaixo de 140 mg/dL ocorreram em 55% dos pacientes no grupo basal-bolus e apenas 31% dos pacientes no grupo de escalonamento de doses (p<0,001). Houve redução de 64,6% no desfecho composto de mortalidade, infecção de sítio cirúrgico, pneumonia e falência renal aguda) no grupo com esquema basal-bolus, principalmente pela redução de infecção de sítio cirúrgico e de falência renal aguda.⁷
- Umpierrez et al. em um estudo multicêntrico com 130 pacientes com DM tipo 2 internados, não cirúrgicos, não usuários de insulina, compararam a segurança e eficácia do esquema basal-bolus com glargina uma vez ao dia e glulisina antes das refeições com o esquema em escalonamento de doses. O grupo basal-bolus atingiu médias glicêmicas 27mg/dL menores, sem aumento de hipoglicemias. No grupo de escalonamento de doses, apesar de as doses serem crescentes, 14% dos pacientes permaneceram com glicemias acima de 240mg/dL.¹²
- Christensen MB et al., realizaram revisão sistemática e metanálise para avaliar segurança e eficácia de esquema basal-bolus em pacientes internados com DM 2. Cinco ensaios clínicos e sete estudos observacionais foram incluídos. As metanálises demonstraram glicemia média diária 14 a 29 mg/dL menor com uso de esquema basal-bolus, comparado ao uso de escalonamento de doses. O risco de hipoglicemia foi maior no grupo em uso de esquema basal-bolus, comparado com escalonamento de doses (glicemia ≤ 70 mg/dL, RR 5,75; IC95% 2,79-11,83), (glicemia ≤ 60 mg/dL, RR 4,21; IC95% CI 1,61-11,02). Não houve diferença nas taxas de hipoglicemia abaixo de 40 mg/dL entre os grupos.¹³
- Umpierrez et al., em seu estudo de comparação entre o esquema de insulinoterapia basal-bolus e o basal-plus, substituíram o esquema basal-plus pelo basal-bolus quando a média diária das glicemias ou duas glicemias consecutivas fossem maiores que 240mg/dL.³⁸
- Não existem estudos que avaliem a transição de esquemas de insulinização, entretanto, quando o método utilizado não for efetivo, recomenda-se utilizar um esquema mais efetivo, que no caso seria o basal-correção.
- Nenhum dos estudos acima randomizou pacientes com doses de insulina acima de 0,6 UI/kg.dia para braços que não utilizassem terapia basal-bolus.
Tabela 2 – Escolha do esquema de insulinização no hospital para pacientes com HH não-críticos
| Tabela 2 - Escolha do esquema de insulinização no hospital para pacientes com HH não-críticos | |||
| Esquema | Indicação | Grau de recomendação e nível de evidência | |
|
Escala de correção (Apenas insulina rápida pré prandial) |
|
IIb | B |
|
Basal com correção (Insulina basal + escala de correção) |
|
IIa | B |
|
Basal-bolus (insulina basal + Insulina bolus em múltiplas doses) |
|
I | B |
Tabela 3 – Cálculo de doses iniciais de insulina no paciente internado:
| Tabela 3: Cálculo da dose de insulina esquema Basal-Bolus |
Insulina Basal:
Tipos de Insulinas Basal:
Bolus de Insulina:
Tipos Insulinas para Bolus:
|
Tabela 4 – Sugestão de escala de correção de glicemias
| Tabela 4: Escala de correção de glicemias | |||
| Glicemia Capilar | Paciente sensível¹ | Paciente Usual² | Paciente Resistente³ |
| 181-230 mg/dL | Aumentar 1UI | Aumentar 2UI | Aumentar 4UI |
| 231-280 mg/dL | Aumentar 2UI | Aumentar 3UI | Aumentar 6UI |
| 281-330 mg/dL | Aumentar 3UI | Aumentar 4UI | Aumentar 8UI |
| 331-390 mg/dL | Aumentar 4UI | Aumentar 5UI | Aumentar 10UI |
| >390 mg/dL | Aumentar 6UI | Aumentar 8UI | Aumentar 12UI |
|
(1) Idosos, índice de massa corporal (IMC)< 19kg/m², frágeis e/ou com insuficiência renal, hepática ou cardíaca. (2) IMC de 19 a 33kg/m², sem sinais de resistência insulínica ou uso de glicocorticoide. (3) Pacientes com IMC acima de 33kg/m², com sinais de resistência insulínica, em uso de glicocorticoide ou glicemias persistentemente aumentadas. |
|||
Figura 2: Escolha do tratamento inicial da hiperglicemia hospitalar
Nota Importante 7: Insulina em dieta enteral e parenteral
- A prescrição de insulina basal pode ser feita com insulina análoga 1 vez ao dia, ou insulina NPH duas a três vezes ao dia, correspondendo a 50-80% da dose diária.
- A insulina bolus associada a correção pode ser feita a cada 4-6 horas com análogos de ação rápida ou a cada 6 horas com insulina regular, correspondendo a 20-50% da dose total diária.
- No caso de dieta enteral, deve-se levar em conta se a dieta é contínua ou intermitente e coordenar a administração de insulina de ação rápida com os períodos alimentares, além de dar preferência para dietas com menor índice glicêmico.
- É importante ficar atento à interrupção dessas dietas e sempre que fizer uso de insulina basal por via subcutânea, ao interromper a dieta, instituir glicose por via endovenosa a fim de minimizar o risco de hipoglicemia.³⁹
R9. PODE SER CONSIDERADO o uso de insulina NPH em dose única diária pela manhã para o tratamento da hiperglicemia secundária ao uso de glicocorticoide, em pacientes com predomínio de hiperglicemia vespertina, iniciando-se em 0,1 UI/kg.dia, de forma isolada ou associada às outras formas de insulinização ou medicamentos orais.
| Classe IIb | Nível B |
Sumário de evidências:
- Brooks et al., em uma revisão sistemática, demonstraram que a associação de insulina de ação intermediária (insulina NPH) ao esquema hipoglicemiante convencional se mostrou segura e eficaz no controle da glicemia secundária ao uso de glicocorticoide em ambiente hospitalar.⁴⁰
- Khowaja et al. realizaram estudo randomizado (n=61) mostrando que a adição de insulina NPH pela manhã ao esquema prévio de insulinização apresentou menor média de glicemia diária, além de menores valores de glicemia em jejum e pré refeição em pacientes com DM em uso de glicocorticoide durante hospitalização.⁴¹
- Grommesh et al., em um estudo piloto, randomizado, com 61 pacientes utilizando insulina NPH aplicada no momento do recebimento do glicocorticoide, mostrou superioridade no controle glicêmico para o esquema de associação da insulina NPH com esquema basal bolus quando comparado à insulinização basal de longa duração ou basal-bolus isoladas.⁴²
Nota Importante 8: Hiperglicemia secundária ao uso de glicocorticóide
- Na maioria dos casos, a hiperglicemia secundária ao glicocorticóide ocorre com maior intensidade no período vespertino, com glicemias mais baixas pela manhã, fazendo uma curva de hiperglicemia semelhante à curva farmacocinética da insulina NPH.³⁴
- Um esquema sugerido de ajuste de insulina conforme potência do glicocorticóide é iniciar insulina NPH na dose de 0,1UI/kg. A dose equivalente do glicocorticoide de 10mg de prednisona tem aumentos de 0,1UI/Kg a cada incremento de 10mg. Sendo 0,2UI/Kg para doses equivalentes de 20mg de prednisona, 0,3UI/Kg para 30mg e 0,4UI/kg.dia para doses superiores a 40mg.⁴³ ⁻ ⁴⁴
- A dose da insulina deve ser titulada com base na glicemia da manhã, em jejum, e nas pré prandiais, principalmente antes do jantar, com aumentos de 10-20% da dose total ou 0,1UI/kg.dia, conforme grau de hiperglicemia, sendo possível realizar os ajustes 24 horas após a aplicação da dose ajustada.
- Considerando as diferenças farmacocinéticas dos diferentes glicocorticoides, além de diferenças interpessoais, podem ocorrer diferentes padrões de alteração de glicemia nos pacientes, sendo necessários diferentes esquemas de insulinização. O uso da insulina NPH na forma sugerida acima aplica-se aos pacientes que apresentam hiperglicemia predominante ou exclusivamente no período vespertino.⁴⁵
Ajuste da insulinoterapia:
R10. É RECOMENDADO o intervalo de ajuste da insulinoterapia a cada 24 a 48 horas, de acordo com monitorização de glicemia situação da dieta e posologia de medicamentos com efeitos hiperglicemiantes.
| Classe I | Nível C |
Sumário de evidências:
- Magaji e Johnston, em um artigo de revisão narrativa e de opinião de especialista, sugerem que os ajustes de insulinoterapia sejam realizados a cada 24 a 48 horas.⁴⁶
- O grupo de pesquisa da Emory University, Atlanta, EUA, em seus estudos RABBIT-2¹², DEAN⁴⁷ e Basal-Plus³⁸, realizou ajustes da insulinoterapia a cada 24 horas. Da mesma forma, os estudos com análogos de insulina de ação ultralonga (glargina U300 e degludeca) em ambiente hospitalar, propunham ajustes de doses que foram realizados a cada 24 horas. ⁴⁸ ⁻ ⁴⁹
Nota Importante 9: Ajustes de doses de insulina em pacientes com HH não-críticos hospitalizados
- As doses de insulina podem ser ajustadas frequentemente ao longo da internação do paciente, dependendo dos resultados das glicemias capilares, medicamentos em uso e de sua ingestão calórica.⁴⁶
- No seguimento do paciente ao longo da internação, a titulação da DTD de insulina no esquema basal-bolus, ou seja, aumento ou redução de dose de insulina no seguimento, pode ser realizada de duas maneiras: ⁷ ⁻ ⁵⁰ ⁻ ⁵¹
- Em valores percentuais da DTD de insulina (10 a 20%).
- De acordo com a DTD de insulina por kg de peso do paciente (aproximadamente 0,05-0,1 UI/kg.dia).
R11. É RECOMENDADO que, em um esquema basal-bolus, o ajuste da dose total diária de insulina seja realizado de acordo com a média glicêmica ou valores das glicemias de jejum e pré-refeições.
| Classe I | Nível B |
Sumário de evidências:
- Magaji e Johnston publicaram um artigo de revisão e de opinião de especialista, sugerindo que a glicemia de jejum é o melhor indicador da adequação da dose basal de insulina com insulina glargina U100 pela manhã. As demais glicemias ao longo do dia refletem a adequação das doses de insulinas de ação rápida em bolus às refeições. As glicemias antes do almoço refletem a adequação da dose do café da manhã, a glicemia antes do jantar reflete a dose de insulina na hora do almoço e a glicemia na hora de dormir reflete a dose de insulina de ação rápida na hora do jantar.⁴⁶
- Zhang et al. também utilizaram em um estudo clínico randomizado, ajuste da dose de insulina glargina U100, de acordo com a glicemia de jejum.⁵⁰
- Umpierrez et al. no estudo DEAN, um ensaio clínico randomizado (2009), recomendaram aumento diário das doses de insulina basal (detemir e NPH) caso as glicemias de jejum e pré-jantar estivessem maiores do que 140mg/dL. Se as glicemias de jejum e pré-jantar estivessem abaixo de 100mg/dL, as doses de insulina basal eram reduzidas.⁴⁷
- O grupo do Dr. Umpierrez (Emory University, Atlanta, EUA), em seus estudos RABBIT-2 e Basal-Plus, ensaios clínicos randomizados que compararam os esquemas de insulinoterapia em escala de correção, basal-bolus ou basal-plus, com uso de insulina glargina U100 ou NPH utilizada como basal, realizou ajustes da insulinoterapia de acordo com a média glicêmica desde a última avaliação.¹² ⁻ ³⁸
- Pasquel et al., em um estudo prospectivo randomizado que comparou o uso das insulinas glargina U300 e glargina U100 em ambiente hospitalar, ajustaram as doses de insulina diariamente, de acordo com as glicemias de jejum e pré-jantar.⁴⁸
- Galindo et al. (2022), em um estudo prospectivo randomizado que comparou o uso das insulinas degludeca e glargina U100 em ambiente hospitalar, ajustaram as doses de insulina diariamente, de acordo com a glicemia de jejum e glicemias antes das refeições.⁴⁹
R12. É RECOMENDADO adotar um padrão de ajuste para doses de insulina, que pode ser igualmente efetivo em valores percentuais da dose total diária (DTD) de insulina (em 10-20% ao dia) ou de acordo com a DTD de insulina por peso do paciente (em 0,05-0,1 UI/kg.dia).
| Classe I | Nível B |
Sumário de evidências:
- Umpierrez et al. (2007), no estudo clínico randomizado RABBIT-2, que comparou o esquema de insulinoterapia basal-bolus e o de escalas de correção, propôs um protocolo de ajuste de insulina, aumentando diariamente a dose de insulina basal (glargina U100) em 20% caso a média glicêmica fosse maior que 140mg/dL e reduzindo-se em 20%, caso ocorresse hipoglicemia (<70mg/dL). A dose de correção da hiperglicemia pré-prandial era baseada em uma tabela com três colunas (insulinossensível, usual e insulinorresistente), as quais poderiam ser alteradas para um perfil mais sensível ou resistente, de acordo com a decisão do médico pesquisador.¹²
- Umpierrez et al. (2009), em seu estudo clínico randomizado que comparou o esquema de insulinoterapia basal-bolus utilizando análogos de insulina (detemir e asparte) versus insulinas humanas (NPH e regular), propuseram protocolo de ajuste de insulina aumentando diariamente as doses de insulina basal (detemir e NPH) em 10% caso as glicemias de jejum e pré-jantar estivessem entre 140 a 180mg/dL e em 20%, caso as glicemias de jejum e pré-jantar fossem maiores que 180mg/dL. Se as glicemias de jejum e pré-jantar estivessem entre 70 e 99mg/dL, as doses de insulina basal eram reduzidas em 10% e se alguma glicemia fosse <60mg/dL, estas doses eram reduzidas em 20%. A dose de correção da hiperglicemia pré-prandial era baseada em uma tabela com três colunas (insulinossensível, usual e insulinorresistente), cujas colunas poderiam ser alteradas, de acordo com a decisão do médico pesquisador.⁴⁷
- Umpierrez et al. (2013), em seu estudo clínico randomizado que comparou o esquema de insulinoterapia basal-bolus e o basal-plus, realizaram o protocolo de ajuste de insulina, aumentando-se diariamente a DTD de insulina em 10%, caso as glicemias de jejum e pré-jantar estivessem entre 140 a 180mg/dL e em 20%, caso as glicemias de jejum e pré-jantar fossem maior que 180mg/dL. Se as glicemias de jejum e pré-jantar estivessem entre 70 e 99mg/dL, a DTD de insulina era reduzida em 10% e se alguma destas glicemias fossem <70mg/dL, a DTD de insulina era reduzida em 20%. A dose de correção da hiperglicemia pré-prandial era baseada em uma tabela com duas colunas, uma de perfil mais insulinossensível e outra de perfil usual, cujas colunas poderiam ser alteradas, de acordo com a decisão do médico pesquisador.³⁸
- Pasquel et al. (2020), em um estudo clínico randomizado que comparou o uso dos análogos de insulina glargina U300 e glargina U100 em ambiente hospitalar, ajustaram as doses diariamente para manter as glicemias de jejum e pré-jantar entre 100 e 140mg/dL. A DTD de insulina era aumentada em 10%, se as glicemias estivessem entre 140 e 180mg/dL; em 20%, entre 180 e 240mg/dL; e em 30%, se maiores que 240mg/dL.⁴⁸
- Galindo et al. (2022), em um ensaio clínico randomizado que comparou o uso de análogos de insulina degludeca e glargina U100 em ambiente hospitalar, ajustaram as doses de insulina diariamente para manter a glicemia de jejum menor que 140mg/dL, glicemias antes das refeições menores que 180mg/dL e evitando-se hipoglicemias <70mg/dL.⁴⁹
- Zhang et al. (2020), em um ensaio clínico randomizado realizado na China, compararam os ajustes de doses de insulina realizados em valores absolutos de DTD de insulina com aqueles de acordo com a DTD de insulina por peso do paciente (em UI/kg). Ambos os algoritmos se mostraram igualmente efetivos e seguros em pacientes com DM tipo 2 em ambiente hospitalar. No grupo com ajustes de doses baseadas por peso, a dose de glargina U100 era titulada a cada 0,1UI/kg.dia, se a glicemia de jejum fosse maior que 140mg/dL, e a dose total diária de asparte também era titulada a cada 0,1UI/kg.dia se a glicemia 2h após as refeições fosse maior que 180mg/dL. Para os protocolos cujos ajustes de doses eram realizados em valores absolutos, foram utilizados protocolos modificados por Riddle et al. (2003)⁵², no caso de análogo de insulina basal (glargina U100), e por Trence et al. (2003)⁵³, no caso da análogo de insulina bolus prandial (asparte).⁵⁰
- Li et al., que fazem parte do mesmo grupo acima, já havia comparado, num ensaio clínico randomizado e controlado em 2014, os ajustes de glargina U100 em valores absolutos de DTD de insulina com aqueles de acordo com a DTD de insulina por peso do paciente (em UI/kg), mostrando que ambos os protocolos eram igualmente efetivos e seguros.⁵¹
PACIENTES COM BAIXA ACEITAÇÃO ORAL
R13. DEVE SER CONSIDERADO suspender as doses fixas de bolus de insulina nos pacientes com baixa aceitação de dieta oral.
| Classe IIa | Nível C |
Sumário de evidências:
- Magaji e Johnston (2011) em um artigo de revisão narrativa e de opinião de especialista, recomendam que a insulina em bolus (prandial) deve ser suspensa se o paciente não estiver se alimentando.⁴⁶
- Galindo et al. (2022), em um estudo clínico randomizado que comparou o uso das insulinas degludeca e glargina U100 em ambiente hospitalar, recomendavam a pausa da insulina prandial em pacientes com baixa ingestão alimentar ou em jejum.⁴⁹
AGENTES ANTIDIABÉTICOS ORAIS EM PACIENTES INTERNADOS NÃO-CRÍTICOS
Secretagogos:
R14. Medicamentos secretagogos de insulina (sulfonilureias e glinidas) NÃO SÃO RECOMENDADOS durante a internação hospitalar, devido ao risco de hipoglicemias.
| Classe III | Nível C |
Sumário de evidências:
- Rajendran et al. avaliaram, no Reino Unido, em estudo caso-controle, pacientes internados que utilizaram sulfonilureias e tiveram ou não hipoglicemias. Foi identificada episódios de hipoglicemia em 19% dos pacientes, com maior risco naqueles acima de 65 anos, em uso de insulina concomitante ou com TFG abaixo de 30mL/min.1,73m2. Avaliando todos os episódios, o uso de sulfoniluréia foi o responsável por mais de 30% dos episódios de hipoglicemia, ou seja, mais comum do que hipoglicemia por uso de insulina quando avaliadas as primeiras horas da manhã.⁵⁴
Metformina
R15. O uso da metformina para auxiliar no controle glicêmico de pacientes internados, utilizando altas doses de insulina, PODE SER CONSIDERADO quando o quadro agudo estiver resolvido, o paciente estiver estável, a TFG estiver acima de 30ml/min/1.73m² e não houver programação de realização de exames contrastados.
| Classe IIb | Nível C |
Sumário de evidências:
- No estudo de Bano et al., com 1800 pacientes, 387 usaram metformina até a noite anterior à revascularização miocárdica; não houve diferença na incidência de acidose láctica entre usuários deste fármaco, não usuários e pacientes sem DM.⁵⁵
- Salpeter et al., em uma metanálise da Cochrane com 357 ensaios clínicos e estudos de coorte, o que incluiu 70.490 pacientes-ano no grupo metformina e 55.451 pacientes-ano no grupo não usando metformina, a incidência verdadeira de acidose lática por 100.000 pacientes-ano foi de 4,3 casos no grupo metformina e 5,4 casos no grupo não usando metformina. Estes dados, no entanto, não se referem a pacientes internados.⁵⁶
- Ma et al., em uma revisão sistemática com metanálise de estudos observacionais sobre o uso da metformina em pacientes com COVID-19, encontraram uma redução do risco de óbito para pacientes em uso prévio da metformina, mas neutro para aqueles que iniciaram durante a internação.⁵⁷
INIBIDORES DE DPP-4
R16. O uso de inibidores da DPP4 PODE SER CONSIDERADO em pacientes não-críticos que apresentem hiperglicemia leve (180-200mg/dL), desde que ajustados para a função renal, quando recomendado.
| Classe IIb | Nível A |
Sumário de evidências:
- Vellanki et al. avaliaram o uso de Linagliptina em um estudo clínico randomizado de 250 pacientes cirúrgicos, comparados a pacientes em terapia basal-bolus, mostrando eficácia semelhante nos pacientes que apresentavam glicemias inferiores a 200mg/dL, com redução de 86% nos eventos de hipoglicemia.⁵⁸
- Umpierrez et al., em um estudo randomizado, com 90 participantes apresentando bom controle prévio da glicemia, foram divididos em 3 grupos: Sitagliptina isolada, Sitagliptina associada a basal e basal-bolus. Os níveis de hipo e hiperglicemia foram semelhantes, com a vantagem de menor uso de insulina nos grupos de sitagliptina.⁵⁹
- Pasquel et al. avaliaram um grupo de 279 pacientes com DM tipo 2 internados, usuários de medicamentos orais ou insulina até a dose total de 0,6 UI/kg.dia e glicemias abaixo de 400mg/dL, em um estudo multicêntrico e randomizado, comparando um grupo de insulina basal associada à sitagliptina contra um grupo em insulinoterapia basal-bolus. Os desfechos foram não inferiores em médias glicêmicas diárias (171 ± 48,6mg/dL vs 169,2 ± 48,6mg/dL), hipoglicemias (9% vs 12%) e falência de tratamento (16% vs 19%) grupo sitagliptina + basal vs. basal-bolus respectivamente.²⁶
- Gracia-Ramos et al., em um estudo prospectivo randomizado e aberto, avaliaram 76 pacientes com DM2 internados, com glicemia de admissão abaixo de 400mg/dL e doses residenciais de insulina abaixo de 0,5UI/kg. Estes pacientes foram divididos em 2 grupos: Basal associado a correções (BP) e Basal associado a correções e sitagliptina (s-BP). O grupo s-BP apresentou menor média diária de glicemia (158,8 vs 175,0 mg/dL, P = 0,014), maior porcentagem de leituras dentro de uma faixa de glicemia de 70-180 mg/dL (75,9% vs 64,7%, P < 0,001) e um número menor de leituras de glicemia >180 mg/dL (P < 0,001). O grupo s-BP resultou em menos doses de insulina basal e suplementar (P= 0,024 e P = 0,017, respectivamente) e injeções diárias de insulina mais baixas (P = 0,023) do que aquelas com insulina isoladamente. A proporção de pacientes com hipoglicemia foi semelhante nos dois grupos.⁶⁰
- Rabizadeh et al., em uma metanálise de quatro estudos randomizados (n=658), comparando inibidores da DPP4 isoladamente ou associados à insulina basal versus terapia basal-bolus, evidenciaram que não houve diferença no nível médio diário de glicemia entre os dois grupos (MD 4,63; IC 95% = – 1,57, 10,83; p = 0,14) (I2 = 14%, p = 0,32). A dose total de insulina por dia foi menor em pacientes que receberam inibidores da DPP4 (MD – 14,27; IC95%= – 22,47, – 6,07; p = 0,001) (I2 = 92%, p = 0,001), assim como o número de injeções de insulina (MD – 0,79; IC95% = – 1,01, – 0,57; p = 0,001) (I2 = 0%, p = 0,68). A taxa de hipoglicemia não foi diferente entre os grupos (RR 0,60, IC95% = 0,34, 1,074; p = 0,08) (I2 = 37,3%, p = 0,18), nem a falha ao tratamento. (RR 0,87, IC95% = 0,64, 4,8; p = 0,38) (I2 = 49%, p = 0,11).⁶¹
- Exceção ao uso de inibidores da DPP4 deve ser feita ao uso da saxagliptina, que esteve relacionada ao aumento de internações por insuficiência cardíaca no estudo SAVOR.³⁶
INIBIDORES DO SGLT2 (iSGLT2)
R17. PODE SER CONSIDERADA a manutenção do uso dos iSGLT2 em pacientes internados não-críticos com DM tipo 2, principalmente em casos com insuficiência cardíaca.
| Classe IIb | Nível B |
R18. Em pacientes internados que estejam em uso de iSGLT2, É RECOMENDADO a monitorização de cetonas, preferencialmente de cetonemia capilar ou, em sua ausência, de cetonúria, devendo o mesmo ser suspenso em caso de cetonemia > 1,5 mmol/L ou cetonúria positiva, para reduzir o risco de cetoacidose diabética.
| Classe I | Nível C |
Sumário de evidências:
- Singh et al. em uma análise retrospectiva, avaliaram 5936 internações de pacientes com DM2 que mantiveram o uso de iSGLT2 durante a internação e de 30569 que tiveram o uso suspenso. Após ajustes por gravidade, idade, sexo, IMC, etnia, uso de insulina e procedimentos cirúrgicos, o grupo que manteve o uso apresentou um risco de mortalidade 45% menor (RR 0.55, 95% IC 0.42–0.73, P < 0.01), sem aumento de insuficiência renal aguda e com discreta redução no tempo de estadia hospitalar 4,9 versus 4,7 dias (RR 0.95, 95% CI 0.93-0.98, p<0.01).⁶²
- Thiruvenkatarajan et al., em uma revisão sistemática para episódios de cetoacidose diabética, tanto euglicêmica como hiperglicêmica em perioperatórios de pacientes em uso de inibidores de SGLT2, demonstrou que o maior fator de risco para esta complicação foi a modificação da dieta, especialmente a redução do aporte de carboidratos. Portanto, pacientes em uso de inibidores de SGLT2, em internação, devem ser acompanhados clinicamente para a possibilidade de cetoacidose euglicêmica e devem ser monitorizados com cetonemia caso apresentem sintomas típicos mesmo na ausência de importante hiperglicemia, com atenção especial ao aporte calórico.⁶³
- Kosiborod et al., no estudo clínico multicêntrico randomizado DARE-19, avaliaram a eficácia da Dapagliflozina contra placebo em 1250 pacientes hiperglicêmicos internados com COVID-19. A ocorrência de disfunções orgânicas ou morte não foram estatisticamente significantes entre os os grupos tratamento com Dapagliflozina ou placebo. Cetoacidose ocorreu em 0,32% no grupo tratado e 0% no grupo placebo, sem significância estatística.⁶⁴
- Voors et al., dentro do estudo clínico EMPULSE, avaliaram o uso de Empagliflozina em 530 pacientes internados com insuficiência cardíaca, independentemente da ocorrência de hiperglicemia. O desfecho primário do estudo foi o benefício clínico (morte por qualquer causa, número de eventos de insuficiência cardíaca, tempo até o primeiro evento de insuficiência cardíaca, ou uma diferença de 5 pontos ou mais na mudança em relação ao valor basal de escore de sintomas). Mais pacientes tratados com Empagliflozina tiveram benefício clínico em comparação com placebo. Entretanto, a Empagliflozina foi iniciada apenas após estabilidade clínica, não em fase aguda.⁶⁵
- Biegus et al., também dentro do estudo clínico EMPULSE, avaliaram o uso de Empagliflozina em 530 pacientes internados com insuficiência cardíaca, após estabilização clínica inicial, independentemente de hiperglicemia. O estudo mostrou que em comparação com o placebo, os pacientes tratados com empagliflozina demonstraram reduções maiores em todos os marcadores de descongestão estudados em todos os momentos. As diferenças médias ajustadas (intervalo de confiança de 95%) nos dias 15, 30 e 90 foram: para Perda de peso (WL) -1,97 (-2,86 , −1,08), −1,74 (−2,73, −0,74); −1,53 (-2,75, -0,31)kg; para WL ajustado pela dose de diurético: −2,31 (−3,77, −0,85), −2,79 (−5,03, −0,54), −3,18 (−6,08, −0,28) kg/40 mg furosemida i.v. ou equivalente; respectivamente (todos P < 0,05). Maior hematocrito (HT) no dia 15 (ou seja, acima do HT mediano em toda a população) foi associado a uma probabilidade significativamente maior de benefício clínico no dia 90 (composto hierárquico de morte por todas as causas, eventos de insuficiência cardíaca e uma diferença de 5 pontos ou mais na pontuação total de sintomas do Kansas City Cardiomyopathy Questionnaire (mudança da linha de base para 90 dias) com a taxa de vitória de 1,75 (IC95% 1,37, 2,23; P <0,0001).⁶⁶
- Okoroike et al., no estudo INSIGHT-HF, uma análise retrospectiva de 2663 pacientes hospitalizados com mais de 18 anos com Fração de Ejeção de Ventrículo Esquerdo (FEVE) ≤40% mostraram que as taxas de prescrição em 30 dias foi significativamente maior naqueles com início de inibidores de SGLT2 na programação de alta em comparação com aqueles que não iniciaram durante a internação (96% vs 14,7%, p <0,0001). A taxa de readmissão por insuficiência cardíaca nos primeiros 30 dias foi significativamente menor naqueles com início de inibidores de iSGLT2 antes da alta em comparação com aqueles que não iniciaram durante a hospitalização. (9,3% vs 22,7%, p = 0,04). A mortalidade cardiovascular foi numericamente, mas não significativamente, diferente entre os grupos (4% vs 10,7%, p = 0,21), mostrando a importância da reconciliação medicamentosa e início do tratamento ambulatorial na programação de alta.⁶⁷
- Chieng et al., em uma meta-análise que englobou 1.758 pacientes que receberam inibidores de SGLT2 em até duas semanas de uma admissão hospitalar, avaliaram os benefícios e a segurança do seu uso em ambiente hospitalar. Não houve complicações clinicamente importantes nos pacientes que iniciaram o uso de inibidores de SGLT2 durante a internação. Inclusive, na subanálise com pacientes internados por descompensação de insuficiência cardíaca, o uso de inibidores de SGLT2 foi associado a uma redução de risco relativa de 27% para reinternação por nova descompensação cardíaca quando comparado com placebo, entretanto a utilização não foi na fase aguda da doença.⁶⁸
- Huang et al., em um estudo retrospectivo de análise de prontuário, descreveram que o uso de inibidores de SGLT2 não foi associado a maior chance de complicação aguda como aumento de cetonemia clinicamente significativa quando comparado ao uso de inibidor de DPP4, sugerindo segurança para uso em ambiente hospitalar quando bem indicado.⁶⁹
AGONISTAS DO GLP-1
R19. O uso de agonistas do GLP-1 NÃO É RECOMENDADO em pacientes internados não-críticos pela potencial interferência no esvaziamento gástrico em procedimentos com sedação ou anestesia.
| Classe III | Nível C |
Sumário de evidências:
- Apesar de o uso de agonistas do receptor de GLP-1 em ambiente hospitalar parecer melhorar o controle glicêmico, com necessidade de menores doses de insulina quando comparados aos esquemas insulínicos convencionais⁷⁰, não é recomendado seu uso rotineiro em pacientes internados, principalmente naqueles com plano de procedimentos que envolvam anestesia geral ou sedação, devido ao potencial risco de broncoaspiração. Em mais de um estudo, o uso de agonistas do receptor de GLP1, principalmente dulaglutida e semaglutida, foram associados a maior risco de acúmulo de resíduo gástrico em pacientes submetidos à endoscopia digestiva alta ou ultrassonografia gástrica.⁷¹ ⁻ ⁷⁴
- Recentemente foi descrito estudo de caso-controle com 446 pacientes avaliados quanto à eficácia do preparo de cólon em colonoscopias. Havia mais pacientes com pior preparo de cólon dentre aqueles que utilizavam agonistas do receptor de GLP-1 (15.5% vs. 6.6%, p = 0.01), assim como mais pacientes precisaram repetir sua colonoscopia por preparo de colon inadequado (18.9% vs. 11.1%, p = 0.041).⁷⁵
- Sendo assim, pela ausência de estudos randomizados desenhados para avaliação desta população, assim como potenciais riscos, seu uso deve ser reservado à programação de alta e casos especiais.
TECNOLOGIAS E SENSORES DE GLICEMIA NO PACIENTE INTERNADO NÃO-CRÍTICO
R20. O uso do monitoramento contínuo da glicose intersticial (CGM) em ambiente hospitalar PODE SER CONSIDERADO em pacientes internados não-críticos.
| Classe IIb | Nível B |
Sumário de evidências:
- Spanakis et al., em um ensaio clínico randomizado com 185 pacientes, demonstraram que o uso do CGM em pacientes clínicos e cirúrgicos (cirurgia vascular, ortopédica, geral, torácica e outros tipos), com DM tipo 1 ou 2, é seguro e efetivo para guiar a insulinoterapia, sendo não inferior ao uso da glicemia capilar em tempo no alvo de 70 a 180mg/dL e em glicemia média diária, reduzindo de forma significativa os eventos hipoglicêmicos recorrentes: recorrência de hipoglicemia (1,80 ± 1,54 vs. 2,94 ± 2,76 eventos/paciente; p = 0,03), menor percentual de tempo abaixo da faixa <70 mg/dL (1,89% ± 3,27 vs. 5,47% ± 8,49; p = 0,02) e menor razão de taxa de incidência <70 mg/dL (0,53 [IC 95% 0,31-0,92]) e <54 mg/dL (0,37 [IC 95% 0,17-0,83]). (100)
- Outros estudos mostraram limitações tecnológicas que diminuem a precisão dos sensores subcutâneos, como o atraso da mensuração entre líquido intersticial e o sangue e substâncias interferentes, tais como acetaminofeno, dopamina, heparina, manitol, maltose, ácido ascórbico, ácido úrico e ácido salicílico.⁷⁶ ⁻ ⁷⁷
- Clubbs-Coldron et al. em uma revisão narrativa de 2023 levantaram a literatura existente e apesar de estudos mostrando benefício em algumas métricas, podendo levar a melhor controle glicêmico, gerar diminuição do tempo de internação e redução do risco de hipoglicemia grave ou hiperglicemia, apontam que faltam dados sobre como o uso impactaria em desfechos clínicos e financeiros, além do impacto na rotina de trabalho das equipes assistenciais. Entretanto, as pessoas com DM podem ser capacitadas para melhor autogerenciar sua condição, tendo acesso direto aos seus dados de glicemia.⁷⁸
- Hagerf et al., em um estudo prospectivo, comparando 1546 leituras de CGM Dexcom G6 com glicemias capilares e plasmáticas de 61 pacientes em pós-operatório de transplante de órgãos sólidos ou cirurgias abdominais (pancreatectomias totais ou parciais), mostrando boa acurácia do sensor, com MARD de 9,4% em relação às glicemias plasmáticas e 98,9% das glicemias nas áreas A e B no Grid de erro.⁷⁹
- Devido à realidade assistencial do nosso país, com dificuldade de acesso e custo ainda elevado dos sensores, o uso de CGM na realidade é restrito a pacientes que internam já utilizando, ou desejam iniciar o uso ainda dentro do hospital. Para estes casos, não existem impeditivos e não há necessidade de retirar o sensor dos pacientes ao serem internados, mesmo para procedimentos cirúrgicos, desde que estes não estejam instalados no mesmo local do sítio cirúrgico.
Nota Importante 10: Uso de sensores de glicemia intersticiais no paciente internado não-crítico
- O CGM pode demandar teste adicional de glicemia capilar quando a glicemia estiver <85mg/dL ou >300mg/dL, com sintomas de hipoglicemia, se houver instabilidade hemodinâmica, falha na leitura do aparelho ou durante o pós-operatório imediato.
- Em usuários prévios de monitores contínuos de glicose (também conhecidos pela sigla em inglês CGM) a manutenção do seu uso durante a hospitalização pode melhorar a satisfação do paciente.⁸⁰ ⁻ ⁸¹
- Em 2022, Matievich et al. demonstraram integridade funcional do CGM Freestyle Libre em simulações de exames de raios x, tomografia e ressonância, mostrando a segurança de mantê-los inseridos durante esses exames. Entretanto, é bom lembrar que esses sensores não possuem uma unidade transmissora externa que poderia ser um problema no caso de ressonância magnética.⁸² Entretanto, a bula do Freestyle Libre recomenda sua retirada para exames de ressonância magnética.
- A anemia severa (Hb <7g/dL) pode interferir na acurácia do CGM, sendo importante também conhecer cada equipamento para saber identificar demais interferentes (ácido ascórbico, paracetamol, ácido acetilsalicílico) e a necessidade, ou não, de calibração. Em caso de dúvidas, é sempre importante consultar a consultoria técnica do produto. Outra situação importante a ser lembrada é que os sensores geralmente perdem acurácia na faixa de hipoglicemia, sendo necessária a confirmação com glicemia capilar.⁸³
- É importante que o hospital tenha protocolos institucionais para manejo do CGM, como parte do treinamento da equipe para controle glicêmico.
- Os sensores podem ser mantidos durante a internação, exames e procedimentos, mas valores extremos precisam ser confirmados por glicemia capilar, assim como nas primeiras 24-48 horas após procedimentos cirúrgicos.
- Em pacientes instáveis ou mais graves, a possibilidade de divergências e perda de acurácia são maiores, necessitando maior atenção e eventual substituição pelas glicemias capilares.
Nota importante 11: Manuseio de sistema de infusão subcutânea contínua de insulina (SICI) em ambiente hospitalar.
- Os SICI são dispositivos que infundem insulina de forma contínua no subcutâneo. Eles podem ser totalmente programados de forma manual ou possuírem diversos graus de automatização. Os sistemas automatizados possuem opção de uso no modo manual, podendo ser programados para tal.⁸⁴
- Como a utilização de SICI tem se tornado mais popular, prestadores de saúde hospitalar enfrentarão a necessidade de gerenciar a internação de pacientes em terapia com SICI. Quando os pacientes são hospitalizados, deve ser tomada uma decisão se o paciente pode continuar o uso do SICI ou não. Essa resposta vai depender da capacidade do paciente para operar com segurança o SICI e a familiaridade dos prestadores de saúde com o sistema.⁸⁵
- Caso não haja pessoas com conhecimento sobre o manuseio de SICI, recomendamos que este seja substituído por outra forma de insulinização efetiva até que o paciente ou seus familiares tenham capacidade para voltar a operá-lo.⁸⁴
- São contraindicações à manutenção do uso de SICI as seguintes situações:
- Nível de consciência prejudicado
- Incapacidade do paciente de demonstrar corretamente as configurações mínimas apropriadas da bomba
- Doença crítica que requer cuidados intensivos
- Doença psiquiátrica que interfere na capacidade do paciente de gerenciar o sistema
- Paciente em risco de suicídio
- Cetoacidose diabética e síndrome hiperglicêmica hiperosmolar não cetótica
- Recusa ou falta de vontade do paciente em participar do autocuidado
- Falta de insumos de bomba
- Falta de profissionais de saúde treinados, educadores em DM ou especialistas em DM
- Decisão da equipe prestadora de cuidados de saúde
- A forma efetiva de insulinização para esse paciente é a basal-bolus, com múltiplas doses diárias.
- Calcula-se a dose total média de insulina utilizada no SICI no período mais recente (nos últimos sete dias, por exemplo); esta informação pode ser obtida pelo paciente ou diretamente na bomba.
- Prescreve-se 50% da dose total média de insulina como insulina basal, que pode ser insulina NPH ou análogo de ação longa (como glargina por exemplo).
- Para a dose de insulina bolus nas refeições, prescreve-se 50% da dose total média de insulina, dividido em três ou mais aplicações pré-prandiais de insulina regular ou análoga de ação rápida (por exemplo, lispro ou asparte).
- Titulam-se as doses de acordo com as recomendações acima.
- Um ajuste de segurança (por exemplo, menos 30%) pode ser feito para minimizar o risco de hipoglicemia em situações de risco, em pacientes que apresentem-se já com hipoglicemias ou tenham restrição de ingesta oral, entretanto, geralmente utiliza-se menor dose de insulina no SICI em relação à terapia basal-bolus, sendo geralmente desnecessária esta redução.
- Desliga-se o SICI aproximadamente duas horas após a aplicação de insulina basal.
- Exemplo prático: A dose total média de insulina utilizada no SICI de um paciente nos últimos sete dias é de 48 unidades/dia.
- Basal = 50% de 48 unidades = 24 unidades – 24 UI/dia de insulina glargina ou 8 UI 3 vezes ao dia de insulina NPH
- Bolus = 50% de 48 unidades/3 refeições = 8 UI de insulina de ação rápida em cada refeição
- O SICI pode ser reiniciado quando o paciente ou algum familiar for capaz de retomar a responsabilidade sobre seu manejo ou na alta hospitalar.
CORREÇÃO E MONITORAMENTO DAS HIPOGLICEMIAS:
R21. É RECOMENDADO realizar a correção das hipoglicemias hospitalares níveis 1 (Entre 54 e 70mg/dL) e 2 (<54mg/dL) por via oral, enteral ou gastrostomia, com solução contendo 15-30g de glicose (0,3g/kg), sendo reavaliada a glicemia a cada 15 minutos, e repetindo o tratamento até que a glicemia esteja acima de 100mg/dL.
| Classe I | Nível B |
R22. É RECOMENDADO realizar a correção da hipoglicemia por via endovenosa nos casos de hipoglicemia nível 3 (hipoglicemia associada a alteração de nível de consciência) ou impossibilidade de uso das vias oral, enteral ou gastrostomia.
| Classe I | Nível C |
R23. É RECOMENDADO que na eventualidade de uma hipoglicemia nível 3 (hipolicemia associada a alteração de nível de consciência), sem possibilidade de acesso venoso, seja realizada a aplicação intramuscular ou subcutânea de 1mg de Glucagon.
| Classe I | Nível C |
Sumário de evidências R21-R23:
- O tratamento da hipoglicemia requer ingestão de alimentos com glicose ou carboidrato, devendo ser realizado preferencialmente com glicose. A resposta aguda com aumento da glicemia se correlaciona melhor com a glicose do que com o conteúdo de carboidrato presente no alimento. A adição de gorduras pode retardar e prolongar a resposta glicêmica. A ingestão de proteínas em pacientes com DM tipo 2 pode aumentar a resposta insulínica sem o aumento da glicemia.⁸⁶
- McTavish et al., em um estudo randomizado e controlado, demonstraram que a correção da hipoglicemia ocorre de forma mais efetiva com uso oral de 0.3g de carboidrato por kg de peso em crianças e adultos com DM tipo 1 em bomba de infusão contínua de insulina.⁸⁷
- Georgakopoulos et al., em estudo comparativo com voluntários saudáveis com hipoglicemia induzida por insulina rápida por via subcutânea, mostrou que a suplementação de glicose foi mais efetiva do que a suplementação de sacarose na reversão da hipoglicemia.⁸⁸
- McTavish e Wiltshire avaliaram episódios de hipoglicemia em crianças com DM tipo 1 durante acampamento e foi observado que suplementação de carboidratos (0,3 g/kg) foi efetiva em corrigir a glicemia em até 15 minutos.⁸⁹
- Namba et al. em um estudo de farmacocinética e farmacodinâmica de uso de glucagon intramuscular ou endovenoso, que após a aplicação IM, a glicemia sobe em média 55mg/dL em 20 minutos, sendo uma alternativa quando a via endovenosa para aplicação de glicose não está disponível.⁹⁰
Nota importante 12: Uso de soluções glicosadas endovenosas
- Com o objetivo de evitar super correção da glicemia e causar tromboflebites, a via endovenosa deve ser reservada para casos de hipoglicemia grave ou de impossibilidade de uso de via oral/enteral.
- Na eventualidade do uso da veia periférica, devem ser utilizadas soluções de 25-50% de glicose, perfazendo um total de 10-30g de glicose.
- Alternativamente, pode ser usado 10g para hipoglicemias nível 1 e 20-30g para nível 2 ou 3), em bolus lento, com reavaliação da glicemia a cada 15 minutos, até que a glicemia esteja acima de 100mg/dL. Vale relembrar que cada 10mL de solução de glicose 50% possui 5g e cada 10mL de solução 25% possui 2,5g.
Resumo das recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1 – É RECOMENDADO utilizar o critério de HIPERGLICEMIA HOSPITALAR para todo paciente que apresente glicemia capilar ou plasmática acima de 180mg/dL, independentemente da existência prévia de diabetes, por estar associada a maior necessidade de tratamento. | I | B |
| R2 – É RECOMENDADO rastrear a hiperglicemia hospitalar com um teste de glicemia capilar ou plasmática em todo o paciente adulto ao internar, independentemente do diagnóstico prévio de DM. | I | C |
| R3 – É RECOMENDADO solicitar dosagem de HbA1c para todos os pacientes com hiperglicemia hospitalar confirmada ou que também já tenham diagnóstico de DM, desde que não tenha sido realizada nos últimos 3 meses, visando diagnosticar casos desconhecidos de DM, quando esta estiver acima de 6,5%, e auxiliar no processo de alta hospitalar. | I | B |
| R4 – É RECOMENDADO o monitoramento com glicemias capilares em todos pacientes com hiperglicemia hospitalar que apresentem glicemias acima de 180 mg/dL. | I | C |
| R5 – É RECOMENDADO realizar teste para cetonemia capilar ou cetonúria nas seguintes situações: pacientes que apresentem glicemias acima de 250mg/dL, pacientes com sinais ou sintomas sugestivos de cetoacidose, especialmente que estejam em uso de inibidores de SGLT2, mesmo com glicemia normal. | I | C |
| R6 – Em pacientes em uso de glicocorticóide, independentemente do diagnóstico prévio de DM, É RECOMENDADO realizar glicemias capilares ao acordar e antes do jantar. | I | C |
| R7 – Em pacientes com HH não-críticos com ou sem DM, É RECOMENDADO utilizar a meta de controle glicêmico entre 100 a 180 mg/dL, visando evitar hiper e hipoglicemias. | I | C |
| R8 – É RECOMENDADO o uso de insulina basal, se necessário associada a bolus pré-prandiais para o tratamento de hiperglicemia persistente em pacientes hospitalizados não-críticos, por estar relacionado ao melhor controle glicêmico, redução de desfechos desfavoráveis e do tempo de internação. | I | A |
| R9 – PODE SER CONSIDERADO o uso de insulina NPH em dose única diária pela manhã para o tratamento da hiperglicemia secundária ao uso de glicocorticoide, em pacientes com predomínio de hiperglicemia vespertina, iniciando-se em 0,1 UI/kg.dia, de forma isolada ou associada às outras formas de insulinização ou medicamentos orais. | IIb | B |
| R10 – É RECOMENDADO o intervalo de ajuste da insulinoterapia a cada 24 a 48 horas, de acordo com monitorização de glicemia situação da dieta e posologia de medicamentos com efeitos hiperglicemiantes. | I | C |
| R11 – É RECOMENDADO que, em um esquema basal-bolus, o ajuste da dose total diária de insulina seja realizado de acordo com a média glicêmica ou valores das glicemias de jejum e pré-refeições. | I | B |
| R12 – É RECOMENDADO adotar um padrão de ajuste para doses de insulina, que pode ser igualmente efetivo em valores percentuais da dose total diária (DTD) de insulina (em 10-20% ao dia) ou de acordo com a DTD de insulina por peso do paciente (em 0,05-0,1 UI/kg.dia). | I | B |
| R13 – DEVE SER CONSIDERADO suspender as doses fixas de bolus de insulina nos pacientes com baixa aceitação de dieta oral. | IIa | C |
| R14 – Medicamentos secretagogos de insulina (sulfonilureias e glinidas) NÃO SÃO RECOMENDADOS durante a internação hospitalar, devido ao risco de hipoglicemias. | III | C |
| R15 – O uso da metformina para auxiliar no controle glicêmico de pacientes internados, utilizando altas doses de insulina, PODE SER CONSIDERADO quando o quadro agudo estiver resolvido, o paciente estiver estável, a TFG estiver acima de 30ml/min/1.73m² e não houver programação de realização de exames contrastados. | IIb | C |
| R16 – O uso de inibidores da DPP4 PODE SER CONSIDERADO em pacientes não-críticos que apresentem hiperglicemia leve (180-200mg/dL), desde que ajustados para a função renal, quando recomendado. | IIb | A |
| R17 – PODE SER CONSIDERADA a manutenção do uso dos iSGLT2 em pacientes internados não-críticos com DM tipo 2, principalmente em casos com insuficiência cardíaca. | IIb | B |
| R18 – Em pacientes internados que estejam em uso de iSGLT2, É RECOMENDADO a monitorização de cetonas, preferencialmente de cetonemia capilar ou, em sua ausência, de cetonúria, devendo o mesmo ser suspenso em caso de cetonemia > 1,5 mmol/L ou cetonúria positiva, para reduzir o risco de cetoacidose diabética. | I | C |
| R19 – O uso de agonistas do GLP-1 NÃO É RECOMENDADO em pacientes internados não-críticos pela potencial interferência no esvaziamento gástrico em procedimentos com sedação ou anestesia. | III | C |
| R20 – O uso do monitoramento contínuo da glicose intersticial (CGM) em ambiente hospitalar PODE SER CONSIDERADO em pacientes internados não-críticos. | IIb | B |
| R21 – É RECOMENDADO realizar a correção das hipoglicemias hospitalares níveis 1 (Entre 54 e 70mg/dL) e 2 (<54mg/dL) por via oral, enteral ou gastrostomia, com solução contendo 15-30g de glicose (0,3g/kg), sendo reavaliada a glicemia a cada 15 minutos, e repetindo o tratamento até que a glicemia esteja acima de 100mg/dL. | I | B |
| R22 – É RECOMENDADO realizar a correção da hipoglicemia por via endovenosa nos casos de hipoglicemia nível 3 (hipoglicemia associada a alteração de nível de consciência) ou impossibilidade de uso das vias oral, enteral ou gastrostomia. | I | C |
| R23 – É RECOMENDADO que na eventualidade de uma hipoglicemia nível 3 (hipolicemia associada a alteração de nível de consciência), sem possibilidade de acesso venoso, seja realizada a aplicação intramuscular ou subcutânea de 1mg de Glucagon. | I | C |
Referências
- Umpierrez GE, Isaacs SD, Bazargan N, You X, Thaler LM, Kitabchi AE. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Metab. 2002 Mar;87(3):978–82.
- Dungan KM, Braithwaite SS, Preiser J-C. Stress hyperglycaemia. Lancet. 2009 May 23;373(9677):1798–807.
- Wang Z, Ren J, Wang G, Liu Q, Guo K, Li J. Association Between Diabetes Mellitus and Outcomes of Patients with Sepsis: A Meta-Analysis. Med Sci Monit. 2017 Jul 20;23:3546–55.
- Leite SA, Locatelli SB, Niece SP, Oliveira AR, Tockus D, Tosin T. Impact of hyperglycemia on morbidity and mortality, length of hospitalization and rates of re-hospitalization in a general hospital setting in Brazil. Diabetol Metab Syndr. 2010 Jul 21;2:49.
- Corsino L, Dhatariya K, Umpierrez G. Management of Diabetes and Hyperglycemia in Hospitalized Patients. In: De Groot LJ, Beck-Peccoz P, Chrousos G, Dungan K, Grossman A, Hershman JM, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.; 2000.
- Cook CB, Castro JC, Schmidt RE, Gauthier SM, Whitaker MD, Roust LR, et al. Diabetes care in hospitalized noncritically ill patients: More evidence for clinical inertia and negative therapeutic momentum. J Hosp Med. 2007 Jul;2(4):203–11.
- Umpierrez GE, Smiley D, Jacobs S, Peng L, Temponi A, Mulligan P, et al. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes undergoing general surgery (RABBIT 2 surgery). Diabetes Care. 2011 Feb;34(2):256–61.
- Newton CA, Young S. Financial implications of glycemic control: results of an inpatient diabetes management program. Endocr Pract. 2006;12 Suppl 3:43–8.
- Murad MH, Coburn JA, Coto-Yglesias F, Dzyubak S, Hazem A, Lane MA, et al. Glycemic control in non-critically ill hospitalized patients: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2012 Jan;97(1):49–58.
- Mandel SR, Langan S, Mathioudakis NN, Sidhaye AR, Bashura H, Bie JY, et al. Retrospective study of inpatient diabetes management service, length of stay and 30-day readmission rate of patients with diabetes at a community hospital. J Community Hosp Intern Med Perspect. 2019 Apr 12;9(2):64–73.
- Kyi M, Colman PG, Wraight PR, Reid J, Gorelik A, Galligan A, et al. Early Intervention for Diabetes in Medical and Surgical Inpatients Decreases Hyperglycemia and Hospital-Acquired Infections: A Cluster Randomized Trial. Diabetes Care. 2019 May;42(5):832–40.
- Umpierrez GE, Smiley D, Zisman A, Prieto LM, Palacio A, Ceron M, et al. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes (RABBIT 2 trial). Diabetes Care. 2007 Sep;30(9):2181–6.
- Christensen MB, Gotfredsen A, Nørgaard K. Efficacy of basal-bolus insulin regimens in the inpatient management of non-critically ill patients with type 2 diabetes: A systematic review and meta-analysis. Diabetes Metab Res Rev. 2017 Jul;33(5).
- McAlister FA, Majumdar SR, Blitz S, Rowe BH, Romney J, Marrie TJ. The relation between hyperglycemia and outcomes in 2,471 patients admitted to the hospital with community-acquired pneumonia. Diabetes Care. 2005 Apr;28(4):810–5.
- Bhatti JM, Raza SA, Shahid MO, Akhtar A, Ahmed T, Das B. Association between glycemic control and the outcome in hospitalized patients with COVID-19. Endocrine. 2022 Aug;77(2):213–20.
- Van den Boom W, Schroeder RA, Manning MW, Setji TL, Fiestan G-O, Dunson DB. Effect of A1C and glucose on postoperative mortality in noncardiac and cardiac surgeries. Diabetes Care. 2018 Apr;41(4):782–8.
- Kosiborod M, Inzucchi SE, Krumholz HM, Xiao L, Jones PG, Fiske S, et al. Glucometrics in patients hospitalized with acute myocardial infarction: defining the optimal outcomes-based measure of risk. Circulation. 2008 Feb 26;117(8):1018–27.
- Fong KM, Au SY, Ng GWY. Glycemic control in critically ill patients with or without diabetes. BMC Anesthesiol. 2022 Jul 16;22(1):227.
- Abdelmalak B, Abdelmalak JB, Knittel J, Christiansen E, Mascha E, Zimmerman R, et al. The prevalence of undiagnosed diabetes in non-cardiac surgery patients, an observational study. Can J Anaesth. 2010 Dec 1;57(12):1058–64.
- Cobas R, Rodacki M, Giacaglia L, Calliari LEP, Noronha RM, Valerio C, et al. Diagnóstico do diabetes e rastreamento do diabetes tipo 2. Diretriz oficial da sociedade brasileira de diabetes. Conectando Pessoas; 2022.
- Greci LS, Kailasam M, Malkani S, Katz DL, Hulinsky I, Ahmadi R, et al. Utility of HbA(1c) levels for diabetes case finding in hospitalized patients with hyperglycemia. Diabetes Care. 2003 Apr;26(4):1064–8.
- Pasquel FJ, Gomez-Huelgas R, Anzola I, Oyedokun F, Haw JS, Vellanki P, et al. Predictive value of admission hemoglobin a1c on inpatient glycemic control and response to insulin therapy in medicine and surgery patients with type 2 diabetes. Diabetes Care. 2015 Dec;38(12):e202-3.
- Beck RW, Connor CG, Mullen DM, Wesley DM, Bergenstal RM. The fallacy of average: how using hba1c alone to assess glycemic control can be misleading. Diabetes Care. 2017 Aug;40(8):994–9.
- Gounden V, Ngu M, Anastasopoulou C, Jialal I. Fructosamine. StatPearls. Treasure Island (FL): StatPearls Publishing; 2024.
- Pasquel FJ, Gianchandani R, Rubin DJ, Dungan KM, Anzola I, Gomez PC, et al. Efficacy of sitagliptin for the hospital management of general medicine and surgery patients with type 2 diabetes (Sita-Hospital): a multicentre, prospective, open-label, non-inferiority randomised trial. Lancet Diabetes Endocrinol. 2017 Feb;5(2):125–33.
- Pérez-Belmonte LM, Gómez-Doblas JJ, Millán-Gómez M, López-Carmona MD, Guijarro-Merino R, Carrasco-Chinchilla F, et al. Use of Linagliptin for the Management of Medicine Department Inpatients with Type 2 Diabetes in Real-World Clinical Practice (Lina-Real-World Study). J Clin Med. 2018 Sep 11;7(9).
- Ribeiro RS, Peres RB, Yamamoto MT, Novaes AP, Laselva CR, Faulhaber ACL, et al. Impact of screening and monitoring of capillary blood glucose in the detection of hyperglycemia and hypoglycemia in non-critical inpatients. Einstein (Sao Paulo). 2011 Mar;9(1):14–7.
- Bowman CF, Nichols JH. Comparison of accuracy guidelines for hospital glucose meters. J Diabetes Sci Technol. 2020 May;14(3):546–52.
- Arora S, Henderson SO, Long T, Menchine M. Diagnostic accuracy of point-of-care testing for diabetic ketoacidosis at emergency-department triage: {beta}-hydroxybutyrate versus the urine dipstick. Diabetes Care. 2011 Apr;34(4):852–4.
- Brooke J, Stiell M, Ojo O. Evaluation of the Accuracy of Capillary Hydroxybutyrate Measurement Compared with Other Measurements in the Diagnosis of Diabetic Ketoacidosis: A Systematic Review. Int J Environ Res Public Health. 2016 Aug 23;13(9).
- Santomauro AT, Santomauro Junior AC, Raduan RA, Bertoluci M. Diagnóstico e tratamento da cetoacidose diabética euglicêmica. Diretriz oficial da sociedade brasileira de diabetes. Conectando Pessoas; 2022.
- Douros A, Lix LM, Fralick M, Dell’Aniello S, Shah BR, Ronksley PE, et al. Sodium-Glucose Cotransporter-2 Inhibitors and the Risk for Diabetic Ketoacidosis : A Multicenter Cohort Study. Ann Intern Med. 2020 Sep 15;173(6):417–25.
- Toyoshima MTK, Cukier P, Souza ABC de, Pereira J, Hoff AO, Nery M. Effects of glucocorticoids on interstitial glucose concentrations in individuals with hematologic cancer and without known diagnosis of diabetes: a pilot study. Einstein (Sao Paulo). 2022 Jul 8;20:eAO8031.
- Donihi AC, Raval D, Saul M, Korytkowski MT, DeVita MA. Prevalence and predictors of corticosteroid-related hyperglycemia in hospitalized patients. Endocr Pract. 2006;12(4):358–62.
- Le VT, Ha QH, Tran MT, Le NT, Le VT, Le MK. Hyperglycemia in Severe and Critical COVID-19 Patients: Risk Factors and Outcomes. Cureus. 2022 Aug 2;14(8):e27611.
- Johnston KC, Bruno A, Pauls Q, Hall CE, Barrett KM, Barsan W, et al. Intensive vs standard treatment of hyperglycemia and functional outcome in patients with acute ischemic stroke: the SHINE randomized clinical trial. JAMA. 2019 Jul 23;322(4):326–35.
- Umpierrez GE, Smiley D, Hermayer K, Khan A, Olson DE, Newton C, et al. Randomized study comparing a Basal-bolus with a basal plus correction insulin regimen for the hospital management of medical and surgical patients with type 2 diabetes: basal plus trial. Diabetes Care. 2013 Aug;36(8):2169–74.
- Drincic AT, Knezevich JT, Akkireddy P. Nutrition and hyperglycemia management in the inpatient setting (meals on demand, parenteral, or enteral nutrition). Curr Diab Rep. 2017 Aug;17(8):59.
- Brooks D, Schulman-Rosenbaum R, Griff M, Lester J, Low Wang CC. Glucocorticoid-Induced Hyperglycemia Including Dexamethasone-Associated Hyperglycemia in COVID-19 Infection: A Systematic Review. Endocr Pract. 2022 Nov;28(11):1166–77.
- Khowaja A, Alkhaddo JB, Rana Z, Fish L. Glycemic Control in Hospitalized Patients with Diabetes Receiving Corticosteroids Using a Neutral Protamine Hagedorn Insulin Protocol: A Randomized Clinical Trial. Diabetes Ther. 2018 Aug;9(4):1647–55.
- Grommesh B, Lausch MJ, Vannelli AJ, Mullen DM, Bergenstal RM, Richter SA, et al. Hospital insulin protocol aims for glucose control in glucocorticoid-induced hyperglycemia. Endocr Pract. 2016 Feb;22(2):180–9.
- Alessi J, de Oliveira GB, Schaan BD, Telo GH. Dexamethasone in the era of COVID-19: friend or foe? An essay on the effects of dexamethasone and the potential risks of its inadvertent use in patients with diabetes. Diabetol Metab Syndr. 2020 Sep 7;12:80.
- Aberer F, Hochfellner DA, Sourij H, Mader JK. A practical guide for the management of steroid induced hyperglycaemia in the hospital. J Clin Med. 2021 May 16;10(10).
- Magaji V, Johnston JM. Inpatient management of hyperglycemia and diabetes. Clinical Diabetes. 2011 Jan 1;29(1):3–9.
- Umpierrez GE, Hor T, Smiley D, Temponi A, Umpierrez D, Ceron M, et al. Comparison of inpatient insulin regimens with detemir plus aspart versus neutral protamine hagedorn plus regular in medical patients with type 2 diabetes. J Clin Endocrinol Metab. 2009 Feb;94(2):564–9.
- Pasquel FJ, Lansang MC, Khowaja A, Urrutia MA, Cardona S, Albury B, et al. A randomized controlled trial comparing glargine U300 and glargine U100 for the inpatient management of medicine and surgery patients with type 2 diabetes: glargine U300 hospital trial. Diabetes Care. 2020 Jun;43(6):1242–8.
- Galindo RJ, Pasquel FJ, Vellanki P, Alicic R, Lam DW, Fayfman M, et al. Degludec hospital trial: A randomized controlled trial comparing insulin degludec U100 and glargine U100 for the inpatient management of patients with type 2 diabetes. Diabetes Obes Metab. 2022 Jan;24(1):42–9.
- Zhang X, Zhang T, Xiang G, Wang W, Li Y, Du T, et al. Comparison of weight-based insulin titration (WIT) and glucose-based insulin titration using basal-bolus algorithm in hospitalized patients with type 2 diabetes: a multicenter, randomized, clinical study. BMJ Open Diabetes Res Care. 2020 Sep;8(1).
- Li X, Du T, Li W, Zhang T, Liu H, Xiong Y. Efficacy and safety of weight-based insulin glargine dose titration regimen compared with glucose level- and current dose-based regimens in hospitalized patients with type 2 diabetes: a randomized, controlled study. Clin Ther. 2014 Sep 1;36(9):1269–75.
- Riddle MC, Rosenstock J, Gerich J, Insulin Glargine 4002 Study Investigators. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care. 2003 Nov;26(11):3080–6.
- Trence DL, Kelly JL, Hirsch IB. The rationale and management of hyperglycemia for in-patients with cardiovascular disease: time for change. J Clin Endocrinol Metab. 2003 Jun;88(6):2430–7.
- Rajendran R, Kerry C, Rayman G, MaGIC study group. Temporal patterns of hypoglycaemia and burden of sulfonylurea-related hypoglycaemia in UK hospitals: a retrospective multicentre audit of hospitalised patients with diabetes. BMJ Open. 2014 Jul 9;4(7):e005165.
- Bano T, Mishra SK, Kuchay MS, Mehta Y, Trehan N, Sharma P, et al. Continuation of metformin till night before surgery and lactate levels in patients undergoing coronary artery bypass graft surgery. Indian J Endocrinol Metab. 2019 Aug;23(4):416–21.
- Salpeter SR, Greyber E, Pasternak GA, Salpeter EE. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev. 2010 Apr 14;2010(4):CD002967.
- Ma Z, Krishnamurthy M. Is metformin use associated with low mortality in patients with type 2 diabetes mellitus hospitalized for COVID-19? a multivariable and propensity score-adjusted meta-analysis. PLoS ONE. 2023 Feb 23;18(2):e0282210.
- Vellanki P, Rasouli N, Baldwin D, Alexanian S, Anzola I, Urrutia M, et al. Glycaemic efficacy and safety of linagliptin compared to a basal-bolus insulin regimen in patients with type 2 diabetes undergoing non-cardiac surgery: A multicentre randomized clinical trial. Diabetes Obes Metab. 2019 Apr;21(4):837–43.
- Umpierrez GE, Gianchandani R, Smiley D, Jacobs S, Wesorick DH, Newton C, et al. Safety and efficacy of sitagliptin therapy for the inpatient management of general medicine and surgery patients with type 2 diabetes: a pilot, randomized, controlled study. Diabetes Care. 2013 Nov;36(11):3430–5.
- Gracia-Ramos AE, Cruz-Dominguez MDP, Madrigal-Santillán EO, Rojas-Martínez R, Morales-González JA, Morales-González Á, et al. Efficacy and safety of sitagliptin with basal-plus insulin regimen versus insulin alone in non-critically ill hospitalized patients with type 2 diabetes: SITA-PLUS hospital trial. J Diabetes Complicat. 2024 May;38(5):108742.
- Rabizadeh S, Tavakoli Ardakani MA, Mouodi M, Bitaraf M, Shab-Bidar S, Esteghamati A, et al. DPP4 Inhibitors in the Management of Hospitalized Patients With Type 2 Diabetes: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Adv Ther. 2020 Sep;37(9):3660–75.
- Singh LG, Ntelis S, Siddiqui T, Seliger SL, Sorkin JD, Spanakis EK. Association of continued use of SGLT2 inhibitors from the ambulatory to inpatient setting with hospital outcomes in patients with diabetes: A nationwide cohort study. Diabetes Care. 2024 Jun 1;47(6):933–40.
- Thiruvenkatarajan V, Meyer EJ, Nanjappa N, Van Wijk RM, Jesudason D. Perioperative diabetic ketoacidosis associated with sodium-glucose co-transporter-2 inhibitors: a systematic review. Br J Anaesth. 2019 Jul;123(1):27–36.
- Kosiborod MN, Esterline R, Furtado RHM, Oscarsson J, Gasparyan SB, Koch GG, et al. Dapagliflozin in patients with cardiometabolic risk factors hospitalised with COVID-19 (DARE-19): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol. 2021 Sep;9(9):586–94.
- Voors AA, Angermann CE, Teerlink JR, Collins SP, Kosiborod M, Biegus J, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med. 2022 Mar;28(3):568–74.
- Biegus J, Voors AA, Collins SP, Kosiborod MN, Teerlink JR, Angermann CE, et al. Impact of empagliflozin on decongestion in acute heart failure: the EMPULSE trial. Eur Heart J. 2023 Jan 1;44(1):41–50.
- Okoroike H, Patel S, Simone P, Lavelle R, Szwak JA. Impact of Inpatient Initiation of Sodium-Glucose Cotransporter-2 Inhibitors on Prescription Rates in Patients With Heart Failure With Reduced Ejection Fraction. Am J Cardiol. 2023 Jan 1;186:150–5.
- Chieng JHL, Sia TK, Teo YH, Wong JZA, Ng TJY, Teo YN, et al. Evaluating the Initiation of Sodium/Glucose Cotransporter 2 Inhibitors within 2 Weeks of an Acute Hospital Admission: A Systematic Review and Meta-Analysis of Nine Clinical Trials. Med Princ Pract. 2022 Apr 4;31(3):215–23.
- Huang W, Whitelaw J, Kishore K, Neto AS, Holmes NE, Marhoon N, et al. The comparative epidemiology and outcomes of hospitalized patients treated with SGLT2 or DPP4 inhibitors. J Diabetes Complicat. 2021 Dec;35(12):108052.
- Watkins AR, Fialka N, El-Andari R, Kang JJ, Bozso SJ, Nagendran J. Effect of glucagon-like peptide-1 receptor agonists administration during coronary artery bypass grafting: a systematic review and meta-analysis of randomized control trials. Future Cardiol. 2023 Mar 28;
- Silveira SQ, da Silva LM, de Campos Vieira Abib A, de Moura DTH, de Moura EGH, Santos LB, et al. Relationship between perioperative semaglutide use and residual gastric content: A retrospective analysis of patients undergoing elective upper endoscopy. J Clin Anesth. 2023 Aug;87:111091.
- Kobori T, Onishi Y, Yoshida Y, Tahara T, Kikuchi T, Kubota T, et al. Association of glucagon-like peptide-1 receptor agonist treatment with gastric residue in an esophagogastroduodenoscopy. J Diabetes Investig. 2023 Jun;14(6):767–73.
- Sherwin M, Hamburger J, Katz D, DeMaria S. Influence of semaglutide use on the presence of residual gastric solids on gastric ultrasound: a prospective observational study in volunteers without obesity recently started on semaglutide. Can J Anaesth. 2023 Aug;70(8):1300–6.
- Nakatani Y, Maeda M, Matsumura M, Shimizu R, Banba N, Aso Y, et al. Effect of GLP-1 receptor agonist on gastrointestinal tract motility and residue rates as evaluated by capsule endoscopy. Diabetes Metab. 2017 Oct;43(5):430–7.
- Yao R, Gala KS, Ghusn W, Abboud DM, Wallace FK, Vargas EJ. Effect of Glucagon-Like Peptide-1 Receptor Agonists on Bowel Preparation for Colonoscopy. Am J Gastroenterol. 2024 Feb 28;
- Lansang MC, Modic MB, Sauvey R, Lock P, Ross D, Combs P, et al. Approach to the adult hospitalized patient on an insulin pump. J Hosp Med. 2013 Dec;8(12):721–7.
- Klonoff DC, Buckingham B, Christiansen JS, Montori VM, Tamborlane WV, Vigersky RA, et al. Continuous glucose monitoring: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2011 Oct;96(10):2968–79.
- Clubbs Coldron B, Coates V, Khamis A, MacRury S. Use of Continuous Glucose Monitoring in Non-ICU Hospital Settings for People With Diabetes: A Scoping Review of Emerging Benefits and Issues. J Diabetes Sci Technol. 2023 Mar;17(2):467–73.
- Voglová Hagerf B, Protus M, Nemetova L, Mraz M, Kieslichova E, Uchytilova E, et al. Accuracy and Feasibility of Real-time Continuous Glucose Monitoring in Critically Ill Patients After Abdominal Surgery and Solid Organ Transplantation. Diabetes Care. 2024 Jun 1;47(6):956–63.
- Klonoff DC, Kerr D. A Simplified Approach Using Rate of Change Arrows to Adjust Insulin With Real-Time Continuous Glucose Monitoring. J Diabetes Sci Technol. 2017 Nov;11(6):1063–9.
- Logtenberg SJ, Kleefstra N, Snellen FT, Groenier KH, Slingerland RJ, Nierich AP, et al. Pre- and postoperative accuracy and safety of a real-time continuous glucose monitoring system in cardiac surgical patients: a randomized pilot study. Diabetes Technol Ther. 2009 Jan;11(1):31–7.
- Matievich W, Kiaie N, Dunn TC. Safety and functional integrity of CGM sensors when used during radiologic procedures under high exposure conditions. J Diabetes Sci Technol. 2022 Jun 30;19322968221106210.
- Davis GM, Spanakis EK, Migdal AL, Singh LG, Albury B, Urrutia MA, et al. Accuracy of Dexcom G6 Continuous Glucose Monitoring in Non-Critically Ill Hospitalized Patients With Diabetes. Diabetes Care. 2021 Jul;44(7):1641–6.
- Davis GM, Galindo RJ, Migdal AL, Umpierrez GE. Diabetes technology in the inpatient setting for management of hyperglycemia. Endocrinol Metab Clin North Am. 2020 Mar;49(1):79–93.
- Nassar AA, Partlow BJ, Boyle ME, Castro JC, Bourgeois PB, Cook CB. Outpatient-to-inpatient transition of insulin pump therapy: successes and continuing challenges. J Diabetes Sci Technol. 2010 Jul 1;4(4):863–72.
- ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, Bruemmer D, et al. 6. Glycemic Targets: Standards of Care in Diabetes-2023. Diabetes Care. 2023 Jan 1;46(Suppl 1):S97–110.
- McTavish L, Corley B, Weatherall M, Wiltshire E, Krebs JD. Weight-based carbohydrate treatment of hypoglycaemia in people with Type 1 diabetes using insulin pump therapy: a randomized crossover clinical trial. Diabet Med. 2018 Mar;35(3):339–46.
- Georgakopoulos K, Katsilambros N, Fragaki M, Poulopoulou Z, Kimbouris J, Sfikakis P, et al. Recovery from insulin-induced hypoglycemia after saccharose or glucose administration. Clin Physiol Biochem. 1990;8(5):267–72.
- McTavish L, Wiltshire E. Effective treatment of hypoglycemia in children with type 1 diabetes: a randomized controlled clinical trial. Pediatr Diabetes. 2011 Jun;12(4 Pt 2):381–7.
- Namba M, Hanafusa T, Kono N, Tarui S. Clinical evaluation of biosynthetic glucagon treatment for recovery from hypoglycemia developed in diabetic patients. The GL-G Hypoglycemia Study Group. Diabetes Res Clin Pract. 1993 Feb;19(2):133–8.
Cite este artigo