Autores: Melanie Rodacki, Roberta A. Cobas, Lenita Zajdenverg, Wellington Santana da Silva Júnior, Luciano Giacaglia, Luis Eduardo Calliari, Renata Maria Noronha (in memoriam), Cynthia Valerio, Joaquim Custódio, Mauro Scharf, Cristiano Roberto Grimaldi Barcellos, Bianca de Almeida-Pititto, Carlos Antonio Negrato, Monica Gabbay, Marcello Bertoluci
Editor-Chefe: Marcello Bertoluci
Última revisão em: 09/07/2024
DOI: 10.29327/5412848.2024-1 | Cite este Artigo
Introdução
O diagnóstico de diabetes mellitus (DM) deve ser estabelecido pela identificação de hiperglicemia. Para isto, podem ser usados a glicemia plasmática de jejum (GJ), o teste de tolerância à glicose por via oral (TTGO) e a hemoglobina glicada (HbA1c). O TTGO consiste em uma glicemia realizada após uma hora (TTGO-1h) ou duas horas (TTGO-2h) de uma sobrecarga de 75 gramas de glicose por via oral.
Os sinais e sintomas sugestivos de hiperglicemia estão indicados no quadro 1. Entretanto, frequentemente há ausência de sintomas.
Os testes laboratoriais para o diagnóstico de DM devem ser feitos em todos os indivíduos com sintomatologia sugestiva de diabetes, e em indivíduos assintomáticos com risco aumentado de desenvolver essa condição.
Ao realizar testes para diagnóstico de DM, também podem ser identificadas pessoas com hiperglicemia leve, que não preenchem critérios para DM. De acordo com a International Diabetes Federation (IDF), esses casos constituem a “hiperglicemia intermediária”¹, composta pela “glicemia de jejum alterada”, nos casos em que a disglicemia leve ocorre em jejum e pela “intolerância à glicose”, na situação em que há hiperglicemia leve após TTGO, sem preencher critérios para DM. A American Diabetes Association (ADA) e a Sociedade Brasileira de Diabetes (SBD) utilizam a nomenclatura “pré-diabetes” para estes indivíduos.² Embora nem todos os indivíduos desse grupo evoluam para DM, o termo “pré-diabetes” tornou-se facilmente assimilado e difundido pelos profissionais de saúde.
Quadro 1. Sinais e sintomas de hiperglicemia
| Sinais e sintomas TÍPICOS de hiperglicemia |
|
| Sinais e sintomas SUGESTIVOS de hiperglicemia |
|
Recomendações
R1. É RECOMENDADO utilizar, como critérios de diagnóstico de DM, a glicemia de jejum maior ou igual a 126 mg/dl, a HbA1c maior ou igual a 6,5%, a glicemia no TTGO-1h maior ou igual a 209 mg/dl ou a glicemia no TTGO- 2h maior ou igual a 200 mg/dl. Se somente um exame estiver alterado, este deverá ser repetido para confirmação.
| Classe I | Nível B |
Sumário de evidências:
- O Report of the Expert Committee on the Diagnosis and Classification of Diabetes de 1997 definiu o ponto de corte da glicemia de jejum e da glicemia de duas horas após sobrecarga de glicose para diagnóstico de DM e de pré-diabetes com base em três coortes populacionais que avaliaram a associação entre os níveis glicêmicos e o surgimento de retinopatia diabética.³⁻⁹
- Um estudo de coorte demonstrou uma relação contínua entre níveis glicêmicos e desenvolvimento de retinopatia diabética. Entretanto, há um limiar que divide os indivíduos em maior risco de complicações relacionadas ao DM daqueles em menor risco, o que é utilizado para determinar o ponto de corte para diagnóstico de DM.¹⁰ Este limiar não é uniforme entre os estudos. Diferenças na prevalência de retinopatia podem justificar, em parte, os diferentes limiares.¹¹
- O estudo Emerging Risk Factors Collaboration, que avaliou 121 estudos prospectivos envolvendo um total de 1,27 milhão de adultos com registros individuais sobre complicações cardiovasculares, mostrou que, em indivíduos sem histórico de DM, o risco de apresentar doença coronariana foi significativamente mais elevado naqueles com GJ ≥ 126 mg/dl em comparação com pessoas com GJ ≤ 100 mg/dl. O diagnóstico conhecido de DM ou a medida de GJ ≥ 126 mg/dl, independente de outros fatores, aumentou em duas vezes o risco de doença coronariana, acidente vascular cerebral e mortes atribuídas a causas vasculares.¹²
- O uso de valor de corte da HbA1c ≥ 6,5% como critério diagnóstico de DM foi sugerido em 2009 pelo International Expert Committee, baseado nos estudos populacionais que também avaliaram a GJ e o TTGO-2h.¹³ A avaliação de dados de nove estudos de cinco países, com 44.623 participantes de idades entre 20 e 79 anos, demonstrou aumento do odds ratio (OR) entre a medida da HbA1c e a presença de retinopatia diabética (OR HbA1c 6,5–6,9% vs HbA1c 4-4,4% = 16,8 [IC 95%: 2,3–123,7]; p= 0,01).¹⁹
- O ponto de corte de HbA1c de 6,5% tem uma sensibilidade de 47-67% e uma especificidade de 98-99% para o diagnóstico de DM, em relação ao TTGO-2h.¹⁴⁻¹⁷
- Dados brasileiros também corroboram a baixa sensibilidade e alta especificidade da HbA1c para diagnóstico de DM, em relação ao TTGO-2h.¹⁸
- Uma metanálise que incluiu 17 estudos avaliando a acurácia da HbA1c e da GJ para o diagnóstico de DM, considerando o TTGO-2h como padrão-ouro, mostrou que a sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo da HbA1c ≥ 6,5% foram de 50% (IC 95%: 42–59%), 97,3% (IC 95%: 95,3–98,4), 18,32% (IC 95%: 11,06–30,53) e 51% (IC 95%: 43–60%), respectivamente. Para GJ ≥ 126 mg/dl, os respectivos valores foram 59,4% (IC 95%: 46,6–71%), 98,8% (IC 95%: 96,5–99,6%), 47,82% (IC 95%: 19,10–119,73%) e 41,1% (IC 95%: 30,5–55,5%), respectivamente.²⁰
- Diferenças étnicas que afetam a medida da HbA1c devem ser consideradas. Indivíduos afrodescendentes podem ter HbA1c mais elevada do que o esperado para o perfil glicêmico, com testes falso-positivos para diagnóstico de DM.²¹
- A variabilidade intraindividual dos métodos glicêmicos com intervalo de duas semanas entre as medidas foi avaliada em 685 indivíduos acima de 20 anos de idade e sem DM, incluídos no NHANES III. A glicemia de duas horas apresentou maior variabilidade (16,7%), comparada à GJ (5,7%) e à HbA1c (3,6%). A proporção de indivíduos com GJ ≥ 100 mg/dl, GJ ≥ 126 mg/dl, GJ ≥ 200 mg/dl, glicemia de 2h ≥ 140 mg/dl, glicemia de 2h ≥ 200 mg/dl e HbA1c ≥ 6,5% que apresentaram a mesma alteração no segundo resultado foi de 78%, 70,4%, 100%, 72%, 72% e 83,3%, respectivamente. A prevalência de DM não diagnosticado usando apenas uma GJ foi de 3,7%. Com confirmação por uma segunda amostra, a prevalência foi de 2,8%, correspondendo a uma redução de 24,4%. Para glicemia de duas horas, a prevalência de DM não diagnosticado foi de 9% e 6,7%, com uma ou duas alterações, significando redução de 26%. Os resultados desse estudo sugerem haver diferenças nas estimativas de prevalência de DM entre estudos epidemiológicos que utilizam uma ou duas medidas de glicemia.²²
- Recentemente, um comitê de experts da IDF reavaliou a acurácia e aplicabilidade do TTGO de 1 hora (TTGO-1h) para diagnóstico de pré-diabetes e de DM. TTGO-1h é mais prático do que o TTGO-2h. Uma metanálise de 15 estudos com 35.551 indivíduos caucasianos, ameríndios, asiáticos e mexicanos americanos identificou que o valor de corte de TTGO-1h de 209 mg/dl é equivalente ao valor de corte no TTGO-2h de 200 mg/dl para diagnóstico de DM. A IDF recomenda que a glicemia no TTGO-1h ≥ 209 mg/dl seja um critério para diagnóstico de DM.¹,²³
Tabela 1. Critérios laboratoriais para diagnóstico de DM e pré-diabetes.
| Critérios | Normal | Pré-diabetes | DM |
| Glicemia de jejum (mg/dl) | < 100 | 100-125 | ≥ 126 |
| Glicemia ao acaso (mg/dl) + sintomas | - | - | ≥ 200 |
| Glicemia de 1 hora no TTGO (mg/dl) | < 155 | 155-208 | ≥ 209 |
| Glicemia de 2 horas no TTGO (mg/dl) | < 140 | 140-199 | ≥ 200 |
| HbA1c (%) | < 5,7 | 5,7-6,4 | ≥ 6,5 |
DM: diabetes mellitus; TTGO: teste de tolerância à glicose oral; HbA1c: hemoglobina glicada. *Considera-se como jejum a cessação de ingesta calórica de 8-12 horas. **Carga oral equivalente a 75 g de glicose anidra diluída em água.
Nota importante 1: Cuidados e limitações dos métodos diagnósticos
- Todos os métodos têm limitações metodológicas. A GJ necessita de jejum, sofre interferências decorrentes de condições agudas e tem menor taxa de reprodutibilidade quando comparada à HbA1c.
- O TTGO é mais oneroso, desconfortável e consome mais tempo, mas tem maior sensibilidade. Para sua utilização, deve ser feita alimentação nos três dias antecendentes ao teste, com ingesta de, pelo menos, 150g de carboidratos por dia.²⁴
- A HbA1c tem maior custo e não leva em conta a variabilidade individual no fenômeno de glicação proteica, além de ter menor sensibilidade diagnóstica do que os outros métodos.²⁵,²⁶
Nota importante 2: Padronização da HbA1c
- A análise laboratorial da HbA1c foi mundialmente padronizada pelo método de cromatografia líquida de alta eficiência (CLAE ou HPLC, na sigla em inglês), e sua validação necessita ser certificada pelo National Glycohemoglobin Standardization Program (NGSP), estabelecida para a aplicabilidade no estudo Diabetes Control and Complications Trial (DCCT).²⁵
R2. Na presença de sintomas típicos de hiperglicemia, É RECOMENDADO que o diagnóstico seja estabelecido quando houver glicemia plasmática ao acaso maior ou igual a 200 mg/dl.
| Classe I | Nível C |
Sumário de evidências:
- Este painel considera que, com o intuito de não postergar o início de tratamento em situações agudas, o diagnóstico de DM poderá ser feito por meio de glicemia ao acaso, quando houver presença de sintomas típicos de hiperglicemia, como poliúria, polidipsia e perda de peso inexplicada.
R3. É RECOMENDADO estabelecer o diagnóstico de DM se houver glicemia de jejum maior ou igual a 126 mg/dl e HbA1c maior ou igual a 6,5%, simultaneamente.
| Classe I | Nível B |
Sumário de evidências:
- No estudo Atherosclerosis Risk in Communities (ARIC), com 12.268 participantes (brancos e afrodescendentes), sem diagnóstico prévio de DM, foram acompanhados por 25 anos para avaliar a incidência de diabetes. Dois subgrupos foram analisados prospectivamente (n = 978): DM confirmado (39%), quando GJ e HbA1c estavam alteradas na mesma amostra, e DM não confirmado (61%), quando somente um dos exames estava alterado. Não houve repetição dos resultados dos casos não confirmados. Os casos considerados confirmados apresentaram sensibilidade moderada (54,9%) e especificidade alta (98,1%) para identificar novos casos de diabetes. A especificidade foi ainda maior (99,6%) aos 15 anos de seguimento. Os casos de diabetes confirmados foram significativamente associados à maior incidência de doença cardiovascular e renal do que os casos não confirmados. Os autores concluíram que a confirmação do diagnóstico de DM com dois exames alterados em uma única amostra apresentou alto valor preditivo positivo para subsequente diagnóstico de diabetes e foi fortemente associada a desfechos clínicos, sendo capaz de identificar pacientes em risco.²⁷
R4. Quando indicada a realização de TTGO, É RECOMENDADO o uso de TTGO-1h para diagnóstico de DM2 e detecção de pré-diabetes, por ser superior e mais prático do que o TTGO-2h.
| Classe I | Nível B |
Sumário de evidências:
- Em 1979, o National Diabetes Data Group (NDDG) recomendava valores intermediários de glicemia durante o TTGO-2h (30 min, 1 hora e 1 hora e 30 min) para diagnóstico de DM. Devido à baixa praticidade de execução dessas medidas intermediárias e à observação de que a medida de 2 horas obteve reprodutibilidade e sensibilidade satisfatórias para diagnosticar DM2, os outros pontos da curva de TTGO foram abandonados.²⁸,²⁹ Essa decisão não foi baseada na capacidade de predição de pré-diabetes, futuro DM ou complicações crônicas de DM. Mais recentemente, estudos demonstraram que o TTGO-1h tinha reprodutibilidade semelhante à GJ e ao TTGO-2h³⁰,³¹, além de identificar, de forma similar, pessoas com DM e retinopatia³²,³³ e de ter boa acurácia para identificação de pré-diabetes e predição de evolução para DM2.
- TTGO-1h é superior ao TTGO-2h em detectar indivíduos com risco para desenvolvimento de DM2. Abdul-Ghani e cols avaliaram o perfil glicêmico de 1.611 mexicanos americanos sem diabetes no San Antonio Heart Study, com TTGO. Estes pacientes foram submetidos a uma nova avaliação quanto ao status de DM após 7 a 8 anos de acompanhamento. O TTGO-1h inicial foi superior ao TTGO-2h (e também à GJ) como preditor para o desenvolvimento de DM2.¹,³⁴⁻³⁶
- O TTGO-1h resulta em detecção mais precoce de DM2 e de pré-diabetes, aumentando a possibilidade de intervenção e de redução do risco de complicações. A maioria dos pacientes (74%) atinge o ponto de corte para detecção de DM2 e pré-diabetes primeiro com os parâmetros estabelecidos para o TTGO-1h, em relação ao TTGO-2h (35). Em um estudo com 201 nativos americanos, a glicemia ≥ 209 mg/dl no TTGO-1h foi atingida antes do que a glicemia ≥ 200 mg/dl no TTGO-2h (mediana de 1 ano antes), em pessoas que foram diagnosticadas com DM2. A detecção de pré-diabetes com glicemia ≥ 155 mg/dl no TTGO-1h também foi mais precoce do que a identificação de glicemia ≥ 140 mg/dl no TTGO-2h (mediana 1,6 anos a menos).³⁷
- Um estudo multicêntrico combinando as populações do estudo Botnia (n=2603) e Malmo Preventive Project (MPP) (n=2.386), identificou o TTGO-1h como o melhor preditor de DM2 entre 14 índices derivados do TTGO em um período de acompanhamento de 5-23,5 anos, respectivamente.³⁸
- Com base nesses estudos e no fato de que o exame de TTGO-1h é mais curto que o TTGO-2h, proporcionando maior praticidade e potencial vantagem econômica, o comitê de experts da IDF recomendou seu uso preferencial para rastreamento e diagnóstico de DM2. ¹,²³
R5. No TTGO-1h, É RECOMENDADO utilizar, como ponto de corte para diagnóstico de DM2, a glicemia maior ou igual a 209 mg/dl; e, para detecção de pré-diabetes, glicemia maior ou igual a 155 mg/dl.
| Classe I | Nível B |
Sumário de evidências:
- Uma metanálise com 35.551 indivíduos de múltiplas etnias demonstrou que o TTGO-1h ≥ 209 mg/dl é equivalente ao TTGO-2h ≥ 200 mg/dl para diagnóstico de DM. Com base neste trabalho, a IDF passou a considerar o TTGO-1h ≥ 209 mg/dl como um critério para o diagnóstico de DM.²³
- Uma associação direta entre a glicose no TTGO-1h ≥ 155 mg/dl e a incidência de DM2 em anos subsequentes foi observada em vários estudos prospectivos, como o San Antonio Heart Study, GHO e Botnia, que avaliaram 1.611, 853 e 2.603 indivíduos, respectivamente. Embora alguns estudos tenham utilizado outros pontos de corte para predição de DM2 no TTGO-1h, o valor de 155 mg/dl representa um ponto adequado em termos de sensibilidade e especificidade para predição de DM2 em populações de etnias diversas.¹
- Fiorentino e cols avaliaram 392 indivíduos sem DM em dois momentos: no período basal, com TTGO-1h e clamp euglicêmico hiperinsulinêmico, e após 5,2 ± 0,9 anos. A razão de risco para desenvolvimento de DM nos indivíduos com glicose ≥ 155 mg/dl no TTGO-1h foi 4,02 (IC 95%: 1,06–15,26), possivelmente por menor sensibilidade à insulina e disfunção de células beta.³⁹
RASTREAMENTO PARA DIABETES MELLITUS TIPO 2 (DM2)
R6. É RECOMENDADO o rastreamento de DM2 para todos os indivíduos com idade maior ou igual a 35 anos e para adultos com sobrepeso ou obesidade, que tenham pelo menos um fator de risco adicional para DM2 (Quadro 2), e ou que apresentem FINDRISC alto ou muito alto.
| Classe I | Nível B |
Sumário de evidências:
- Um estudo transversal realizado nos Estados Unidos (National Health and Nutrition Examination Survey) demostrou que o número de pessoas necessárias para rastreamento (NNR) é significativamente maior em menores de 35 anos do que a partir desta idade, em adultos com idade de 31 a 80 anos. Neste estudo, a frequência de rastreamento positivo (diagnóstico de DM) e NNR em rastreamento universal foram comparadas por faixas etárias (com intervalo de 5 anos cada). As diferenças entre as faixas etárias foram mais evidentes entre os grupos de 30 a 34 anos e de 35 a 39 anos (prevalência de 1,3% e NNR de 80 na faixa etária de 30 a 34 anos vs 3,4% e NNR de 31 na faixa etária de 35 a 39 anos).⁴⁰
- A prevalência de DM é significativa aos 35 anos e aumenta com a idade. No Brasil, de acordo com dados do VIGITEL 2023, a prevalência de DM de acordo com a faixa etária é de 0,5%, 2,4%, 5,5%, 10,4%, 22,4% e 30,3% para as faixas de 18 a 24 anos, 25 a 34 anos, 35 a 44 anos, 45 a 54 anos, 56 a 64 anos e ≥ 65 anos, respectivamente.⁴¹
- Existe associação entre pré-diabetes e risco cardiovascular. Um estudo com 505 indivíduos com idade entre 19 anos e 88 anos demonstrou que os níveis de HbA1c e GJ característicos de pré-diabetes estão associados a maior risco cardiovascular, o que justifica o rastreamento para identificar indivíduos que devem ser alvo de avaliação e intervenção.⁴²
- A realização do rastreamento tem bom custo-benefício. Sob a perspectiva do sistema de saúde americano, considerando várias premissas, em adultos com média de idade de 48 anos e de IMC de 30 Kg/m2, o custo do rastreamento e intervenção com metformina e modificação de estilo de vida nos casos identificados de DM e pré-diabetes, em 3 anos, seria menor do que o custo de não realizar o rastreamento e não diagnosticar pessoas com DM.⁴³
- A presença de fatores de risco adicionais aumenta o risco de DM2. Uma subanálise do estudo STAND avaliou, através de TTGO e HbA1c, a prevalência de DM2 e pré-diabetes em 193 adultos jovens entre 18 anos e 40 anos, com idade mediana de 33,8 anos, IMC mediano de 33,9 Kg/m2 e um fator de risco adicional. As prevalências de DM2 e pré-diabetes foram de 4,7% e 18,1%, respectivamente.⁴⁴
- Questionários para avaliação de risco de DM2 são úteis para identificar as pessoas com < 35 anos que mais se beneficiariam do rastreamento. O Ministério da Saúde do Brasil recomenda a utilização do Finnish Diabetes Risk Score (FINDRISC) para estratificação de risco de desenvolvimento de DM2. O FINDRISC tem pontuação máxima de 26 e classifica os indivíduos em níveis de risco: baixo (< 7 pontos); levemente elevado (entre 7 e 11 pontos); moderado (12-14 pontos); alto (15-20 pontos) e muito alto (mais de 20 pontos).⁴⁵,⁴⁶ O escore FINDRISC está pormenorizado na Figura 1, e pode ser encontrado no site da SBD através do link https://diabetes.org.br/calculadoras/findrisc.
- O rastreamento de DM2 permite detecção precoce da doença, o que pode reduzir o risco de suas complicações crônicas. Além disso, identifica pessoas com maior propensão para desenvolvimento de DM, que poderão se beneficiar de estratégias eficazes de prevenção da doença, como modificações do estilo de vida.
- O risco de DM2 é maior em minorias étnicas. Entretanto, julgamos inadequado considerar a etnia como um dos fatores de risco a serem contabilizados entre os critérios de rastreamento na população brasileira, considerando que ela é etnicamente miscigenada.
Quadro 2. Indicações de rastreamento para DM2
| Indicações para rastreamento de DM2 em adultos assintomáticos² |
|
OBS: Há situações em que DM secundário deve ser rastreado (vide recomendações R11 e R12).
Figura 1. Questionário FINDRISC para avaliação do risco de DM2⁴⁵,⁴⁶

R7. É RECOMENDADO utilizar a glicemia de jejum e/ou a HbA1c como primeiros testes de rastreamento de DM2. A escolha deve ser baseada na disponibilidade local para realização da dosagem de HbA1c.
| Classe I | Nível C |
Sumário de evidências:
- As dosagens de GJ e de HbA1c são mais práticas do que a realização de TTGO. Além disso, iniciar o rastreamento com GJ e/ou HbA1c evita submeter pessoas que teriam testes positivos a uma sobrecarga de glicose desnecessária.
- Idealmente, as medidas de GJ e HbA1c devem ser realizadas simultaneamente para rastreamento inicial de DM2, em locais com viabilidade financeira e disponibilidade técnica total. Medições simultâneas da GJ e HbA1c são convenientes, pois a triagem do DM pode ser realizada através da obtenção de uma única amostra de sangue em jejum. Ainda assim, convém ressaltar que, comparada com a medida da GJ, a medida da HbA1c requer equipamentos e reagentes de maior custo, além de padronização da metodologia em larga escala e execução por profissional treinado.⁴⁷
- Os critérios para diagnóstico de DM nem sempre são concordantes.⁴⁸ GJ e HbA1c são consideradas medidas complementares entre si, pois os indivíduos podem ter níveis elevados de apenas um ou de ambos os biomarcadores.⁴⁹ A GJ reflete a homeostase da glicose no estado pós-absortivo e a HbA1c reflete a glicemia média ao longo de período de 2–3 meses. Apesar dessas diferenças, o valor da GJ está fortemente correlacionado com a HbA1c.⁴⁹
- Em uma revisão sistemática de 117 estudos de base populacional, evidenciou-se uma taxa de concordância de 29-39% entre a GJ e HbA1c para o diagnóstico do DM em diversas regiões do mundo, incluindo o Brasil.⁵⁰
- Em situações em que a HbA1c não pode ser utilizada devido a fatores que interferem na sua acurácia (Quadro 3) e em locais com viabilidade financeira e disponibilidade técnica parciais, a dosagem isolada de GJ é aceita para rastreamento inicial de DM2 (Tabela 2 e Figura 2).
Tabela 2. Rastreamento inicial do DM em indivíduos assintomáticos no Brasil
| Locais com viabilidade financeira e disponibilidade técnica total | Locais com viabilidade financeira e disponibilidade técnica parciais |
| Medida simultânea da glicemia plasmática e HbA1c em amostra de sangue obtida em jejum de 8 a 12 horas | Medida da glicemia plasmática em amostra de sangue obtida em jejum de 8 a 12 horas |
Quadro 3. Situações clínicas onde podem ocorrer incongruências na determinação da HbA1c²⁵,²⁶
| Situações propensas a incongruências na HbA1c |
|
R8. Em adultos com pré-diabetes, definido previamente por glicemia de jejum e HbA1c, É RECOMENDADO a realização adicional do TTGO-1h para diagnóstico de casos de DM2 não anteriormente detectados (se maior ou igual a 209 mg/dl) ou para predizer risco futuro de DM2 (se maior ou igual a 155 mg/dl e menor do que 209 mg/dl).
| Classe I | Nível B |
Sumário de evidências:
- TTGO pode detectar casos adicionais de DM não identificados pelos demais métodos. Das pessoas com DM identificado pelo TTGO-2h, 31% apresentavam GJ normal e 20% apresentavam GJ alterada. Nestes indivíduos, foi identificado maior risco de morte prematura (razão de risco de 1,8 em homens e 2,6 em mulheres).⁵¹ A sensibilidade da HbA1c para detecção de DM diagnosticado por TTGO é de 47-67%. A realização de TTGO, em indivíduos de alto risco, aumenta a detecção de casos de DM.¹⁴
- O TTGO-1h foi comparado com outros marcadores para predição de DM2.⁵² No estudo Botnia, TTGO-1h foi capaz de predizer progressão para DM2 de forma mais precisa do que a GJ e TTGO-2h, com sensibilidade de 75% e especificidade de 68%. A sensibilidade da GJ e do TTGO-2h foram 55% e 56%, com especificidade de 64% e 73%, respectivamente. Neste estudo, TTGO-1h também superou um modelo de predição de DM2 utilizando múltiplos fatores de risco clínicos e HbA1c.⁵³
- No San Antonio Heart Study, o TTGO-1h teve sensibilidade (75%) superior à GJ (31,6%) e TTGO-2h (45,6%) na predição de DM2, além de maior valor preditivo positivo (45,9%, 41,2% e 39,1%, respectivamente) em um acompanhamento de 7 a 8 anos, com menor especificidade.³⁷
R9. No rastreamento do DM2, se houver glicemia de jejum menor a 100 mg/dl e HbA1c menor que 5,7% em pessoas com 3 ou mais fatores de risco ou FINDRISC alto/muito alto, É RECOMENDADO realizar o TTGO-1h para complementar a investigação de DM e pré-diabetes.
| Classe I | Nível C |
Sumário de evidências:
- Pessoas sem critérios para DM e pré-diabetes, mas com alteração no TTGO-1h, representam um estágio intermediário de disfunção metabólica. No estudo RISC, os indivíduos com GJ e TTGO-2h normais, que apresentavam valores mais elevados de TTGO-1h, apresentaram maior resistência à insulina (RI) e progrediram mais para intolerância à glicose (determinada pelo TTGO-2h) em 3 anos do que os demais.⁵⁴,⁵⁵
- No San Antonio Heart Study, 16,7% dos indivíduos normoglicêmicos, de acordo com GJ e TTGO-2h, mas com TTGO-1h ≥ 155 mg/dl, desenvolveram DM2 em 7 a 8 anos. Neste grupo, o risco anual de DM2 foi significativamente maior do que nos indivíduos com TTGO-1h < 155 mg/dl (2,2% vs 0,39% ao ano).³⁷
- No estudo Israel Study of Glucose Intolerance, Obesity and Hypertension (The Israel GOH Study), 1.970 pessoas sem DM foram acompanhadas prospectivamente para avaliar o risco de DM. Cerca de 20 anos após a avaliação inicial, a razão de risco de desenvolver DM2 e pré-diabetes foram, respectivamente, 4,35 e 1,87 para os participantes com glicose ≥ 155 mg/dl no TTGO-1h.⁵⁶
- A realização do TTGO-1h nos indivíduos com GJ e HbA1c normais, mas com múltiplos fatores de risco, permite identificar aqueles que mais se beneficiarão de medidas para prevenção do DM, como orientação nutricional e atividade física. Isso poderá ser útil para ações individuais ou programas preventivos governamentais.
R10. No rastreamento inicial do DM2, caso haja glicemia de jejum menor que 100 mg/dl e HbA1c menor que 5,7%, em pessoas com menos de 3 fatores de risco, e com FINDRISC baixo a moderado, NÃO É RECOMENDADO realizar testes adicionais para detecção de DM2 ou pré-diabetes.
| Classe III | Nível C |
Sumário de evidências:
- Nas pessoas com baixo risco de DM (< 3 fatores de risco ou FINDRISC baixo/levemente elevado/moderado) e com glicemia de jejum e HbA1c normais, este comitê julgou adequado classificar o perfil glicêmico como normal, levando em consideração o baixo risco de desenvolvimento de DM2.
- Selvin e cols avaliaram o risco de desenvolvimento de DM de acordo com a medida inicial da HbA1c nos participantes da coorte do estudo Atherosclerosis Risk in Communities (ARIC) (n=11.092), com tempo de seguimento médio de 14 anos. Os autores identificaram um risco significativamente mais alto de desenvolvimento de DM subsequente para pessoas com HbA1c a partir de 5,5% e, especialmente, a partir de 6%, com razão de risco para HbA1c <5%, 5 a <5,5%, 5,5% a <6% e 6 a <6,5% para diagnóstico de DM de 0,52 (IC 95%: 0,40-0,69), 1,00 (referência), 1,86 (IC 95%: 1,67-2,08) e 4,48 (IC 95%: 3,92-5,13), respectivamente. A faixa de HbA1c de 5,5 a 5,7% não foi avaliada separadamente neste estudo.⁵⁷
- Em um estudo de coorte retrospectivo com 11.369 indivíduos asiáticos acompanhados por 7 anos, a incidência de DM foi de 2,39% nos indivíduos com GJ < 100 mg/dl. A GJ de 101 mg/dl foi considerada o ponto de corte ideal para diferenciar pessoas que desenvolveram DM ao longo do tempo das demais (103 mg/dl para homens e 99 mg/dl para mulheres).⁵⁸
R11. Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com glicemia de jejum e HbA1c normais, e menos de 3 fatores de risco, ou FINDRISC baixo a moderado, sejam reavaliadas após 3 anos (Tabela 3).
| Classe I | Nível C |
R12. Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas assintomáticas, com glicemia de jejum e HbA1c normais, e 3 ou mais fatores de risco, ou FINDRISC alto/muito alto sejam reavaliadas em 12 meses (Tabela 3).
| Classe I | Nível C |
R13. Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com pré-diabetes sejam reavaliadas após 12 meses (Tabela 3).
| Classe I | Nível C |
R14. Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com apenas um exame laboratorial com critério para DM, sem outros exames alterados, sejam reavaliadas em 6 meses (Tabela 3).
| Classe I | Nível C |
Sumário de evidências: R11 a R14
- O intervalo de três anos para rastreamento subsequente em pessoas com < 3 fatores de risco ou FINDRISC baixo a moderado é sugerido com base em opinião de experts, por permitir que possíveis casos falso-negativos sejam testados novamente antes do desenvolvimento de complicações crônicas da doença e não permaneçam sem diagnóstico.⁵⁹
- O intervalo de 12 meses é sugerido para repetição do rastreamento em pessoas com pré-diabetes ou com resultados de exames laboratoriais normais e ≥ 3 fatores de risco ou FINDRISC alto/muito alto (Figura 2), pois são situações com maior propensão ao desenvolvimento de DM2 nos anos subsequentes (Tabela 3).
- O risco de desenvolvimento de DM2, com base nos resultados de exames iniciais, é contínuo. Apesar da categoria “pré-diabetes” ser geralmente avaliada como um grupo uniforme, trata-se de um grupo heterogêneo, no qual há diferenças de risco de progressão para DM2. Indivíduos com pré-diabetes cujos valores de HbA1c, GJ ou TTGO estejam mais próximos dos pontos de corte que caracterizam o diagnóstico de DM apresentam maior propensão ao desenvolvimento dessa condição ao longo do tempo do que os demais. Dessa forma, uma reavaliação mais precoce, em 6 a 12 meses, pode ser considerada nas pessoas com pré-diabetes e exames de rastreio muito próximos dos pontos de corte para o diagnóstico de DM (Tabela 3).
- Sugere-se o intervalo de 6 meses para reavaliação de indivíduos com apenas um critério para DM e com outros exames dentro da normalidade, para promover diagnóstico oportuno e intervenções adequadas (Tabela 3).
Tabela 3. Frequência de repetição do rastreamento de DM2 conforme a situação clínica apresentada na investigação inicial
| Situação clínica | Frequência de rastreamento de DM2 |
| Pessoas sem sintomas e com apenas um exame preenchendo critérios para DM. | Semestral |
| Pessoas com pré-diabetes confirmada. | Anual |
| Pessoas com exames normais e ≥ 3 fatores de risco. | Anual |
| Pessoas com exames normais e FINDRISC alto/muito alto. | Anual |
| Pessoas com exames normais e < 3 fatores de risco. | Trianual |
| Pessoas com exames normais e FINDRISC baixo/moderado. | Trianual |
Figura 2. Algoritmo para rastreamento de DM2
O TTGO deve ser feito preferencialmente com glicemia 1 hora após (TTGO-1h). TTGO-2h permanece como uma opção alternativa de teste diagnóstico.
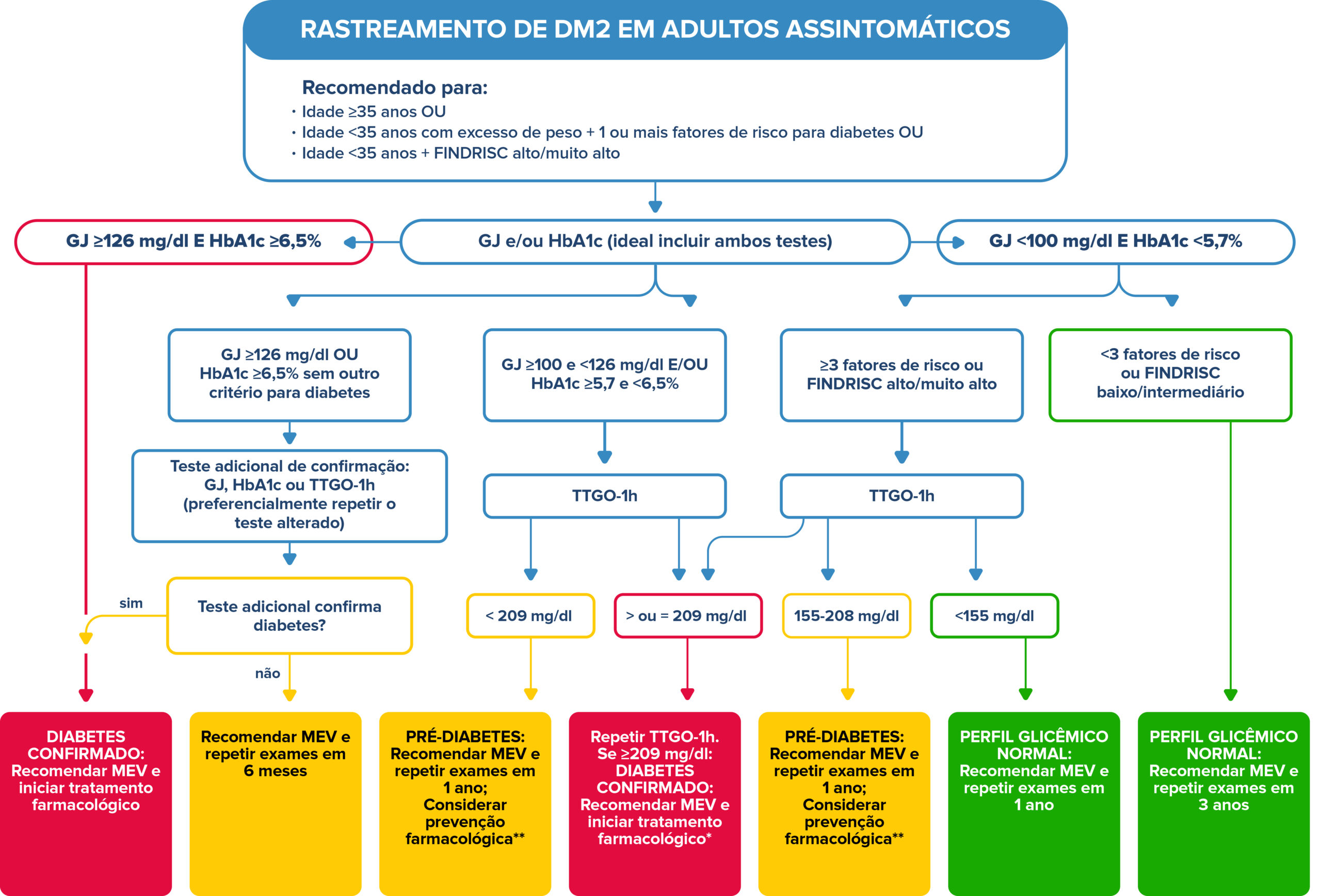
R15. É RECOMENDADO fazer rastreamento para DM nos indivíduos que apresentam comorbidades relacionadas ao diabetes secundário, como endocrinopatias e doenças pancreáticas, com infecção pelo vírus da imunodeficiência humana (HIV) ou na vigência de condições frequentemente associadas ao DM, como a doença hepática esteatótica metabólica (DHEM).
| Classe I | Nível C |
Sumário de evidências:
- Dada a importância de se tratar a hiperglicemia, este painel considera que, na vigência de causas de diabetes secundário, o rastreamento de DM seja realizado, pelo potencial impacto no tratamento da doença de base e na prevenção das complicações associadas à hiperglicemia.
- Fatores associados à infecção pelo HIV ou ao seu tratamento corroboram a indicação de rastreamento do DM.⁶⁰ Alguns agentes antirretrovirais usados para o tratamento da infecção pelo HIV, como inibidores da integrase ou inibidores da protease, são associados à RI e ao aumento da incidência de DM2.
- No estudo Multicenter AIDS Cohort Study (MACS),⁶¹ a incidência de DM foi de 4,7 casos por 100 pessoas/ano vs. 1,4 casos por 100 pessoas/ano entre homens sem HIV, em quatro anos de observação. Ainda não está claro se medicamentos antirretrovirais mais novos também são associados ao aumento do risco de DM.⁶¹
Nota importante 4: Doença hepática esteatótica metabólica (DHEM)
- A Sociedade Brasileira de Diabetes recomenda o rastreio da DHEM em todos os indivíduos com DM2, conforme diretriz específica.⁶² A presença da DHEM está associada ao desenvolvimento de DM2,⁶³,⁶⁴ e a presença de DM2 aumenta o risco de progressão da DHEM para formas mais graves (esteatohepatite, diferentes graus de fibrose, cirrose e hepatocarcinoma).⁶⁵
R16. É RECOMENDADO que pacientes que irão iniciar medicações com potencial efeito hiperglicemiante, como glicocorticoides ou antipsicóticos, sejam rastreados para DM antes e após o início do tratamento.
| Classe I | Nível C |
Sumário de evidências:
- Os fatores de risco descritos para hiperglicemia induzida pelo uso de glicocorticoide são: uso de doses mais altas (prednisolona > 20 mg/dia, hidrocortisona > 50 mg/dia, dexametasona > 4 mg/dia), longa duração de tratamento, idade avançada, IMC elevado, intolerância à glicose prévia, história de diabetes gestacional, história anterior de hiperglicemia induzida por glicocorticoide, história familiar de DM, HbA1c ≥ 6%.⁶⁶ A monitorização dos níveis de HbA1c mostrou ser importante na detecção do diabetes induzido por glicocorticoide.⁶⁷
- O uso de antipsicóticos tem sido associado ao risco de DM através de mecanismos diretos (alteração da sensibilidade e da secreção de insulina) ou indiretos (ganho de peso). Os fármacos mais associados a esse risco são: clorpromazina (primeira geração), clozapina, olanzapina, quetiapina e risperidona (segunda geração).⁶⁸
R17. É RECOMENDADO realizar triagem de DM2 em crianças e adolescentes a partir de 10 anos de idade ou após o início da puberdade, quando houver sobrepeso/obesidade e pelo menos um fator de risco adicional para DM2 (Quadro 4).
| Classe I | Nível B |
Sumário de evidências:
- A prevalência de diabetes nos anos de 2001 e 2009 foi avaliada em um estudo de base populacional, incluindo jovens com idade entre 10 anos e 19 anos de cinco centros nos EUA. Em 2001 e em 2009, a prevalência de DM2 foi de 0,34/1.000 em 1,7 milhão de jovens e de 0,46/1.000 em 1,8 milhão de jovens na mesma população, respectivamente. Em 2009, a prevalência de DM2 em jovens foi de 0,17/1.000 caucasianos, 0,79/1.000 hispânicos, 1,06/1.000 negros e 1,2/1.000 ameríndios. De 2001 para 2009, a prevalência de DM2 aumentou em 30,5%.⁶⁹ A prevalência de DM2 e de pré-diabetes no Brasil, de acordo com dados do estudo ERICA (Estudo dos Riscos Cardiovasculares em Adolescentes), foi de 3,3% e de 22% em 37.854 adolescentes de 12 a 17 anos de idade, respectivamente.⁷⁰
- O DM2 em crianças e adolescentes é caracterizado por RI e diminuição da secreção de insulina, como ocorre em adultos. O aumento da prevalência de DM2 nessa faixa etária está fortemente associado à obesidade, especialmente em meninas.⁷¹ Aproximadamente 70% a 90% dos pacientes acometidos são obesos, e 38% apresentam obesidade grave. A obesidade e a história familiar parecem ter efeito aditivo no risco de desenvolvimento da doença.⁷² No estudo ERICA, os adolescentes com obesidade apresentaram 59% mais chance de terem DM2.⁷⁰
- O desenvolvimento de RI também é associado a fatores genéticos e à etnia, com sensibilidade à insulina 30% menor em afroamericanos do que em caucasianos, o que explica a maior prevalência de DM2 nessa população.⁷³
- Mais de 75% das crianças e adolescentes com DM2 geralmente têm pelo menos um dos parentes de primeiro ou de segundo grau afetados.⁷⁴ Indivíduos com sobrepeso que tenham irmãos jovens com DM2 têm risco quatro vezes maior de intolerância à glicose do que outras crianças com sobrepeso sem DM2. Isso evidencia a necessidade de uma abordagem preventiva específica para esse grupo de alto risco.⁷⁵ A presença de baixo peso ao nascer também aumenta em sete vezes o risco de RI na vida adulta.⁷⁶
- Crianças com DM2 são geralmente assintomáticas ou oligossintomáticas por longos períodos, o que justifica a necessidade de rastreamento para DM em indivíduos de alto risco. Cerca de 50% dos casos são encaminhados a um serviço especializado, em virtude de glicosúria ou hiperglicemia em exame de rotina. Além disso, 30% dos pacientes apresentam poliúria, polidipsia leve e emagrecimento discreto. Alguns pacientes podem ter história de monilíase vaginal.⁷⁷ A acantose nigricans está presente em quase 90% dessas crianças⁷⁸, e sinais da síndrome dos ovários policísticos estão presentes em 26% das meninas.⁷⁹
- A média de idade dos jovens ao diagnóstico do DM2 é de aproximadamente 13 anos, coincidindo com o período de maior RI. No maior estudo sobre DM2 em jovens (Treatment Options for Type 2 Diabetes in Adolescents and Youth – TODAY), 65% dos pacientes com DM2 eram do sexo feminino, com média de idade de 14 anos; estavam no estágio III da classificação de Tanner, escore-Z do IMC = 2,15; história familiar de DM positiva em 89,4%; 26,3% apresentavam pressão arterial ≥ percentil 90.⁷²
- O risco de DM2 em adolescentes e crianças é maior em minorias étnicas nos Estados Unidos. Entretanto, como a população brasileira é etnicamente miscigenada, não julgamos adequado considerar a etnia como um dos fatores de risco a serem contabilizados entre os critérios de rastreamento de DM2 em crianças e adolescentes de nossa população.
- Em adolescentes com DM2, há rápida deterioração da função das células β, superior à observada em adultos, o que exige cuidado adicional na seleção das terapias farmacológicas para essas pessoas.⁸⁰,⁸¹
Quadro 4. Critérios para rastreamento de DM2 em crianças e adolescentes assintomáticos
| Critérios para rastreamento de DM2 em crianças e adolescentes assintomáticos² |
|
RASTREAMENTO NO DIABETES MELLITUS TIPO 1 (DM1)
R18. O rastreamento com dosagem de autoanticorpos PODE SER CONSIDERADO em familiares de primeiro grau de pessoas com DM1, visando reduzir o risco de cetoacidose ao diagnóstico, fornecer educação em diabetes, selecionar candidatos para participação em protocolos de pesquisa para prevenção do DM1 fase 3 e para início do uso de medicações imunomoduladoras aprovadas por agências reguladoras com objetivo de atrasar DM1 fase 3.
| Classe IIb | Nível C |
Sumário de evidências:
- O risco de DM1 é aumentado em parentes de primeiro grau de pessoas com essa condição.⁸² Entretanto, a maioria das pessoas com DM1 não apresenta história familiar positiva para a doença.⁸³
- O desenvolvimento do DM1 pode ser dividido em fases, conforme indicado no quadro 4. Com base nos conhecimentos adquiridos acerca da evolução da história natural do DM1, Breakthough T1D (antiga Juvenile Diabetes Research Foundation ou JDRF) e International Society for Pediatric and Adolescent Diabetes (ISPAD) sugerem identificar pacientes com múltiplos anticorpos positivos, com ou sem hiperglicemia, como pessoas com DM1, de acordo com a classificação descrita no quadro 5⁸⁴, o que é corroborado pela SBD.
- A presença de autoanticorpos associados ao DM autoimune (antidescarboxilase do ácido glutâmico ou anti-GAD, anti-tirosina fosfatase ou anti-IA2, antitransportador de zinco ou anti-ZnT8 e anti-insulina) identifica indivíduos com risco aumentado de desenvolvimento de DM1 fase 3, tanto em parentes de 1º grau de pessoas com DM1 quanto na população geral. Em estudo realizado com coortes pediátricas na Finlândia, Alemanha e Estados Unidos, a presença de dois ou mais anticorpos foi associada ao risco de desenvolvimento de DM1 fase 3 de 69,5% em dez anos e 84% em quinze anos. O risco da presença de um anticorpo foi de 14,5% em dez anos.⁸⁵ O risco de desenvolvimento de DM1 fase 3 aumenta conforme o aumento do número de autoanticorpos.⁸⁵⁻⁸⁷
- O rastreamento pode permitir identificar potenciais candidatos à inclusão em estudo clínico destinado à prevenção ou atraso do DM1 fase 3 ou ao uso de medicações imunomoduladoras aprovadas por agências reguladoras. Herold et al demonstraram benefícios com uso de teplizumab nesses indivíduos. Em um estudo de fase 2, duplo-cego e randomizado, com 76 parentes de pacientes com DM1 sem doença clínica, porém sob alto risco de desenvolvê-la, o uso de teplizumab mostrou-se associado a um diagnóstico de DM1 mais tardio (mediana de 48,4 meses) em comparação ao grupo placebo (mediana de 24,4 meses). O uso de teplizumab é aprovado pelo FDA para pessoas com DM 1 em fase 2 a partir de 8 anos de idade, visando atrasar a evolução para o DM1 fase 3.⁸⁸
- Ainda não há, no Brasil, nenhuma medição comprovadamente eficaz disponível para atraso de DM1 fase 3 em pessoas com fase 1 ou 2 da doença.
- A cetoacidose diabética é uma condição que traz risco de morte. Rastreamento de DM1 reduz a frequência de cetoacidose ao diagnóstico, o que pode ter impacto a longo prazo no controle glicêmico e no risco de complicações do DM.⁸⁹,⁹⁰
- Embora alguns estudos tenham descrito um risco de impacto psicológico negativo pela constatação de anticorpos positivos em programas de rastreamento, este efeito parece ser transitório. Por outro lado, a ausência de anticorpos positivos ocorre na maioria dos casos e é tranquilizadora para as famílias de pessoas com DM1. A detecção de anticorpos positivos pode permitir educação em diabetes e ajuste psicossocial das famílias acometidas.⁹¹
Nota importante 5: Rastreamento para DM1 em fase pré-clínica
- O rastreamento universal para DM1 em fase pré-clínica tem sido proposto em alguns países, visando atrasar ou prevenir DM1 em estágio 3 e fornecer educação em diabetes antes da necessidade de insulina para evitar aparecimento de cetoacidose diabética.
- São necessárias estratégias de rastreamento para DM1 em fases pré-clínicas na população. Entretanto, ainda não há dados suficientes para recomendar o rastreamento universal no Brasil, levando em conta o alto custo, a incidência da doença no país e a ausência de medicações imunomoduladoras aprovadas pela ANVISA.
Quadro 5. Fases do diabetes mellitus tipo 1
| Fase | Características |
| Fase 1* | 2 ou mais anticorpos positivos, porém sem alterações glicêmicas; assintomático |
| Fase 2* | 2 ou mais anticorpos positivos, com disglicemia leve, porém sem critérios para diabetes; assintomático |
| Fase 3 | Anticorpos positivos, e hiperglicemia com critérios para diabetes; sintomático |
*Fases pré-clínicas
Nota importante 6: Rastreamento de DM1 com autoanticorpos
- Durante o rastreamento para DM1, caso haja positividade de um ou mais autoanticorpos, a repetição do teste deve ser realizada, para confirmar a positividade.
- Acompanhamento clínico é indicado para todas as pessoas com autoanticorpos associados a DM autoimune positivos, que não preencham critérios de diagnóstico para DM. Nesses casos, é mandatório fornecer informações sobre sintomas e sinais de DM e de cetoacidose diabética, bem como proceder em caso de suspeita.
- Nos indivíduos com um único autoanticorpo positivo, sem anormalidades glicêmicas, a repetição periódica de todos os autoanticorpos deve ser realizada, para identificar se há DM1 em fase pré-clínica. Caso haja dois ou mais autoanticorpos positivos, a avaliação metabólica deve ser realizada, com dosagem de HbA1c, glicemia de jejum e/ou TTGO-2h, para caracterizar a presença de DM1 fase 1 ou fase 2.⁹²
- Como ainda não há intervenções modificadoras de curso da doença aprovadas no Brasil, é incerta a frequência ideal de repetições destes testes.
- Crianças com menos de 3 anos necessitam de acompanhamento mais frequente do perfil glicêmico, devido ao risco de progressão mais rápida para a fase 3.
Tabela de Recomendações
| RECOMENDAÇÕES | CLASSE | NÍVEL |
| R1 – É RECOMENDADO utilizar, como critérios de diagnóstico de DM, a glicemia de jejum maior ou igual a 126 mg/dl, a HbA1c maior ou igual a 6,5%, a glicemia no TTGO-1h maior ou igual a 209 mg/dl ou a glicemia no TTGO- 2h maior ou igual a 200 mg/dl. Se somente um exame estiver alterado, este deverá ser repetido para confirmação. | I | C |
| R2 – Na presença de sintomas típicos de hiperglicemia ou crise hiperglicêmica, É RECOMENDADO que o diagnóstico seja estabelecido quando houver glicemia plasmática ao acaso ≥ 200 mg/dl. | I | C |
| R3 – É RECOMENDADO estabelecer o diagnóstico de DM se houver GJ ≥ 126 mg/dl e HbA1c ≥ 6,5% em uma mesma amostra de sangue. | I | B |
| R4 – Quando indicada a realização de TTGO, É RECOMENDADO o uso de TTGO-1h para diagnóstico de DM2 e detecção de pré-diabetes, por ser superior e mais prático do que o TTGO-2h. | I | B |
| R5 – É RECOMENDADO utilizar como ponto de corte de glicemia no TTGO-1h ≥ 209 mg/dl para diagnóstico de DM2 e ≥ 155 mg/dl para detecção de pré-diabetes. | I | C |
| R6 – É RECOMENDADO o rastreamento de DM2 para todos os indivíduos com idade ≥ 35 anos e para os demais adultos com sobrepeso/obesidade que tenham pelo menos um fator de risco adicional para DM2 (Quadro 2) e/ou que apresentem FINDRISC alto/muito alto. | I | B |
| R7 – É RECOMENDADO utilizar GJ e/ou HbA1c como primeiros testes de rastreamento de DM2. A escolha entre solicitar um destes testes ou ambos deve ser baseada na disponibilidade local para realização da dosagem de HbA1c. | I | C |
| R8 – Em adultos com pré-diabetes, definido previamente por glicemia de jejum e HbA1c, É RECOMENDADO a realização adicional do TTGO-1h para diagnóstico de casos de DM2 não anteriormente detectados (se maior ou igual a 209 mg/dl) ou para predizer risco futuro de DM2 (se maior ou igual a 155 mg/dl e menor do que 209 mg/dl). | I | B |
| R9 – No rastreamento do DM2, se houver GJ < 100 mg/dl e HbA1c < 5,7% em pessoas com 3 ou mais fatores de risco ou FINDRISC alto/muito alto, É RECOMENDADO realizar o TTGO-1h para complementar a investigação de DM e pré-diabetes. | I | C |
| R10 – No rastreamento inicial do DM2, caso haja GJ < 100 mg/dl e HbA1c < 5,7% em pessoas com menos de 3 fatores de risco e FINDRISC baixo a moderado, NÃO É RECOMENDADO realizar testes adicionais para detecção de DM2 ou pré-diabetes. | III | C |
| R11 – Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com exames laboratoriais normais, menos de 3 fatores de risco ou FINDRISC baixo a moderado sejam reavaliadas após 3 anos (Tabela 3). | I | C |
| R12 – Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas assintomáticas, com exames laboratoriais normais e ≥ 3 fatores de risco OU FINDRISC alto/muito alto sejam reavaliadas em 12 meses (Tabela 3). | I | C |
| R13 – Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com pré-diabetes sejam reavaliadas após 12 meses (Tabela 3). | I | C |
| R14 – Após o rastreamento inicial para DM2, É RECOMENDADO que pessoas com apenas um exame laboratorial com critério para DM, sem outros exames alterados (diabetes iminente), sejam reavaliadas em 6 meses (Tabela 3). | I | C |
| R15 – É RECOMENDADO fazer rastreamento para DM nos indivíduos que apresentam comorbidades relacionadas ao diabetes secundário, como endocrinopatias e doenças pancreáticas, com infecção pelo vírus da imunodeficiência humana (HIV) ou na vigência de condições frequentemente associadas ao DM, como a doença hepática esteatótica. | I | C |
| R16 – É RECOMENDADO que pacientes que irão iniciar medicações com potencial efeito hiperglicemiante, como glicocorticoides ou antipsicóticos, sejam rastreados para DM antes e após o início do tratamento. | I | C |
| R17 – É RECOMENDADO realizar triagem de DM2 em crianças e adolescentes a partir de 10 anos de idade ou após o início da puberdade, com sobrepeso/obesidade e pelo menos um fator de risco para DM2 (Quadro 4). | I | B |
| R18 – O rastreamento com dosagem de autoanticorpos PODE SER CONSIDERADO em familiares de primeiro grau de pessoas com DM1, visando reduzir o risco de cetoacidose ao diagnóstico, fornecer educação em diabetes, selecionar candidatos para participação em protocolos de pesquisa para prevenção do DM1 fase 3 e para início do uso de medicações imunomoduladoras aprovadas por agências reguladoras com objetivo de atrasar DM1 fase 3. | IIb | C |
Referências
- Bergman M, Manco M, Satman I, Chan J, Schmidt MI, Sesti G, et al. International Diabetes Federation Position Statement on the 1-hour post-load plasma glucose for the diagnosis of intermediate hyperglycaemia and type 2 diabetes. Diab Res Clin Pract. 2024 Mar;209:111589.
- American Diabetes Association Professional Practice Committee. 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes-2024. Diabetes Care. 2024 Jan 1;47(Suppl 1):S20-S42. doi: 10.2337/dc24-S002.
- Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 2003 Jan; 26(Suppl 1):S5-S20.
- Martínez-Vizcaíno V, Cavero-Redondo I, Álvarez-Bueno C, Rodríguez-Artalejo F. The accuracy of diagnostic methods for diabetic retinopathy: a systematic review and meta-analysis. PLoS One. 2016 Apr 28;11(4):e0154411. doi: 10.1371/journal.pone.0154411.
- Ito C, Maeda R, Ishida S, Harada H, Inoue N, Sasaki H. Importance of OGTT for diagnosing diabetes mellitus based on prevalence and incidence of retinopathy. Diabetes Res Clin Pract. 2000 Aug;49(2–3):181–6.
- McCance DR, Hanson RL, Charles MA, Jacobsson LTH, Pettitt DJ, Bennett PH, et al. Comparison of tests for glycated haemoglobin and fasting and two-hour plasma glucose concentrations as diagnostic methods for diabetes. BMJ. 1994;308:1323–8.
- Zhang X, Gregg EW, Williamson DF, Barker LE, Thomas W, Bullard KM, et al. A1C level and future risk of diabetes: a systematic review. Diabetes Care. 2010 Jul;33(7):1665-73. doi: 10.2337/dc09-1939.
- Engelgau MM, Thompson TJ, Herman WH, Boyle JP, Aubert RE, Kenny SJ, et al. Comparison of fasting and 2-hour glucose and HbA1c levels for diagnosing diabetes: diagnostic criteria and performance revisited. Diabetes Care. 1997;20:785–91.
- Colagiuri S, Lee CMY, Wong TY, Balkau B, Shaw JE, Borch-Johnsen K, et al. Glycemic thresholds for diabetes-specific retinopathy: implications for diagnostic criteria for diabetes. Diabetes Care. 2011;34(1):145–50.
- Sabanayagam C, Liew G, Tai ES, Shankar A, Lim SC, Subramaniam T, et al. Relationship between glycated haemoglobin and microvascular complications: Is there a natural cut-off point for the diagnosis of diabetes? Diabetologia. 2009 Jul;52(7):1279–89.
- Massin P. Hemoglobin A1c and fasting plasma glucose levels as predictors of retinopathy at 10 years: The French DESIR Study. Arch Ophthalmol. 2011 Feb 14;129(2):188.
- Emerging Risk Factors Collaboration; Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010 Jun 26;375(9733):2215-22.
- Gillett MJ. International Expert Committee report on the role of the A1c assay in the diagnosis of diabetes: Diabetes Care. 2009;32(7):1327–34.
- Selvin E, Steffes MW, Gregg E, Brancati FL, Coresh J. Performance of A1C for the classification and prediction of diabetes. Diabetes Care. 2011 Jan;34(1):84-9. doi: 10.2337/dc10-1235.
- Kumar PR, Bhansali A, Ravikiran M, Bhansali S, Dutta P, Thakur JS, et al. Utility of glycated hemoglobin in diagnosing type 2 diabetes mellitus: a community-based study. J Clin Endocrinol Metab. 2010 Jun 1;95(6):2832–5.
- Kramer CK, Araneta MRG, Barrett-Connor E. A1C and diabetes diagnosis: The Rancho Bernardo Study. Diabetes Care. 2010 Jan 1;33(1):101–3.
- Bennett CM, Guo M, Dharmage SC. HbA1c as a screening tool for detection of type 2 diabetes: a systematic review. Diabet Med. 2007 Abr;24(4):333–43.
- do Vale Moreira NC, Montenegro RM, Meyer HE, Bhowmik B, Mdala I, Siddiquee T, et al. Glycated hemoglobin in the diagnosis of diabetes mellitus in a semi-urban Brazilian population. Int J Environ Res Public Health. 2019 Sep 26;16(19):3598.
- Cavagnolli G, Comerlato J, Comerlato C, Renz PB, Gross JL, Camargo JL. HbA1c measurement for the diagnosis of diabetes: is it enough?: HbA1c test and diabetes diagnosis. Diabet Med. 2011 Jan;28(1):31–5.
- Kaur G, Lakshmi PVM, Rastogi A, Bhansali A, Jain S, Teerawattananon Y, et al. Diagnostic accuracy of tests for type 2 diabetes and prediabetes: A systematic review and meta-analysis. PLoS One. 2020 Nov 20;15(11):e0242415. doi: 10.1371/journal.pone.0242415.
- Ziemer DC, Kolm P, Weintraub WS, Vaccarino V, Rhee MK, Twombly JG, et al. Glucose-independent, black-white differences in hemoglobin A1c levels: a cross-sectional analysis of 2 studies. Ann Intern Med. 2010 Jun 15;152(12):770-7. doi: 10.7326/0003-4819-152-12-201006150-00004.
- Selvin E. Short-term Variability in measures of glycemia and implications for the classification of diabetes. Arch Intern Med. 2007 Jul 23;167(14):1545.
- Ahuja V, Aronen P, Pramodkumar TA, Looker H, Chetrit A, Bloigu AH, et al. Accuracy of 1-hour plasma glucose during the Oral glucose tolerance test in diagnosis of type 2 diabetes in adults: a meta-analysis. Diabetes Care 2021;44(4): 1062–9.
- Barr RG, Nathan DM, Meigs JB, Singer DE. Tests of glycemia for the diagnosis of type 2 diabetes mellitus. Ann Intern Med. 2002;137:263–72
- Gonzalez A, Deng Y, Lane AN, Benkeser D, Cui X, Staimez LR, et al. Impact of mismatches in HbA1c vs glucose values on the diagnostic classification of diabetes and prediabetes. Diabet Med. 2020 Apr;37(4):689-696. doi: 10.1111/dme.14181.
- Selvin E, Wang D, Matsushita K, Grams ME, Coresh J. Prognostic implications of single-sample confirmatory testing for undiagnosed diabetes: a prospective cohort study. Ann Intern Med. 2018 Aug 7;169(3):156.
- Rushforth NB, Bennett PH, Steinberg AG, Miller M. Comparison of the value of the two- and one-hour glucose levels of the oral GTT in the diagnosis of diabetes in Pima Indians. Diabetes. 1975 Jun;24(6):538-46. doi: 10.2337/diab.24.6.538.
- Bartoli E, Fra GP, Carnevale Schianca GP. The oral glucose tolerance test (OGTT) revisited. Eur J Intern Med. 2011 Feb;22(1):8-12. doi: 10.1016/j.ejim.2010.07.008.
- Briker SM, Hormenu T, DuBose CW, Mabundo LS, Chung ST, Ha J, et al. Metabolic characteristics of Africans with normal glucose tolerance and elevated 1-hour glucose: insight from the Africans in America study. BMJ Open Diabetes Res Care. 2020 Jan;8(1):e000837. doi: 10.1136/bmjdrc-2019-000837.
- Kasturi K, Onuzuruike AU, Kunnam S, Shomaker LB, Yanovski JA, Chung ST. Two- vs one-hour glucose tolerance testing: Predicting prediabetes in adolescent girls with obesity. Pediatr Diabetes. 2019 Mar;20(2):154-159. doi: 10.1111/pedi.12803.
- Paddock E, Looker HC, Piaggi P, Knowler WC, Krakoff J, Chang DC. One-Hour Plasma Glucose Compared With Two-Hour Plasma Glucose in Relation to Diabetic Retinopathy in American Indians. Diabetes Care. 2018 Jun;41(6):1212-1217. doi: 10.2337/dc17-1900.
- Saunajoki A, Auvinen J, Saarela V, Uusitalo JJ, Leiviskä I, Keinänen-Kiukaanniemi S, et al. Association of glucose metabolism and retinopathy signs in non-diabetic individuals in midlife-The Northern Finland Birth Cohort 1966 study. PLoS One. 2020 Oct 22;15(10):e0240983. doi: 10.1371/journal.pone.0240983.
- Abdul-Ghani MA, Abdul-Ghani T, Ali N, Defronzo RA. One-hour plasma glucose concentration and the metabolic syndrome identify subjects at high risk for future type 2 diabetes. Diabetes Care. 2008 Aug;31(8):1650-5. doi: 10.2337/dc08-0225.
- Abdul-Ghani MA, Abdul-Ghani T, Stern MP, Karavic J, Tuomi T, Bo I, et al. Two-step approach for the prediction of future type 2 diabetes risk. Diabetes Care 2011;34(9):2108–12.
- Kumpatla S, Parveen R, Stanson S, Viswanathan V. Elevated one hour with normal fasting and 2 h plasma glucose helps to identify those at risk for development of Type2 Diabetes-11 years observational study from South India. Diabetes Metab Syndr 2019;13(4):2733–7.
- Ha J, Chung ST, Bogardus C, Jagannathan R, Bergman M, Sherman AS. One-hour glucose is an earlier marker of dysglycemia than two-hour glucose. Diabetes Res Clin Pract. 2023 Sep;203:110839. doi: 10.1016/j.diabres.2023.110839.
- Alyass A, Almgren P, Akerlund M, Dushoff J, Isomaa B, Nilsson P, et al. Modelling of OGTT curve identifies 1 h plasma glucose level as a strong predictor of incident type 2 diabetes: results from two prospective cohorts. Diabetologia 2015;58(1):87–97.
- Fiorentino TV, Marini MA, Andreozzi F, Arturi F, Succurro E, Perticone M, et al. One-Hour Postload Hyperglycemia Is a Stronger Predictor of Type 2 Diabetes Than Impaired Fasting Glucose. J Clin Endocrinol Metab. 2015 Oct;100(10):3744-51. doi: 10.1210/jc.2015-2573.
- Chung S, Azar KM, Baek M, Lauderdale DS, Palaniappan LP. Reconsidering the age thresholds for type II diabetes screening in the U.S. Am J Prev Med. 2014 Oct;47(4):375-81. doi: 10.1016/j.amepre.2014.05.012.
- Brasil. Vigitel Brasil 2023: vigilância de fatores de risco e proteção para doenças crônicas por inquérito telefônico: estimativas sobre frequência e distribuição sociodemográfica de fatores de risco e proteção para doenças crônicas nas capitais dos 26 estados brasileiros e no Distrito Federal em 2023. Ministério da Saúde, Secretaria de Vigilância em Saúde e Ambiente, Departamento de Análise Epidemiológica e Vigilância de Doenças Não Transmissíveis. Brasília: Ministério da Saúde, 2023. 131 p. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/vigitel_brasil_2023.pdf.
- Jesudason DR, Dunstan K, Leong D, Wittert GA. Macrovascular risk and diagnostic cCriteria for type 2 diabetes: implications for the use of FPG and HbA1c for cost-effective screening. Diabetes Care. 2003 Feb 1;26(2):485–90.
- Chatterjee R, Venkat Narayan KM, Lipscomb J, Phillips LS. Screening adults for pre-diabetes and diabetes may be cost-saving. Diabetes Care. 2010 Jul 1;33(7):1484–90.
- Wilmot EG, Edwardson CL, Biddle SJ, Gorely T, Henson J, Khunti K, et al. Prevalence of diabetes and impaired glucose metabolism in younger ‘at risk’ UK adults: insights from the STAND programme of research. Diabet Med. 2013 Jun;30(6):671–5.
- Lindström J, Tuomilehto J. The diabetes risk score: a practical tool to predict type 2 diabetes risk. Diabetes Care 2003;26:725-31.
- Barim EM, McLellan KCP, Ribeiro RS, Carvalho JAM, Lindstrom J, Tuomilehto J, et al. Tradução e adaptação transcultural para o português brasileiro do Escore Finlandês de Risco de Diabetes (FINDRISC) e avaliação da confiabilidade. Rev Bras Epidemiol 2020;23:E200060. doi: 10.1590/1980-549720200060.
- Little RR, Rohlfing CL. The long and winding road to optimal HbA1c measurement. Clin Chim Acta. 2013 Mar 15;418:63-71. doi: 10.1016/j.cca.2012.12.026.
- Carson AP, Reynolds K, Fonseca VA, Muntner P. Comparison of A1C and fasting glucose criteria to diagnose diabetes among U.S. adults. Diabetes Care. 2010 Jan 1;33(1):95–7.
- Bennett CM, Guo M, Dharmage SC. HbA(1c) as a screening tool for detection of Type 2 diabetes: a systematic review. Diabet Med. 2007 Apr;24(4):333-43. doi: 10.1111/j.1464-5491.2007.02106.x.
- NCD Risk Factor Collaboration (NCD-RisC). Global variation in diabetes diagnosis and prevalence based on fasting glucose and hemoglobin A1c. Nat Med. 2023 Nov;29(11):2885-2901. doi: 10.1038/s41591-023-02610-2.
- DECODE Study Group, on behalf of the European Diabetes Epidemiology Study Group. Will new diagnostic criteria for diabetes mellitus change phenotype of patients with diabetes? Reanalysis of European epidemiological data. DECODE Study Group on behalf of the European Diabetes Epidemiology Study Group. BMJ. 1998 Aug 8;317(7155):371-5. doi: 10.1136/bmj.317.7155.371.
- Peddinti G, Bergman M, Tuomi T, Groop L. 1-hour post-OGTT glucose improves the early prediction of type 2 diabetes by clinical and metabolic markers. J Clin Endocrinol Metab 2019;104(4):1131–40.
- Alyass A, Almgren P, Akerlund M, Dushoff J, Isomaa B, Nilsson P, et al. Modelling of OGTT curve identifies 1 h plasma glucose level as a strong predictor of incident type 2 diabetes: results from two prospective cohorts. Diabetologia. 2015 Jan;58(1):87-97. doi: 10.1007/s00125-014-3390-x.
- Manco M, Panunzi S, Macfarlane DP, Golay A, Melander O, Konrad T, et al. One-hour plasma glucose identifies insulin resistance and β-cell dysfunction in individuals with Normal glucose tolerance: cross-sectional data from the relationship between insulin sensitivity and cardiovascular risk (RISC) study. Diabetes Care 2010;33(9):2090–7.
- Manco M, Mari A, Petrie J, Mingrone G, Balkau B. One hour post-load plasma glucose and 3 year risk of worsening fasting and 2 hour glucose tolerance in the RISC cohort. Diabetologia 2019;62(3):544–8.
- Bergman M, Chetrit A, Roth J, Jagannathan R, Sevick M, Dankner R. One-hour post-load plasma glucose level during the OGTT predicts dysglycemia: Observations from the 24year follow-up of the Israel Study of Glucose Intolerance, Obesity and Hypertension. Diabetes Res Clin Pract 2016 Oct:120:221–8.
- Selvin E, Steffes MW, Zhu H, Matsushita K, Wagenknecht L, Pankow J, et al. Glycated hemoglobin, diabetes, and cardiovascular risk in nondiabetic adults. N Engl J Med. 2010;362(9):800v11.
- Kato M, Noda M, Suga H, Matsumoto M, Kanazawa Y. Fasting plasma glucose and incidence of diabetes — implication for the threshold for impaired fasting glucose: results from the population-based Omiya MA cohort study. J Atheroscler Thromb. 2009;16(6):857-61. doi: 10.5551/jat.1792.
- Johnson SL, Tabaei BP, Herman WH. The efficacy and cost of alternative strategies for systematic screening for type 2 diabetes in the U.S. population 45-74 years of age. Diabetes Care. 2005 Feb 1;28(2):307–11.
- Monroe AK, Glesby MJ, Brown TT. Diagnosing and managing diabetes in HIV-infected patients: current concepts. Clin Infect Dis. 2015 Feb 1;60(3):453–62.
- Brown TT, Tassiopoulos K, Bosch RJ, Shikuma C, McComsey GA. Association between systemic inflammation and incident diabetes in HIV-infected patients after initiation of antiretroviral therapy. Diabetes Care. 2010;33(10):2244–9.
- Godoy-Matos AF, Valério CM, Silva Júnior WS, de Araujo-Neto JM, Bertoluci MC. 2024 UPDATE: the Brazilian Diabetes Society position on the management of metabolic dysfunction-associated steatotic liver disease (MASLD) in people with prediabetes or type 2 diabetes. Diabetol Metab Syndr. 2024 Jan 19;16(1):23. doi: 10.1186/s13098-024-01259-2.
- Musso G, Gambino R, Cassader M, Pagano G. Meta-analysis: natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity. Ann Med. 2011;43:617–49.
- Ballestri S, Zona S, Targher G, Romagnoli D, Baldelli E, Nascimbeni F, et al. Nonalcoholic fatty liver disease is associated with an almost twofold increased risk of incident type 2 diabetes and metabolic syndrome. Evidence from a systematic review and meta-analysis. J Gastroenterol Hepatol. 2016 May;31(5):936-44. doi: 10.1111/jgh.13264.
- Godoy-Matos AF, Silva Júnior WS, Valerio CM. NAFLD as a continuum: from obesity to metabolic syndrome and diabetes. Diabetol Metab Syndr. 2020 Jul 14;12:60. doi: 10.1186/s13098-020-00570-y.
- Suh S, Park MK. Glucocorticoid-induced diabetes mellitus: an important but overlooked problem. Endocrinol Metab. 2017;32(2):180.
- Imatoh T, Sai K, Hori K, Segawa K, Kawakami J, Kimura M, et al. Development of a novel algorithm for detecting glucocorticoid-induced diabetes mellitus using a medical information database. J Clin Pharm Ther. 2017 Apr;42(2):215–20.
- Holt RIG. Association between antipsychotic medication use and diabetes. Curr Diab Rep. 2019 Oct;19(10):96.
- Dabelea D. Prevalence of type 1 and type 2 diabetes among children and adolescents from 2001 to 2009. JAMA. 2014 May 7;311(17):1778–86.
- Telo GH, Cureau FV, Szklo M, Bloch KV, Schaan BD. Prevalence of type 2 diabetes among adolescents in Brazil: Findings from Study of Cardiovascular Risk in Adolescents (ERICA). Pediatr Diabetes. 2019 Jun;20(4):389–96.
- Van Name MA, Cheng P, Gal RL, Kollman C, Lynch J, Nelson B, et al. Children and adolescents with type 1 and type 2 diabetes mellitus in the Pediatric Diabetes Consortium Registries: comparing clinical characteristics and glycaemic control. Diabet Med. 2020;37(5):863–7.
- Copeland KC, Zeitler P, Geffner M, Guandalini C, Higgins J, Hirst K, et al. Characteristics of adolescents and youth with recent-onset type 2 diabetes: the TODAY cohort at baseline. J Clin Endocrinol Metab. 2011;96(1):159–67.
- Eriksson J, Franssila-Kallunki A, Ekstrand A, Saloranta C, Widén E, Schalin C, et al. Early metabolic defects in persons at increased risk for non-insulin-dependent diabetes mellitus. N Engl J Med. 1989;321(6):337–43.
- Rosenbloom AL, Silverstein JH, Amemiya S, Zeitler P, Klingensmith GJ. Type 2 diabetes in children and adolescents. Pediatr Diabetes 2009;10(Suppl. 12):17-32.
- Magge SN, Stettler N, Jawad AF, Levitt Katz LE. Increased prevalence of abnormal glucose tolerance among obese siblings of children with type 2 diabetes. J Pediatr. 2009;154(4):562–6.e1.
- Eyzaguirre F, Bancalari R, Román R, Silva R, Youlton R, Urquidi C, et al. Prevalence of components of the metabolic syndrome according to birthweight among overweight and obese children and adolescents. J Pediatr Endocrinol Metab. 2012;25(1-2):51–6.
- American Diabetes Association. Type 2 diabetes in children and adolescents. Pediatrics. 2000;105(3 Pt 1):671–80.
- Stuart CA, Gilkison CR, Smith MM, Bosma AM, Keenan BS, Nagamani M. Acanthosis nigricans as a risk factor for non-insulin dependent diabetes mellitus. Clin Pediatr (Phila). 1998;37(2):73–9.
- Shield JP, Lynn R, Wan KC, Haines L, Barrett TG. Management and 1 year outcome for UK children with type 2 diabetes. Arch Dis Child. 2009;94(3):206–9.
- Hannon TS, Arslanian SA. The changing face of diabetes in youth: lessons learned from studies of type 2 diabetes. Ann N Y Acad Sci. 2015;1353:113–37.
- Valaiyapathi B, Gower B, Ashraf AP. Pathophysiology of type 2 diabetes in children and adolescents. Curr Diabetes Rev. 2020;16(3):220–9.
- Harjutsalo V, Reunanen A, Tuomilehto J. Differential transmission of type 1 diabetes from diabetic fathers and mothers to their offspring. Diabetes. 2006 May 1;55(5):1517–24.
- Warram JH, Krolewski AS, Gottlier MS, Kahn R. Differences in risk of insulin-dependent diabetes in offspring of diabetic mothers and diabetic fathers. N Engl J Med. 1984;311:149–52.
- Couper JJ, Haller MJ, Greenbaum CJ, Ziegler AG, Wherrett DK, Knip M, Craig ME. ISPAD Clinical Practice Consensus Guidelines 2018: Stages of type 1 diabetes in children and adolescents. Pediatr Diabetes. 2018 Oct;19 Suppl 27:20–27.
- Ziegler AG, Rewers M, Simell O, Simell T, Lempainen J, Steck A, et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children. JAMA. 2013 Jun 19;309(23):2473.
- Steck AK, Vehik K, Bonifacio E, Lernmark A, Ziegler A-G, Hagopian WA, et al. Predictors of progression from the appearance of islet autoantibodies to early childhood diabetes: the environmental determinants of diabetes in the young (TEDDY). Diabetes Care. 2015 May;38(5):808–13.
- Sosenko JM, Skyler JS, Palmer JP, Krischer JP, Yu L, Mahon J, et al. The prediction of type 1 diabetes by multiple autoantibody levels and their incorporation into an autoantibody risk score in relatives of type 1 diabetic patients. Diabetes Care. 2013 Sep;36(9):2615–20.
- Herold KC, Bundy BN, Long SA, Bluestone JA, DiMeglio LA, Dufort MJ, et al; Type 1 Diabetes TrialNet Study Group. An anti-CD3 antibody, teplizumab, in relatives at risk for type 1 diabetes. N Engl J Med. 2019;381:60–613.
- Winkler C, Schober E, Ziegler AG, Holl RW. Markedly reduced rate of diabetic ketoacidosis at onset of type 1 diabetes in relatives screened for islet autoantibodies. Pediatr Diabetes 2012;13:308–313.
- Duca LM, Wang B, Rewers M, Rewers A. Diabetic ketoacidosis at diagnosis of type 1 diabetes predicts poor long-term glycemic control. Diabetes Care 2017;40:1249–1255.
- Sims EK, Besser REJ, Dayan C, Geno Rasmussen C, Greenbaum C, Griffin KJ, et al; NIDDK Type 1 Diabetes TrialNet Study Group. Screening for type 1 diabetes in the general population: A status report and perspective. Diabetes. 2022 Apr 1;71(4):610-623. doi: 10.2337/dbi20-0054.
- Phillip M, Achenbach P, Addala A, Albanese-O’Neill A, Battelino T, Bell KJ, et al. Consensus guidance for monitoring individuals with islet autoantibody-positive pre-stage 3 type 1 diabetes. Diabetes Care. 2024 Jun 24:dci240042. doi: 10.2337/dci24-0042.
Cite este artigo
Melanie Rodacki, Roberta A. Cobas, Lenita Zajdenverg, Wellington Santana da Silva Júnior, Luciano Giacaglia, Luis Eduardo Calliari, Renata Maria Noronha, Cynthia Valerio, Joaquim Custódio, Mauro Scharf, Cristiano Roberto Grimaldi Barcellos, Maithe Pimentel Tomarchio, Maria Elizabeth Rossi da Silva, Rosa Ferreira dos Santos, Bianca de Almeida-Pitito, Carlos Antonio Negrato, Monica Gabbay, Marcello Bertoluci | Diagnóstico de diabetes mellitus. Diretriz Oficial da Sociedade Brasileira de Diabetes (2024). DOI: 10.29327/5412848.2024-1, ISBN: 978-65-272-0704-7.

